Структурная функция Вещество соединительной ткани и межклеточный матрикс формируют белки коллаген
 Скачать 1.44 Mb. Скачать 1.44 Mb.
|
|
1. Белки как особый класс полимерных высокомолекулярных органических соединений. Биологические функции белков. Элементный и аминокислотный состав белков. Современные представления о структурной организации белковых молекул. Первичная структура белков. Вторичная, третичная и четвертичная структуры белков. Виды связей, стабилизирующих различные уровни структурной организации белков. Белки - высокомолекулярные азотосодержащие органические вещества молекулы которых построены из остатков аминокислот. Простые белки построены из аминокислот и при гидролизе распадаются соответственно только на аминокислоты. Сложные белки - это двухкомпонентные белки, которые состоят из какого-либо простого белка и небелкового компонента, называемого простетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождаются небелковая часть или продукты ее распада. Независимо от источника получения, белковые вещества содержат, кроме С, О и Н, обязательно N и обычно некоторое количество S. Структурная функция Вещество соединительной ткани и межклеточный матрикс формируют белки коллаген, эластин, кератин, протеогликаны. Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности). Ферментативная функцияВсе ферменты являются белками. Гормональная функцияРегуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Такие гормоны как инсулин и глюкагон являются белками, все гормоны гипофиза являются пептидами или небольшими белками. Рецепторная функцияЭта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток. Транспортная функцияТолько белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (связывание кислорода), гаптоглобин (транспорт гема), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы. Транспорт веществ через мембраны осуществляют белки - Na+,К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры. Резервная функцияВ качестве примера депонированного белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени. Сократительная функцияСуществует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин). Защитная функцияЗащитную функцию, предупреждая инфекционный процесс и сохраняя устойчивость организма, выполняют иммуноглобулины крови, факторы системы комплемента (пропердин), при повреждении тканей работают белки свертывающей системы крови - например, фибриноген, протромбин, антигемофильный глобулин. Механическую защиту в виде слизистых и кожи осуществляют коллаген и протеогликаны. К данной функции также можно отнести поддержание постоянства коллоидно-осмотического давления крови, интерстиция и внутриклеточных пространств, а также иные функции белков крови. Белковая буферная система участвует в поддержании кислотно-щелочного состояния. Принято выделять четыре уровня структурной организации белков, которые обозначаются как первичная, вторичная, третичная и четвертичная структуры белков. Первичная структура - последовательность соединения аминокислот в полипептидной цепи. В белковой молекуле при чередовании жестких (пептидная связь) и гибких (α -углеродный атом) участков формируется компактная укладка цепи в пространстве. Вторичная структура -регулярно повторяющаяся форма укладки полипептидной цепи в пространстве. Чаще всего в белках встречается 2 вида вторичной структуры: α - спираль и β - структура. Стабилизируют водородные связи. Третичная структура - специфическая для каждого белка форма укладки полипептидной цепи в пространстве. Данная структура формируется самопроизвольно и определяется первичной структурой. Третичная структура значительно, в десятки увеличивает компактность белка. В формировании третичной структуры участвуют нековалентные связи (гидрофобные, ионные) и ковалентные (дисульфидные) связи. Третичная структура определяет биологическую активность и физико-химические свойства белков. При нарушении третичной структуры белок утрачивает свою биологическую активность. Четвертичная структура - количество и взаимное расположение субъединиц в олигомерных белках. Четвертичную структуру имеют только олигомерные белки, в составе которых имеется несколько субъединиц, протомеров. Протомером считается отдельная полипептидная цепь, субъединицей – функционально активная часть олигомерного белка. Субъединица может содержать один протомер или несколько протомеров. В формировании четвертичной структуры участвуют непрочные нековалентные связи (гидрофобные, ионные, водородные). 2.Физико-химические свойства белков: гидрофильность, растворимость, ионизация, изоэлектрическая точка. Денатурация и высаливание белков, их физико-химическая сущность, практическое значение. Электрические свойства белков определяются присутствием на их поверхности положительно и отрицательно заряженных аминокислотных остатков. Наличие заряженных группировок белка определяет суммарный заряд белковой молекулы. Если в белках преобладают отрицательно заряженные аминокислоты, то его молекула в нейтральном растворе будет иметь отрицательный заряд, если преобладают положительно заряженные – молекула будет иметь положительный заряд. Суммарный заряд белковой молекулы зависит и от кислотности (рН) среды. При увеличении концентрации ионов водорода (увеличении кислотности) происходит подавление диссоциации карбоксильных групп: и в то же время увеличивается число протонированных амино-групп; Таким образом, при увеличении кислотности среды происходит уменьшение на поверхности молекулы белка числа отрицательно заряженных и увеличение числа положительно заряженных групп. Совсем другая картина наблюдается при снижении концентрации ионов водорода и увеличении концентрации гидроксид-ионов. Число диссоциированных карбоксильных групп возрастает и снижается число протонированных аминогрупп Итак, изменяя кислотность среды, можно изменить и заряд молекулы белка. При увеличении кислотности среды в молекуле белка снижается число отрицательно заряженных группировок и увеличивается число положительно заряженных, молекула постепенно теряет отрицательный и приобретает положительный заряд. При снижении кислотности раствора наблюдается противоположная картина. Очевидно, что при определенных значениях рН молекула будет электронейтральной, т.е. число положительно заряженных групп будет равно числу отрицательно заряженных групп, и суммарный заряд молекулы будет равен нулю (рис. 14). Значение рН, при котором суммарный заряд белка равен нулю, называется изоэлектрической точкой и обозначается pI. 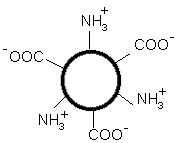 Изоэлектрическая точка для большинства белков находится в области рН от 4,5 до 6,5. При значениях рН ниже изоэлектрической точки белок несет суммарный положительный заряд, выше – суммарный отрицательный. В изоэлектрической точке растворимость белка минимальна, так как его молекулы в таком состоянии электронейтральны и между ними нет сил взаимного отталкивания, поэтому они могут «слипаться» за счет водородных и ионных связей, гидрофобных взаимодействий, ван-дер-ваальсовых сил. При значениях рН, отличающихся от рI, молекулы белка будут нести одинаковый заряд - либо положительный, либо отрицательный. В результате этого между молекулами будут существовать силы электростатического отталкивания, препятствующие их «слипанию», растворимость будет выше. Растворимость белков Белки бывают растворимые и нерастворимые в воде. Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и других факторов и определяется природой тех групп, которые находятся на поверхности белковой молекулы. К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (щелк, паутина). Многие другие белки растворимы в воде. Растворимость определяется наличием на их поверхности заряженных и полярных группировок (-СОО-, -NH3+, -OH и др.). Заряженные и полярные группировки белков притягивают к себе молекулы воды, и вокруг них формируется гидратная оболочка (рис. 15), существование которой обусловливает их растворимость в воде.  Высаливание – этообратимое осаждение белков под действием концентрированных нейтральных солей (Na2SO4, (NH4)2SO4). Механизм высаливания заключается во взаимодействии анионов (SO42-) и катионов (Na+, NH4+) с зарядами белка (группы NH4+ и COO–). В результате заряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновременно резко уменьшается гидратная оболочка. Все это приводит к "слипанию" молекул и осаждению. Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции. 1. Физическая денатурацияВызывается повышением температуры, ультрафиолетовым и микроволновым излучением, механическими воздействиями, ионизацией заряженными частицами. 2. Химическая денатурация (кислоты, щелочи, тяжелые металлы)3. Биологические факторы 3. Ферменты. Современные представления о химической природе ферментов. Проферменты, изоферменты, мультиферментнык комплексы Ферменты – это белки , которые действуют как катализаторы в биологических системах. По химической природе ферменты являются белками и подразделяются на простые и сложные. Простые ферменты при гидролизе расщепляются до аминокислот. Примеры простых ферментов: трипсин, уреаза, рибонуклеаза. Большинство природных ферментов относится к сложным белкам, содержащим кроме белкового компонента, называемого апоферментом, и небелковую часть - кофактор. Апофермент и кофактор отдельно друг от друга не могут обеспечивать катализ химической реакции. Объединение их дает активную молекулу фермента - холофермент. Изоферменты - это разновидности одного и того же олигомерного фермента, катализирующие одну и ту же реакцию, но различающиеся между собой физическими и химическими свойствами. Одним из наиболее изученных олигомерных ферментов является лактатдегидрогеназа (ЛДГ), представляющий собой тетрамер (т.е. состоящий из 4-х субъединиц). ЛДГ катализирует обратимое превращение пировиноградной кислоты в молочную. ЛДГ существует в виде 5 изоферментов, которые образуются в результате различного сочетания субъединиц 2-х типов: H (сердечного) и М (мышечного): ЛДГ1 - Н4 ЛДГ2 - Н3М ЛДГ3 - Н2М2 ЛДГ4 - НМ3 ЛДГ5 - М4 Например, ЛДГ1 преобладает в сердечной мышце, а ЛДГ5 - в печени. Изучение картины изоферментного спектра широко используется в клинической диагностике, что позволяет определить характер патологического процесса, а также контролировать ход лечения. Так, при инфаркте миокарда в плазме крови будут преобладать изоферменты ЛДГ с Н-типом субъединиц, а при воспалительных процессах печени - М-типа. Мультиферментные комплексы это надмолекулярные образования которые включают, несколько ферментов и коферментов, работающих по принципу конвейера. Биологическое значение мультиферментных комплексов состоит в том, что благодаря их существованию облегчается перенос реагирующих веществ между отдельными фермен тами и коферментами, что ускоряет протекание реакций. Профермент — неактивный предшественник фермента. Другие названия: зимоген, проэнзим, энзимоген. Физиологический смысл проферментов заключается в том, чтобы ткани, продуцирующие ферменты, не подвергались воздействию этих самых ферментов. Поэтому акт продукции фермента (профермента) отделен от акта его активации — превращения в фермент. И поэтому проферменты, в основном, встречаются у протеолитических ферментов 2.Холоферменты, строение. Кофакторы ферментов, химическая природа, роль в биологическом катализе. Коферменты и простетические группы. Их связь с витаминами. Ионы металлов как важные кофакторы многих ферментов. Номенклатура и классификация ферментов. Характеристика основных классов ферментов. 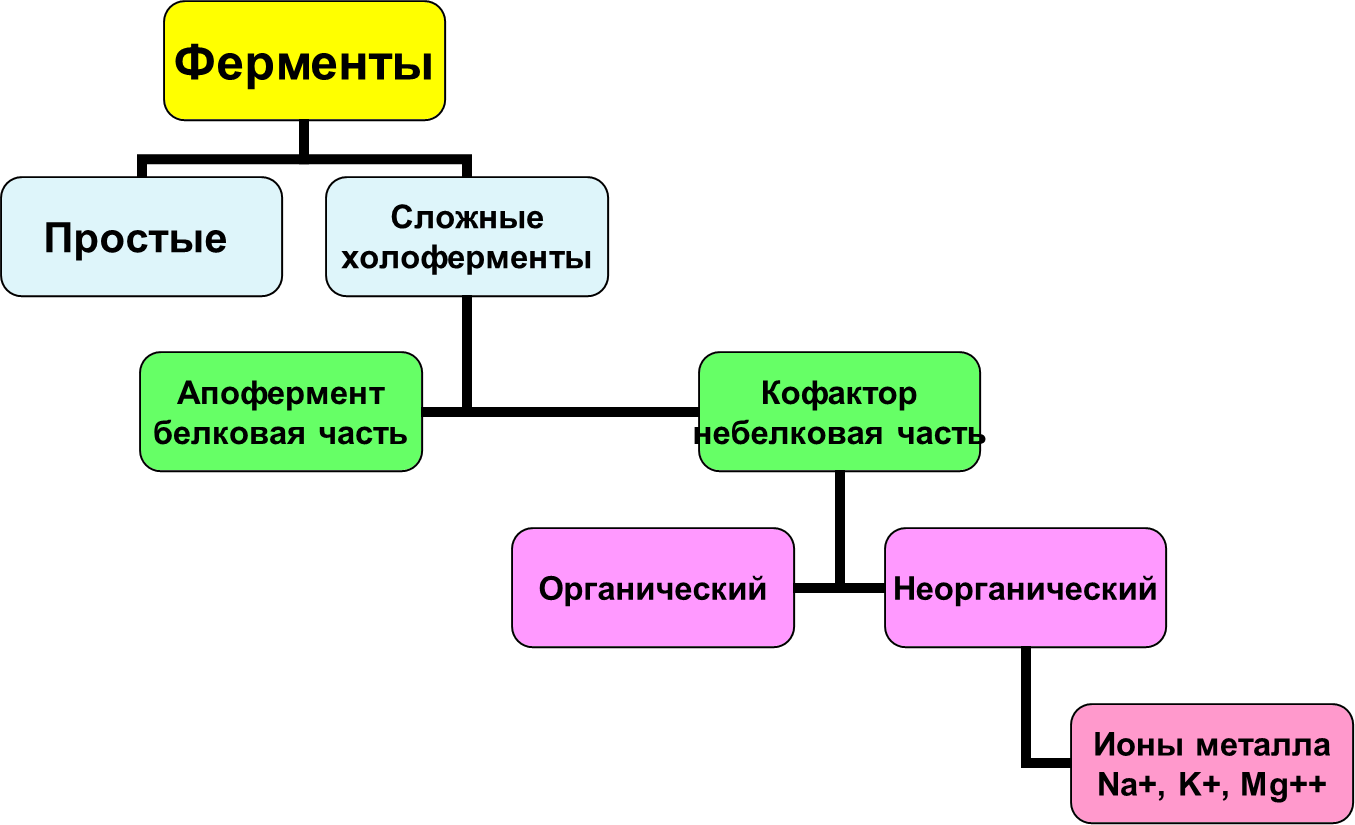 Апофермент- белковая часть сложного фермента Термолабилен Определяет специфичность фермента Не принимает непосредственное участие в катализе Кофактор- небелковая часть Свойства: Термостабилен Принимает непосредственное участие в катализе Придает молекуле фермента конформационную устойчивость Органические кофакторы Производные витаминов Невитаминной природы РР, В1 , В2 , В6, Вс - Нуклеотиды (АТФ, ГТФ) - Порфирины (гем) - Пептидной природы (глутатион) - Амид липоевой кислоты Неорганические – ионы металлов - Ca2+ Zn2+ Na+ 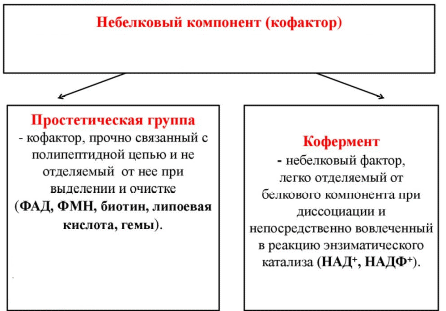 Современная классификация ферментов базируется на характеристике катализируемых химических реакций. На этом основании выделено 6 основных групп (классов) энзимов: Оксидоредуктазы осуществляют реакции окислительно-восстановительного характера, ответственны за перенос протонов и электронов. Реакции проходят по схеме А восстановлен + В окислен = А окислен + В восстановлен, где исходные вещества А и В являются субстратами фермента. Трасферазы катализируют межмолекулярный перенос химических групп (кроме атома водорода) с одного субстрата на другой (A-X + B = A + BX). Гидролазы ответственны за расщепление (гидролиз) внутримолекулярных химических связей, образованных с участием воды. Лиазы отщепляют от субстрата химические группы по негидролитическому механизму (без участия воды) с формированием двойных связей. Изомеразы осуществляют межизомерные превращения. Лигазы катализируют соединение двух молекул, которое сопряжено с разрушением макроэргических связей (например, АТФ). Механизм действия ферментов. Образование фермент-субстратных комплексов. Общие представления об активных центрах ферментов, их химической структуре, свойствах активного центра. Функциональная организация ферментного белка Активный центр – это небольшой участок в трехмерной пространственной организации простого или сложного фермента, к которому присоединяется субстрат, и в котором протекает химическая реакция Свойства Это очень небольшой участок в молекуле фермента. Формируется на уровне третичной структуры (10-16 АМК), представляет собой объемное трехмерное образование Это «щель» в молекуле фермента, куда не попадает вода, за исключением тех реакций, когда вода непосредственный участник химической реакции. Активный центр слабо связывается с субстратом за счет нековалентного взаимодействия (10 -15 Å). Специфичен по отношению к субстрату, который комплементарен ему по форме Активный центр – это нежесткая структура, способная несколько изменять свою конформацию при взаимодействии с субстратом идет процесс «индукция соответствия» по теории Кошланда  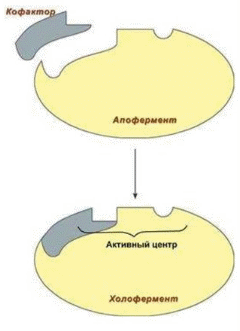 В активном центре выделяют два участка: якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре, каталитический – непосредственно отвечает за осуществление реакции. Аллостерический центр – это участок, пространственно удаленный от активного центра и служащий для присоединения низкомолекулярных веществ, несходных по строению с субстратом и изменяющих активность фермента Механизм действия ферментов Ферменты увеличивают скорость химической реакции за счет снижения величины энергии активации (Еакт). Энергия активации – это дополнительная энергия, которую нужно сообщить молекулам реагирующих веществ для того, чтобы они смогли преодолеть энергетический барьер реакции, достичь переходного состояния (ПС) и стать реакционноспособными. Стадии I. Образование фермент-субстратного комплекса Е+S = ЕS II. Преобразование фермент-субстратного комплекса ЕS = ЕS* III.Образование продукта реакции ЕS* = ЕР = Е+Р Свойства ферментов как биологических катализаторов: высокая катали-тическая активность, специфичность действия. Зависимость активности ферментов от температуры и рН среды: биологическое и медицинское значение этих свойств. Свойства ферментов Высокая каталитическая активность; Высокая специфичность действия; Термолабильность; Зависимость активности фермента от рН среды; Ферменты работают в «мягких условиях»; Активность ферментов можно регулировать. Специфичность (избирательность) действия ферментов выражается в их способности катализировать строго определенную реакцию, действовать на определенный субстрат (или группу субстратов) или даже на определенную связь в этом субстрате без образования в итоге побочных продуктов. Абсолютная специфичность – это такой вид специфичности, при котором фермент действует только на один субстрат  Стереохимическая специфичность – это такой вид специфичности, когда фермент действует на определенный стереоизомер Пример: фермент фумараза действует только на транс-изомер фумаровой кислоты, но не на цис-изомер Относительная групповая субстратная специфичность – это такой вид специфичности, когда фермент действует на группу субстратов, имеющих один и тот же тип химической связи (ферменты: пептидазы, гликозидазы, эстеразы) Относительная субстратная специфичность - это такой вид специфичности, когда фермент действует на разные субстраты, но тип катализируемой реакции одинаков (цитохром Р- 450) Термолабильность – это свойство фермента, которое определяет зависимость активности фермента от температуры. Для большинства ферментов температурный оптимум составляет 37-40 градусов 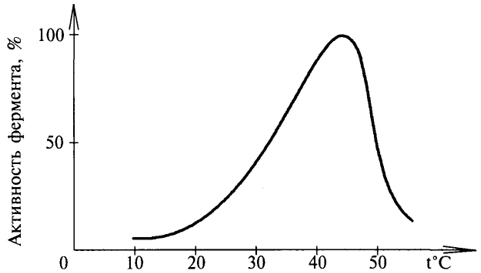 Свойство фермента – изменять свою активность в зависимости от рН среды  Активаторы и ингибиторы ферментов. Механизм их действия. Обратимое и необратимое, конкурентное и неконкурентное ингибирование. Использование принципа конкурентного ингибирования в медицине. Активирование- увеличение активности ферментов: изостерическое и аллостерическое  Механизмы активации 1.Частичный протеолиз Диссоциация неактивного комплекса 3. Фосфорилирование - дефосфорилирование ферментов Механизмы ингибирования: Необратимое ингибирование Специфическое ингибирование;  2 . Неспецифическое ингибирование;  Обратимое ингибирование Конкурентное ингибирование 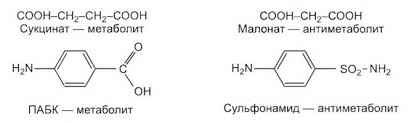 2.Неконкурентное ингибирование  Структурная организация ферментов в клетке. Принципы обнаружения, ферментов. Основы клинической ферментологии. Энзимопатология, энзимодиагностика, энзимолечение. Связь клинической ферментологии со стоматологией. Одним из принципиальных отличий ферментов от катализаторов небиологического происхождения является кооперативный характер их действия. На уровне одиночной молекулы фермента кооперативный принцип реализуется в тонком взаимодействии субстратного, активного и аллостерического центров. Однако гораздо большее значение имеет кооперативное осуществление реакций на уровне ансамблей ферментов. Именно благодаря наличию систем ферментов — в виде мультиэнзимных комплексов или еще более сложных образований — метаболонов, обеспечивающих каталитические превращения всех участников единого метаболического цикла — в клетках с большой скоростью осуществляются многостадийные процессы как распада, так и синтеза органических молекул. Ферментативный катализ в многостадийных реакциях идет без выделения промежуточных продуктов: только возникнув, они тут же подвергаются дальнейшим преобразованиям. Энзимопатология – это изучение различных нарушений активности ферментов при развитии тех или иных заболеваний с целью наиболее глубокого понимания сущности соответствующего заболевание то-есть изучает каковы ферментативные основы того или иного заболевания. Почти все заболевания имеют в своей основе нарушение активности ферментов, то-есть это энзимопатии. Энзимодиагностика – изучение активности ферментов для диагностики заболеваний. В ряде случаев в крови, моче, других биологических жидкостях и тканях отмечают наличие органоспецифических ферментов, хотя, правильнее сказать, что абсолютной органоспецифичности нет, есть большее количество фермента. Например, для печени органоспецифичен фермент глюкоза – 6 – фосфатаза, для поджелудочной железы – трипсин, химотрипсин и т.д. , для костной ткани – щелочная фосфатаза. Часто для диагностики важны не только органоспецифические ферменты, но и те, количество которых при определенных заболеваниях значительно возрастает (например, аминотрансферазы переносят аминогруппы, при ИБС поражениях печени их активность резко возрастает). Определение активности этих ферментов используют и для дифференциальной диагностики. Например, при инфаркте миокарда их активность увеличивается, а при стенокардии не увеличивается. |
