Биохимия. 22. Метаболизм фосфолипидов (ФЛ). Обмен глицерофосфолипидов. Биологическое значение различных фосфолипаз. Биосинтез фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина
 Скачать 231.67 Kb. Скачать 231.67 Kb.
|
|
22. Метаболизм фосфолипидов (ФЛ). Обмен глицерофосфолипидов. Биологическое значение различных фосфолипаз. Биосинтез фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина. Метаболизм фосфолипидов. Внутриклеточные фосфолипиды расщепляются лизосомальными фосфолипазами (ФЛаза) А1, А2, С, Д. Из фосфолипаз заслуживают внимания: ФЛаза А2, которая от второго углеродного атома глицерина отщепляет полиненасыщенные ЖК (арахидоновую кислоту), участвующую в биосинтезе эйкозаноидов. ФЛаза А2, содержащаяся в яде змей, при укусе отщепляет ПНЖК и в результате образуются лизофосфатиды, вызывающие гемолиз эритроцитов. ФЛазаС, которая в цитоплазматической мембране расщепляет фосфатидилинозитол-4,5-бисфосфат (ФИФ2), образующийся из фосфатидилинозитола (ФИ), на два вторых посредника – ДАГ(диацилглицерол ) и ИФ3 (инозитол-1,4,5-трисфосфат). 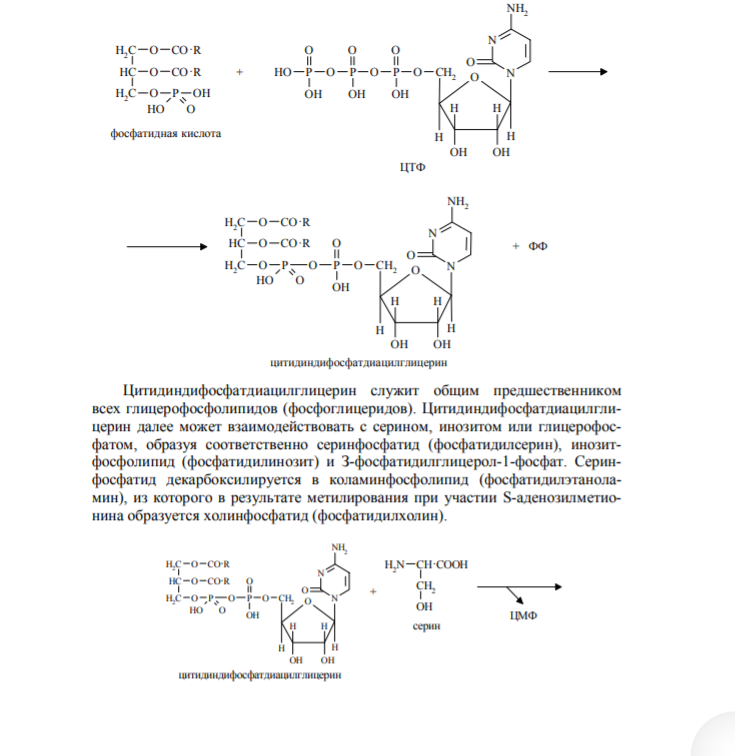 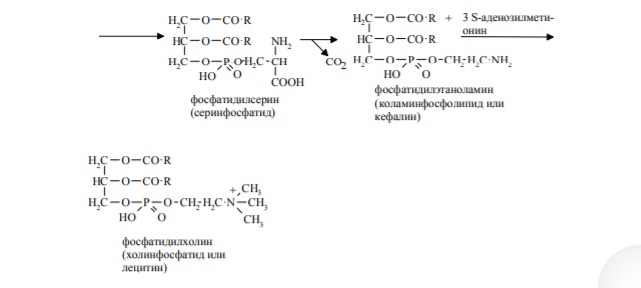 23. Обмен сфинголипидов. Синтез церамина и его производных. Катаболизм сфингомиелина и гликосфинголипилдов, генетические дефекты энзимов. 23. Обмен сфинголипидов. Синтез церамина и его производных. Катаболизм сфингомиелина и гликосфинголипилдов, генетические дефекты энзимов.Синтез сфинголипидов начинается с образования церамида. Серин конденсируется с пальмитоил-КоА. Продукт их взаимодействия сначала восстанавливается коферментом NADPH, затем к аминогруппе дигидросфингозина амидной связью присоединяется жирная кислота, содержащая, как правило, 24 атома углерода. После окисления FAD-зависимой дегидрогеназой образуется церамид. Церамид служит предшественником в синтезе большой группы сфинголипидов: сфингомиелинов, не содержащих углеводов, и гликосфинголипидов (рис. 8-62). Последующие реакции синтеза катализируются специфическими трансферазами, набор которых отличается в разных тканях. Соединение фосфорилхолина с церамидом сфингомиелин-синтазой приводит к образованию сфингомие-лина. Присоединение углеводных компонентов катализируется специфическими гликозилтрансферазами. Донорами углеводных компонентов служат активированные сахара: УДФ-галактоза и УДФ-глюкоза. Галактоцереброзид - главный липид миелиновых оболочек; глюкоцереброзид входит в состав мембран многих клеток и служит предшественником в синтезе более сложных гликолипидов или продуктом на пути их катаболизма. В лизосомах находятся ферменты, способные гидролизовать любые компоненты клеток. Эти ферменты называют кислыми гидролазами, так как они активны в кислой среде. Значение рН = 5, оптимальное для работы ферментов, создаётся протонным насосом, который, используя энергию АТФ, накачивает ионы водорода в лизосомы. Катаболизм сфингомиелинов и гликолипидов происходит в лизосомах. В распаде сфингомиелинов участвуют 2 фермента - сфингомиелиназа, отщепляющая фосфорилхолин, и церамидаза, продуктами действия которой являются сфингозин и жирная кислота. Генетический дефект сфингомиелиназы - причина болезни Ниманна-Пика. Дети с таким дефектом погибают в раннем возрасте. Симптомы заболевания: увеличение печени и селезёнки (гепатоспленомегалия), в лизосомах которых накапливается сфингомиелин; умственная отсталость. Катаболизм гликосфинголипидов начинается с перемещения их с поверхности клетки в цитоплазму по механизму эндоцитоза. В результате молекулы, расположенные на поверхности мембран, оказываются в эндоцитозных везикулах в цитоплазме и сливаются с лизосомами. В лизосомах находятся все ферменты, необходимые для гидролиза сложных молекул гликосфинголипидов: α- и β-галактозидазы, β-глюкозидазы, нейраминидаза (сиалидаза) и церамидаза. В результате последовательных реакций гидролиза сложные молекулы гликосфинголипидов распадаются до мономеров: глюкозы, галактозы, жирной кислоты, сфингозина и других метаболитов. Если имеется генетический дефект какого-либо лизосомного фермента, участвующего в катаболизме гликосфинголипида, то в лизосомах накапливается не-деполимеризованный субстрат, так называемые "остаточные тельца", размеры лизосом увеличиваются, их мембрана может разрушаться, ферменты выходят в цитозоль, и функции клеток нарушаются. Генетические заболевания вследствие дефекта какого-либо из ферментов катаболизма гликосфинголипидов называют сфинголипидоза-ми, или лизосомными болезнями. Эти заболевания редки, но среди некоторых популяций людей их частота очень высока. Кетоновые тела. Биосинтез, использование в качестве источника энергии. Биохимический механизм кетонемии и кетонурии. К кетоновым телам относят бетта-гидроксибутират, ацетоацетат и ацетон. Первые две молекулы могут окисляться в тканях, обеспечивая синтез АТФ. Синтез кетоновых тел начинается с взаимодействия двух молекул ацетил-КоА, которые под действием фермента тиолазы образуют ацетоацетил-КоА (рис. 8-33). С ацетоацетил-КоА взаимодействует третья молекула ацетил-КоА, образуя З-гидрокси-З-метилглутарил-КоА (ГМГ-КоА). Эту реакцию катализирует фермент ГМГ-КоАсинтаза. Далее ГМГ-КоА-лиаза катализирует расщепление ГМГ-КоА на свободный ацетоацетат и ацетил-КоА. Ацетоацетат может выделяться в кровь или превращаться в печени в другое кетоновое тело — р-гидроксибутират путём восстановления. В клетках печени при активном р-окислении создаётся высокая концентрация NADH. Это способствует превращению большей части ацетоацетата в р-гидроксибутират, поэтому основное кетоновое тело в крови — именно р-гидроксибутират. При голодании для многих тканей жирные кислоты и кетоновые тела становятся основными топливными молекулами. Глюкоза используется в первую очередь нервной тканью и эритроцитами. При высокой концентрации ацетоацетата часть его неферментативно декарбоксилируется, превращаясь в ацетон. норме концентрация кетоновых тел в крови составляет 1-3 мг/дл (до 0,2 мМ/л), но при голодании значительно увеличивается. Увеличение концентрации кетоновых тел в крови называют кетонемией, выделение кетоновых тел с мочой - кетонурией. |
