3 алкены. 3 Алкены А. И. Кузнецов
 Скачать 1.11 Mb. Скачать 1.11 Mb.
|
1 2 3 Алкены А. И. Кузнецов 26.10.10 Оглавление 1. Получение 2 А. Дегидрирование алканов 2 Б. Дегидратация спиртов 2 В. Дебромирование вицинальных дибромидов 3 Г. Дегидрогалогенирование алкилгалогенидов 3 2 Електрофильное присоединение 4 2.1. Присоединение галогеноводородов (гидрогалогенирование) 4 2.2. Гидратация 6 2.3. Присоединение спиртов 7 2.4 Галогенирование 8 А. Присоединение HOCl и HOBr 10 3. Радикальное присоединение 11 А. Галогенирование 11 Б. Гидробромирование 11 В. Присоединение тиолов 12 4. Аллильное галогенирование 12 5. Метатезис 12 6. Окисление алкенов 15 6.1. Эпоксидирование 15 6.2. Гидроксилирование 17 6.3. Озонолиз алкенов 18 6.4. Окисление алкенов в жестких условиях 20 А. Окисление этилена в ацетальдегид 20 Б. Хлорокисление этилена 20 В. Окислительный аммонолиз 20 8. Присоединение карбенов 22 А. Дихлоркарбен 23 Б. Метилен 25 В. Реакция Симонса-Смита 25 9. Плимеризация алкенов 26 А. Радикальная полимеризация 26 Б. Катионная полимеризация алкенов 27 В. Координационная полимеризация 27 Г. Метотезисная полимеризация с раскрытием цикла 30 Е. Телломеризация 31 3. Алкены Углеводороды, содержащие в молекуле двойную углерод-углеродную связь (-связь), называют алкенами, олефинами или этиленовыми углеводородами. 1. Получение Главным промышленным источником этилена и других, низших алкенов является крекинг нефтепродуктов. А. Дегидрирование алканов Дополнительное количество этилена и других алкенов может быть получено дегидрированием этана и низших алканов. Дегидрирование алканов является обратимым высокотемпературным каталитическим процессом и используется главным образом в промышленности. В качестве катализаторов дегидрирования применяют оксиды металлов (Cr2O3, Fe2O3, ZnO и др.), а также металлы (Pt, Pd, Ni, Fe). Б. Дегидратация спиртовВ лаборатории алкены обычно получают из спиртов. При их нагревании с серной или фосфорной кислотой они отщепляют воду. Условия проведения реакции зависят от строения спирта. Наиболее трудно дегидратируются первичные спирты, наиболее легко – третичные. Первичные спирты дегидратируются при 170 200оС с использованием концентрированной серной кислоты. Дегидратация вторичных спиртов происходит при температуре 100 150оС с менее концентрированными кислотами. Отщепление воды протекает согласно эмпирическому правилу Зайцева: протон отщепляется предпочтительно от наименее гидрогенизирован-ного -атома углерода. Иными словами, двойная связь образуется у наиболее замещенного атома углерода:  (3) (3)2-бутанол 2-бутен Еще легче отщепляют воду третичные спирты 80 100оС в присутствии более мягких дегидратирующих агентов (разбавленная серная кислота, щавелевая или п-толуолсульфоновая кислота):  (4) (4)2-метил-2-пропанол 2-метилпропен В. Дебромирование вицинальных дибромидовПри действии на виц-дибромиды цинковой пылью в уксусной кислоте или в спирте происходит отщепление атомов брома по типу реакции Вюрца с образованием алкена:  (5) (5)Аналогичный результат достигается при действии на дибромид йодидом калия в ацетоне при нагревании.  (6) (6)виц-Дибромиды получают бромированием алкенов, и поэтому эта реакция не имеет препаративного значения, но с ее помощью можно очищать алкены или «защищать» двойную связь при проведении реакций с другими группами. Г. Дегидрогалогенирование алкилгалогенидов Алкены могут быть получены дегидрогалогенированием алкилгалогенидов (раздел 6.2). При использовании в качестве дегидрогалогенирующих агентов спиртового раствора щелочи или этоксида натрия в этаноле реакция проходит по правилу Зайцева и образуется более замещенный алкен. Если же необходимо получить менее замещенный алкен (по правилу Гофмана), то в качестве дегидрогалогенирующего агента следует использовать трет-бутоксид калия в трет-бутаноле.  (7) (7) (8) (8)2. Електрофильное присоединение (АЕ) Характерными реакциями алкенов являются реакции присоединения (А), при которых "половина" двойной связи рвется, и по освободившимся валентностям углерода присоединяются две новые группы с образованием насыщенного соединения. Атакующей частицей в этих реакциях является электрофил. Реакции электрофильного присоединения часто начинаются со стадии образования -комплекса. Эта реакция не влияет на скорость всего процесса и обычно в схемах механизмов опускается. 2.1. Присоединение галогеноводородов (гидрогалогенирование) Галогеноводороды легко присоединяются к алкенам с образованием алкилгалогенидов: этен (этилен) бромэтан (этилбромид) Присоединение галогенуглеводородов к несимметричным алкенам происходит по правилу Марковникова, то-есть водород присоединяется к атому углерода с наибольшим числом атомов водорода:  (10) (10)пропен (пропилен) 2-хлорпропан (изопропилхлорид) Реакция проходит по механизму АЕ: В статическом, т.е. нереагирующем состоянии, в молекуле пропена под действием электронодонорной метильной группы происходит поляризация электронной плотности -связи, приводящая к возникновению частичных зарядов (статический фактор), определяющих место будущей атаки протоном. При разрыве -связи образуется ковалентная связь между протоном и одним из атомов углерода двойной связи. У другого атома углерода остается вакантная орбиталь, и атом приобретает положительный заряд. В динамическом состоянии, т.е. в процессе реакции, из двух возможных карбокатионов будет образовываться более стабильный (динамический фактор).  В современном виде правило Марковникова можно сформулировать следующим образом: при ионном присоединении несимметричного реагента к двойной связи несимметричного алкена его положительная часть присоединяется к атому углерода с образованием наиболее стабильного карбокатиона. Упр. 1. Напишите реакции хлороводорода с (а) 2-метилпропеном (изобутиленом), (б) метилиденциклогексаном, (в) 1-метилциклогексеном и опишите их механизм. Ответ (а) 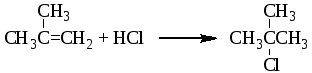 (11) (11)2-метилпропен 2-метил-2-хлорпропан (изобутилен) (трет-бутилхлорид) Механизм АЕ:   (б)  (12) (12)метилиденциклогексан 1-метил-1-хлорциклогексан Практически эти реакции осуществляются путем растворения галогенводородов в уксусной кислоте и прибавления к раствору алкена или газообразный галогеноводород подают в жидкий алкен. Присоединение хлороводорода к 3,3-диметил-1-бутену приводит к образованию двух продуктов: 2,2-диметил-3-хлорбутана и 2,3-диметил-2-хлорбутана:  (13) (13)Этот факт объясняется тем, что образующиеся в качестве промежуточных частиц карбокатионы склонны к перегруппмровкам, при которых менее стабильные катионы превращаются в более стабильные:  2.2. Гидратация При взаимодействии алкена с разбавленным водным раствором кислоты образуется спирт. Реакция присоединения воды к алкенам, называемая гидратацией, используется в промышленности для получения спиртов из продуктов нефтепереработки. Присоединение протекает по правилу Марковникова. Условия проведения реакции зависят от природы алкена. Скорость гидратации возрастает с увеличением разветвленности алкена:  (15) (15)2-метилпропен 2-метил-2-пропанол  (16) (16)пропен 2-пропанол Механизм АЕ:   Поскольку гидратация проходит через стадию образования карбокатиона она может сопровождаться перегруппировкой. 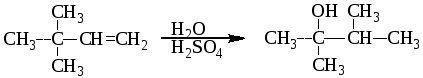 (17) (17)3,3-диметил-1-бутен 2,3-диметил-2-бутанол Механизм АЕ:     Упр. 2. Завершите реакции и опишите их механизмы: (а)  (б) (б)  Ответ (а)  (18) (18)Механизм АЕ:  2.3 Присоединение спиртов При растворении 2-метилпропена (изобутилена) в метаноле, в котором растворено небольшое количество сильной кислоты, образуется трет-бутилметиловый эфир СН3ОС(СН3)3.  (19) (19)Механизм АЕ:   2.4. Галогенирование Алкены легко присоединяют бром и хлор (йод значительно менее активен), образуя вицинальные дигалогениды:  (20) (20)1,2-дибромэтан Бромирование является удобной качественной реакцией обнаружения кратной связи С=С. Механизм бромирования алкенов АЕ:  бромоний карбокатион больший вклад меньший вклад   Реакция проходит как анти присоединение. При бромировании циклогексена первоначально образуется транс-диаксиальный конформер, который далее конвертируется в более стабильный транс-диэкваториальный конформер. 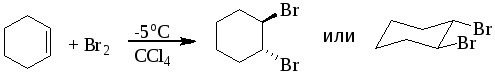 (21) (21)транс-1,2-дибромциклогексан  транс-диаксиальный транс-диэкваториальный (более стабильный) В случае бромирования 4-трет-бутилциклогексена транс-диаксиальный конформер далее не конвертируется в транс-диэкваториальный конформер, т.к. трет-бутил не может занимать аксиальное положение.  (22) (22)4-трет-бутилциклогексен 1,2-дибром-4-трет-бутилциклогексан Реакция идет тем быстрее, чем сильнее электрофил (F2> Cl2> Br2 > I2). Скорость галогенирования возрастает с увеличением разветвленности алкена. При бромирования цис-2-бутена образуется рацемическая смесь (2R,3R)- и (2S,3S)-2,3-дибромбутанов, а транс-2-бунена – мезо форма (2R,3S)-2,3-дибромбутана.  (23) (23) (24) (24)мезо форма Упр. 3. Завершите реакции показав стереохимию продуктов реакции. (а)  (б) (б)  (в)  1 2 |
