Методичка по Молекулярной биологии. 4. Структура и функции ДНК и рнк. Контрольные вопросы
 Скачать 275 Kb. Скачать 275 Kb.
|
|
СОДЕРЖАНИЕ: 1. История изучения нуклеиновых кислот. Методы молекулярной биологии………………3 2. Строение нуклеиновых кислот. Нуклеопротеиды…………………………………………..6 Работа №1. Гидролиз нуклеопротеидов……………………………………………………..8 Работа №2. Выделение дезоксирибонуклеопротеидов (ДНП) из тканей………………...10 3. Синтез нуклеотидов. Распределение нуклеотидов в организме………………………….11 4. Структура и функции ДНК и РНК. Контрольные вопросы………………………………13 5. Количественное определение нуклеиновых кислот………………………………………14 Работа №3. Количественное определение нуклеиновых кислот в крови…………….......- Работа №4. Спектрофотометрическое определение суммарного содержания нуклеиновых кислот в тканях органов………………………….15 Работа №5. Количественное определение ДНК колориметрическим методом…………16 Работа №6. Количественное определение РНК колориметрическим методом………….17 Контрольные вопросы……………………………………………………………………….18 6. Структура генома. Экспрессия генов. Контрольные вопросы……………………………19 Литература………………………………………………………………………………………20 ИСТОРИЯ ИЗУЧЕНИЯ НУКЛЕИНОВЫХ КИСЛОТ. МЕТОДЫ МОЛЕКУЛЯРНОЙ БИОЛОГИИ. ПЛАН: 1. Молекулярная биология как наука. Возникновение. 2. Задачи молекулярной биологии. 3. Основополагающие открытия молекулярной биологии. Основной постулат. 4. Взаимосвязь молекулярной биологии с другими науками. 5. Возникновение новых наук – геномики и протеомики. Создание банков генов. 6. Методы молекулярной биологии: - микроскопия; - рентгеноструктурный анализ; - использование радиоактивных изотопов; - ультрацентрифугирование; - хроматография; - электрофорез; - изоэлектрофокусирование; - метод культуры клеток; - бесклеточные системы; - моноклональные антитела и др. ____________________________ «Молекулярная биология изучает связь структуры биологических макромолекул и основных клеточных компонентов с их функцией, а также основные принципы и механизмы саморегуляции клеток, которые опосредуют согласованность и единство всех протекающих в клетке процессов, составляющих сущность жизни» - Дж. Уотсон, 1968 г. Задачи молекулярной биологии:
Этапы: 1) Ф. Мишер (F. Miesher) впервые выделил ДНК (1869г.); А.Н. Белозерский выделил ДНК из растений. 2) 50-е годы XX века - получены данные об элементарном строении белков и нуклеиновых кислот. 3) 60-е - 70-е гг. XX века – раскрыта природа и основные пути передачи и реализации генетической информации. Сформулирован основной постулат. 4) 70-е - 80-е гг. XX века – изучение механизмов сплайсинга, открытие РНК-ферментов и аутосплайсинга, изучение механизмов генетической рекомбинации, начинаются работы по расшифровке структуры геномов высших организмов, возникает белковая инженерия; организация банков генов. 5) 90-е гг. XX века – начало XXI века – развитие биоинформатики; определение нуклеотидных последовательностей (секвенирование) ДНК различных организмов: 1995г. – секвенирован первый бактериальный геном, 1997г. – геном дрожжей, 1998г. – геном нематоды, 2000г. – геном дрозофилы, 2001г. – почти полностью геном человека. В середине 60-х гг. XX века окончательно сформирован основной постулат молекулярной генетики, формулирующий магистральный путь реализации генетической информации в клетке: ДНК → РНК → белок И был дополнен представлениями о существовании процесса обратной транскрипции (о биосинтезе ДНК на матрице РНК) и репликации РНК: 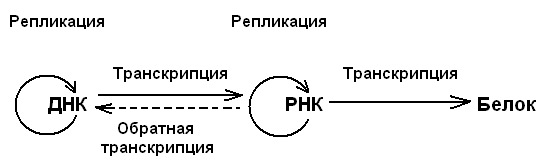 Заполните таблицу:
Постепенно молекулярная биология становится в центре наук, составляющих современную физико-химическую биологию: Физико-химическая биология     Биохимия Биофизика Молекулярная биология       Биоорганическая химия В начале 80-х годов XX века возникла новая наука – биоинформатика – на стыке молекулярной генетики и информатики. В 1982 г. были организованы банки нуклеотидных последовательностей: Gen Bank в США и EMBL в Европе, в которых концентрировалась информация о расшифрованных нуклеотидных последовательностях ДНК различных организмов. Прогресс в области определения нуклеотидных последовательностей ДНК различных организмов привел к возникновению геномики – науки, изучающей наборы всех генов данного организмов как единое целое. Одновременно возникла протеомика – наука, исследующая полные наборы белков, функционирующих на различных этапах развития того или иного организма. Методы молекулярной биологии. Заполните таблицу:
СТРОЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ. НУКЛЕОПРОТЕИДЫ. ПЛАН: 1. Виды нуклеиновых кислот: ДНК и РНК. Химический состав. 2. Мономерные звенья нуклеиновых кислот – нуклеотиды. Строение. Виды азотистых оснований. Минорные основания. 3. Нуклеопротеиды – сложные белки, состоящие из простого белка и нуклеиновой кислоты. 4. Гидролиз нуклеопротеидов. ________________________________ Нуклеиновые кислоты – биополимерные молекулы. Основная роль – хранение и реализация генетической информации. Два вида нуклеиновых кислот – ДНК и РНК. Полимерная цепочка состоит из мономерных звеньев – нуклеотидов, которые в свою очередь состоят из трех частей: 1. азотистое основание (пуриновое: аденин, гуанин; пиримидиновое: урацил, цитозин, тимин); 2. сахара – D-рибозы или D-дезоксирибозы; 3. фосфорной кислоты. Пуриновые и пиримидиновые циклические соединения, входящие в состав нуклеиновых кислот, называют просто основаниями. N-гликозиды оснований, содержащие рибозу или дезоксирибозу, называются нуклеозидами. Фосфатные эфиры нуклеозидов – нуклеотидами. Нуклеотиды связаны друг с другом фосфодиэфирными связями.  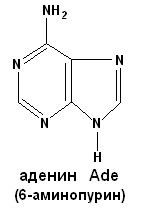 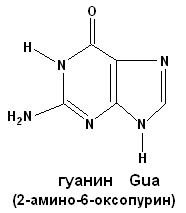 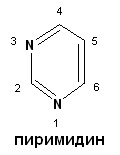 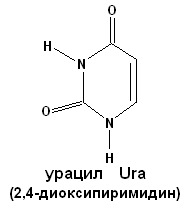  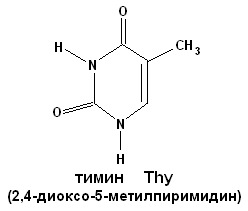
* Изомеры 5'-нуклеотидов, в которых фосфат связан с кислородом при С-3', называют 3'-нуклеотидами. Кроме перечисленных оснований в состав нуклеиновых кислот в небольших количествах встречаются минорные основания (редко встречающиеся). Например: дигидроурацил, псевдоуридин, ксантин, гипоксантин, ацетилцитозин и др. Нуклеопротеиды – сложные белки, состоящие из простого белка и небелковой части – нуклеиновых кислот. Нуклеопротеиды содержатся в большом количестве в ядерном веществе клеток. Кроме того, они выделены из цитоплазмы. Нуклеопротеиды обладают свойствами кислот, нерастворимы в воде и растворимы в щелочах. Нуклеопротеиды содержат простой белок, в основном состоящий из протаминов или гистонов, которые обладают щелочными свойствами за счет большого количества входящих в них диаминомонокарбоновых кислот (аргинин, лизин и гистидин). Небелковая часть нуклеопротеидов представлена нуклеиновыми кислотами. Нуклеиновые кислоты обладают кислотными свойствами вследствие диссоциации имеющихся у них остатков фосфорной кислоты. Работа №1 ГИДРОЛИЗ НУКЛЕОПРОТЕИДОВ ПРИНЦИП РАБОТЫ: Для изучения состава нуклеопротеидов проводят кислотный гидролиз дрожжей в присутствии серной кислоты. При непродолжительном, т.е. частичном, гидролизе нуклеопротеиды распадаются на белок и нуклеиновые кислоты. Про продолжительном гидролизе наступает полный распад нуклеопротеидов. При гидролизе мононуклеотидов выделяются пуриновые или пиримидиновые основания, углевод (рибоза или дезоксирибоза) и фосфорная кислота. Составные части нуклеопротеидов в гидролизате можно открыть с помощью цветных (качественных) реакций. ИССЛЕДУЕМЫЙ МАТЕРИАЛ: дрожжи (пекарские). РЕАКТИВЫ и ОБОРУДОВАНИЕ: 1) серная кислота, 10% раствор; 2) едкий натр, 10% раствор; 3) медь сернокислая, 1% раствор; 4) аммиак концентрированный; 5) азотнокислое серебро, 1-2% раствор (аммиачный раствор); 6) молибденовый реактив – раствор молибденовокислого аммония в азотной кислоте; 7) концентрированная серная кислота; 8) тимол, 1% алкогольный раствор; 9) круглодонная колба с воздушным холодильником; 10) воронка с фильтром; 11) мерный цилиндр на 50 или 100 мл. ХОД РАБОТЫ:
Помещают 1 г пекарских дрожжей в круглодонную колбу на 100 мл, добавляют 20 мл 10% раствора серной кислоты и 20 мл дистиллированной воды. Колбу закрывают пробкой с длинной стеклянной трубкой и кипятят под тягой в течение 1 часа на асбестовой сетке при слабом нагревании. Через час после начала кипения нагревание жидкости прекращают, дают ей остыть, переносят в цилиндр, доводят водой до первоначального объема и фильтруют. С фильтратом проделывают качественные реакции на составные части нуклеопротеидов. При гидролизе нуклеиновых кислот обнаруживаются фосфорная кислота, рибоза или дезоксирибоза и азотистые основания – пуриновые и пиримидиновые.
а) Биуретовая проба на полипептиды. К 5 каплям гидролизата прибавляют 10 капель 10% раствора едкого натра и 1 каплю 1% раствора медного купороса. Жидкость окрашивается в розовый цвет. б) Серебряная проба на пуриновые основания. Нейтрализуют 10 капель гидролизата 1 каплей концентрированного аммиака и добавляют 5 капель 1% раствора азотнокислого серебра. При стоянии через 3-5 мин выпадает небольшой бурый осадок серебряных производных пуриновых оснований. в) Качественная реакция Молиша на пентозную группировку. При взаимодействии концентрированной серной кислоты с гексозами или пентозами происходит дегидратация их: из пентоз образуется фурфурол, а из гексоз – оксиметилфурфурол. Они дают с тимолом (метилизопропилфенол) или α-нафтолом в присутствии концентрированной серной кислоты продукты конденсации красного цвета. К 10 каплям профильтрованного гидролизата дрожжей добавляют 2-3 капли 1% алкогольного раствора тимола, перемешивают и по стенке пробирки осторожно приливают 20 капель концентрированной серной кислоты. При встряхивании на дне пробирки образуется красное окрашивание вследствие образования продукта конденсации фурфурола с тимолом. г) Молибденовая проба на фосфорную кислоту. К 3-5 каплям гидролизата приливают 20 капель молибденового реактива (раствор молибденовокислого аммония в азотной кислоте) и кипятят несколько минут. Жидкость окрашивается в лимонно-желтый цвет. При охлаждении образуется желтый кристаллический осадок комплексного соединения фосфорно-молибденовокислого аммония. Молибденовая проба на фосфорную кислоту: H3PO4 + 12(NH4)2MoO4 + 21HNO3 → → (NH4)3PO4 ∙ 12MoO3 + 21NH4NO3 + 12H2O РЕЗУЛЬТАТЫ и ВЫВОДЫ: Работа №2 ВЫДЕЛЕНИЕ ДЕЗОКСИРИБОНУКЛЕОПРОТЕИДОВ (ДНП) ИЗ ТКАНЕЙ ПРИНЦИП РАБОТЫ: Дезоксирибонуклеопротеиды растворяются в растворах солей средней концентрации (например, в 1М хлориде натрия) с образованием вязких растворов и снова осаждаются при разведении их (0,15М) в виде нитей нуклеопротеидов. РЕАКТИВЫ и ОБОРУДОВАНИЕ: 1) NaCl, 2М и 1М растворы, содержащие 0,04% трехзамещенного цитрата натрия (раствор хранят в холодильнике); 2) NaOH, 0,4 и 10% растворы; 3) дифениламиновый реактив, 1% раствор (1г дифениламина, дважды перекристаллизованного из 70% спирта или петролейного эфира, растворяют в смеси 2,75 мл концентрированной серной кислоты и 100 мл ледяной уксусной кислоты); 4) CuSO4, 1% раствор; 5) селезенка, печень. ХОД РАБОТЫ: 1. В ступке, охлаждаемой льдом, растирают 2 г ткани органа, затем постепенно добавляют 5мл охлажденного 2М раствора хлорида натрия, содержащего 0,04% трехзамешенного цитрата натрия, и растирают в ступке еще в течение 15мин. 2. Затем, перемешивая содержимое, постепенно, малыми порциями добавляют 50 мл охлажденного 1М раствора хлорида натрия. Образовавшуюся гомогенную массу переносят в центрифужные пробирки и центрифугируют 15мин при 3000 об/мин. 3. Надосадочную жидкость после центрифугирования сливают в маленький стакан, измеряют в цилиндре объем полученного центрифугата и медленно вливают его в шестикратный объем дистиллированной воды тонкой струйкой, размешивая жидкость деревянной палочкой. Выделившиеся нити ДНП наматывают на деревянную палочку. Затем часть нитей ДНП осторожно собирают и вместе с палочкой переносят в другую пробирку. 4. Нити выделенного ДНП растворяют в 1 мл 0,4% раствора NaOH. Полученный раствор делят на две части и ставят: 1) биуретовую реакцию (на белок); 2) реакцию с дифениламином (на ДНК). Биуретовая реакция на белковый компонент в ДНП К 5-10 каплям раствора ДНП добавляют 10 капель 10% раствора NaOH и по 1 капле 1% раствора сульфата меди (II), Раствор окрашивается в сине-фиолетовый цвет. Реакция на ДНК При нагревании ДНП гидролизуются, а освободившаяся дезоксирибоза дает синее окрашивание. К раствору (15-20 капель) добавляют равный объем дифениламина, находящегося в смеси с уксусной и серной кислотами. Смесь нагревают на кипящей водяной бане 15 мин. Жидкость постепенно приобретает синюю окраску, обусловленную реакцией дифениламина с дезоксирибозой. РЕЗУЛЬТАТЫ И ВЫВОДЫ: СИНТЕЗ НУКЛЕОТИДОВ. РАСПРЕДЕЛЕНИЕ НУКЛЕОТИДОВ В ОРГАНИЗМЕ. ПЛАН: 1. Нуклеиновые кислоты – биополимерные молекулы, состоящие из трех частей – азотистого основания (пуринового или пиримидинового); сахара (D-рибозы или D-дезоксирибозы); остатка фосфорной кислоты. 2. Минорные основания. 3. Синтез пуриновых и пиримидиновых нуклеотидов de novo. Основные этапы и метаболиты. 4. Синтез нуклеотидов из готовых продуктов. 5. Распределение нуклеотидов в организме. 6. Циклические нуклеотиды. Распределение нуклеотидов в организме
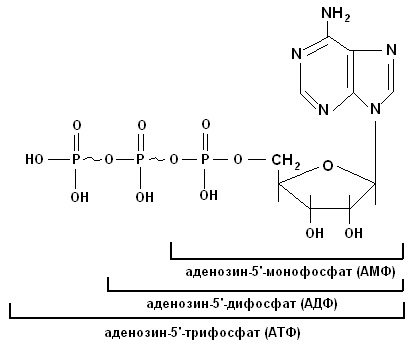 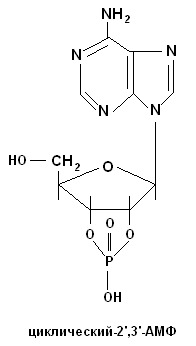 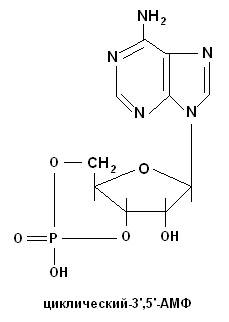 СТРУКТУРА И ФУНКЦИИ ДНК И РНК. Контрольные вопросы: 1. Методы молекулярной биологии. 2. Биологическая роль нуклеиновых кислот в живых организмах. Химический состав молекул ДНК и РНК. 3. Экспериментальные исследования Герши, как доказательство роли ДНК в хранении и реализации наследственной информации. 4. Строение нуклеотидов. Минорные основания. Циклические нуклеотиды. 5. Образование дифосфоэфирных связей. Комплементарность азотистых оснований. Правила Э. Чаргаффа и выводы из них. 6. Первичная структура нуклеиновых кислот. Определение нуклеотидной последовательности ДНК и РНК. Метод секвенирования ДНК по Сангеру (метод Сангера-Коулсона). Метод Максама-Гилберта. 7. Вторичная структура нуклеиновых кислот. Модель ДНК, разработанная Д.Уотсоном и Ф.Криком. 8. Третичная структура ДНК прокариот и эукариот. 9. Разнообразие форм ДНК. Сверхспирализация ДНК. Топоизомеразы. 10. Физико-химические свойства ДНК и РНК. Отношение к растворителям, вязкость, механическая прочность, взаимодействие с УФ. Гиперхромный эффект. 11. Объяснить действие кислот, оснований, азотистой кислоты и температуры на ДНК. С помощью каких методов можно выявить явление денатурации и ренатурации ДНК? 12. Структура и распределение генов в молекулах ДНК. Механизмы формирования нуклеомеров, нуклеосом и хромосом. Распределение генетического материала у прокариот и эукариот. 13. Структура, свойства и функции митохондриальной ДНК. Почему митохондрии имеют собственную ДНК? 14. Структура, свойства и функции РНК. 15. Типы и распределение рибонуклеиновых кислот в клетке. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ. Работа №3 КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ В КРОВИ ПРИНЦИП РАБОТЫ: Интенсивность образования нуклеиновых кислот в организме зависит от уровня белкового питания. Определение суммы нуклеиновых кислот - дезоксирибонуклеиновой и рибонуклеиновой - дает возможность производить весьма точные серийные определения в небольших количествах крови (методики разработаны А.С. Спириным) с использованием спектрофотометрии при λ=270-290 нм (ультрафиолетовая часть спектра) после удаления белков при помощи соляной кислоты. Спектрофотометрические измерения производят с помощью спектрофотометра СФ-26 или СФ-46. РЕАКТИВЫ и ОБОРУДОВАНИЕ: 1) кровь; 2) НСl, 0,6 н.; 3) пробирки обычные, мерные и центрифужные; 4) кипящая водяная баня (!); 4) центрифуга с холодильником; 5) СФ-46. ХОД РАБОТЫ: 1. 0,1 мл крови размешивают в 1,4 мл воды. 2. К полученному гемолизату прибавляют 13,5 мл 0,6 н. раствора соляной кислоты (для этого лучше применять широкие центрифужные пробирки на 30-40 мл). 3. Перемешав смесь, пробирку помещают на 20 мин в кипящую водяную баню и закрывают маленькой воронкой. За это время происходит полный гидролиз нуклеиновых кислот, связанных с белками, и осаждение всех белков. 4. Пробирку охлаждают, затем центрифугируют 10-15 мин при 1500 об/мин. 5. Надосадочную жидкость сливают в чистую пробирку и фотометрируют в кювете шириной 10 мм при λ=270 и 290 нм против 0,6 н. раствора соляной кислоты. 6. Из среднего значения показателя, полученного при λ=270 нм, вычитают значение, полученное при λ=290 нм. Разность делят на эмпирический коэффициент 0,19 (согласно рекомендации А. С. Спирина). Получают количество фосфора в граммах (при разведении 0,1 мл крови в 150 раз). 7. Для нахождения фосфора в 100 мл крови надо увеличить полученное число в 100 раз. Чтобы вычислить содержание нуклеиновых кислот, количество фосфора умножается на коэффициент 10,3 (А.Н. Белозерский и Н.И. Проскуряков, 1951). Т.о., подсчет нуклеиновых кислот ведут по формуле: где А - число, полученное при измерении раствора при λ=270 нм; Б - число, полученное при измерении раствора при λ=290 нм. РЕЗУЛЬТАТЫ и ВЫВОДЫ: Работа №4 СПЕКТРОФОТОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ СУММАРНОГО СОДЕРЖАНИЯ НУКЛЕИНОВЫХ КИСЛОТ В ТКАНЯХ ОРГАНОВ ПРИНЦИП РАБОТЫ: В основе спектрофотометрического метода определения суммарного содержания нуклеиновых кислот, разработанного А.С. Спириным, лежит экстракция их из биологического материала горячей хлорной кислотой с последующим определением поглощения экстрактов в ультрафиолетовой области спектра при 270 и 290 нм. РЕАКТИВЫ и ОБОРУДОВАНИЕ: 1) НСlО4, 0,2 н. и 0,5 н. растворы; 2) пробирки обычные, мерные и центрифужные; 3) водяная баня; 4) центрифуга с холодильником; 5) СФ-46. ХОД РАБОТЫ: 1. 100-200 мг измельченной на холоду ткани помещают в центрифужную пробирку с 5-10 мл охлажденного 0,2 н. раствора хлорной кислоты. Содержимое пробирки тщательно перемешивают и осадок отделяют центрифугированием при 3000 об/мин в течение 10 мин при охлаждении. 2. Надосадочную жидкость отбрасывают, а осадок повторно отмывают хлорной кислотой (такая обработка необходима для удаления кислото-растворимых нуклеотидов): к осадку добавляют 5-10 мл 0,5 н. раствора хлорной кислоты и, закрыв пробирки пробками с воздушными холодильниками, нагревают их на кипящей водяной бане 30 мин. Эта процедура необходима для количественной экстракции нуклеиновых кислот из исследуемой ткани и кислотного гидролиза. 3. Гидролизаты охлаждают и центрифугируют 10 мин при 3000 об/мин. 4. Надосадочную жидкость сливают в отдельную чистую пробирку. 5. Осадок подвергают повторной экстракции 0,5 н. раствором хлорной кислоты: к осадку добавляют 5-10 мл 0,5 н. раствора хлорной кислоты и, закрыв пробирки пробками с воздушными холодильниками, нагревают их на кипящей водяной бане 30 мин. 6. Гидролизаты охлаждают и центрифугируют 10 мин при 3000 об/мин. 7. Надосадочную жидкость сливают в отдельную чистую пробирку и объединяют с полученной в п.4. Точно измеряют общий объем. 8. Определяют поглощение на спектрофотометре при 270 и 290 нм против 0,5 н. раствора хлорной кислоты. При необходимости исследуемый раствор разводят 0,5 н. раствором хлорной кислоты. 9. Рассчитывают содержание фосфора нуклеиновых кислот в 1 мл исследуемого раствора по формуле: Сфосфора = А270 - А290/0,19 (мкг), где 0,19 - значение ΔА (А270– А290), которое имеет гидролизат нуклеиновых кислот, содержащий 1 мкг нуклеинового фосфора в 1 мл раствора. При дальнейших расчетах учитывают общий объем гидролизата и разведения. 10. Для пересчета количества нуклеинового фосфора на количество нуклеиновых кислот пользуются пересчетным коэффициентом 10,3: Снк = Сфосфора ∙ 10,3 (мкг). 11. Рассчитывают содержание нуклеиновых кислот в 1 г исследуемой ткани. РЕЗУЛЬТАТЫ и ВЫВОДЫ: Работа №5 КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ДНК КОЛОРИМЕТРИЧЕСКИМ МЕТОДОМ ПРИНЦИП РАБОТЫ: Метод основан на способности дезоксирибозы, входящей в состав ДНК, давать синее окрашивание с дифениламиновым реактивом. РЕАКТИВЫ и ОБОРУДОВАНИЕ: 1) дифениламиновый реактив, 1% раствор; 2) водный раствор ДНК; 3) пробирки обычные и мерные; 4) кипящая водяная баня (!); 5) КФК, кюветы шириной 5 мм. ХОД РАБОТЫ: 1. В опытную пробирку наливают 1 мл исследуемого водного раствора ДНК и 2 мл дифениламинового реактива. 2. В контрольную пробирку наливают 1 мл дистиллированной воды и 2 мл дифениламинового реактива. 3. Обе пробирки нагревают на кипящей водяной бане 10 мин. 4. После охлаждения измеряют оптическую плотность при красном светофильтре (КФК, кюветы шириной 5 мм) против контроля. 5. Построение калибровочного графика. В 3 пробирки помещают по 1 мл раствора ДНК с концентрациями 50, 100 и 200 мкг/мл соответственно. Добавляют в каждую пробирку по 2 мл дифениламинового реактива и нагревают на кипящей водяной бане 10 мин. После охлаждения измеряют оптическую плотность (см. п. 4). Калибровочный график строят, откладывая на оси абсцисс концентрации использованных растворов ДНК, а на оси ординат - значения оптической плотности. Данные для построения калибровочного графика:
РЕЗУЛЬТАТЫ и ВЫВОДЫ: Работа №6 КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ РНК КОЛОРИМЕТРИЧЕСКИМ МЕТОДОМ ПРИНЦИП РАБОТЫ: Метод основан на цветной реакции орцинового реактива с пентозой, входящей в состав РНК. РЕАКТИВЫ и ОБОРУДОВАНИЕ: 1) орциновый реактив (50 мг FeCl3∙6H2O растворяют в 250 мл концентрированной НС1 и перед опытом к нужному количеству этого раствора добавляют орцин из расчета 4,76 мг/мл); 2) водный раствор РНК; 3) пробирки обычные и мерные; 4) кипящая водяная баня (!); 5) КФК, кюветы шириной 5 мм. ХОД РАБОТЫ: 1. В опытную пробирку помещают 1 мл исследуемого раствора РНК и 1 мл орцинового реактива. 2. В контрольную пробирку помещают 1 мл дистиллированной воды и 1 мл орцинового реактива. 3. Обе пробирки нагревают на кипящей водяной бане 20 мин. 4. После охлаждения измеряют оптическую плотность при красном светофильтре (КФК, кюветы шириной 5 мм) против контроля. 5. Построение калибровочного графика. В 3 пробирки помещают по 1 мл раствора РНК с концентрациями 50, 100 и 200 мкг/мл соответственно. Добавляют в каждую пробирку по 1 мл орцинового реактива. Нагревают на кипящей водяной бане 20 мин. После охлаждения измеряют оптическую плотность (см. п. 4). Калибровочный график строят, откладывая на оси абсцисс концентрации использованных растворов РНК, а на оси ординат - значения оптической плотности. Данные для построения калибровочного графика:
РЕЗУЛЬТАТЫ и ВЫВОДЫ: Контрольные вопросы: 1. Сравните колориметрические и спектрофотометрические методы определения нуклеиновых кислот. 2. Объясните принцип спектрофотометрического определения количества нуклеиновых кислот. 3. Как протекает гидролиз нуклеиновых кислот? Качественные реакции на конечные продукты гидролиза нуклеиновых кислот. Написать химические уравнения реакций. 4. Объясните принцип метода выделения дезоксирибонуклеопротеидов из тканей. 5. Какие реакции позволяют открыть в выделенном ДНП белки и ДНК? СТРУКТУРА ГЕНОМА. ЭКСПРЕССИЯ ГЕНОВ. Контрольные вопросы: 1. Строение гена прокариот. 2. Строение гена эукариот. 3. Строение и молекулярный механизм регуляции оперона. 4. Триплетный генетический код и его свойства. 5. Репликация ДНК. Белки и ферменты, участвующие в репликации ДНК. Сайт-специфические участки. Молекулярный механизм. 6. Постсинтетическая репарация. 7. Обратная транскрипция – биосинтез ДНК на РНК-матрице. 8. Транскрипция. Особенности процесса у прокариот и эукариот. Факторы транскрипции. 9. Процессинг РНК. Сплайсинг. Кэпирование. Полиаденилирование. Особенности процессинга у прокариот и эукариот. 10. Альтернативный процессинг. 11. Трансляция у прокариот и эукариот. Активация аминокислот. 12. Рибосомы. Строение и функции. 13. Инициация трансляции. Белковые факторы инициации трансляции. 14. Элонгация трансляции. Стадии. Характеристика. 15. Терминация трансляции. Белковые факторы. 16. Регуляция трансляции. 17. Репарация ДНК. ЛИТЕРАТУРА: 1. Коничев А.С. Молекулярная биология /А.С. Коничев, Г.А. Севастьянова. М.: Академия, 2005 2. Мушкамбаров Н.Н. Молекулярная биология /Н.Н. Мушкамбаров, С.Л. Кузнецов. М.: МИА, 2003 3. Агол В.И. и др. Молекулярная биология. Структура и биосинтез нуклеиновых кислот./Под ред. А.С. Спирина. М.: Высшая школа, 1990 4. Спирин А.С. Молекулярная биология. Структура рибосомы и белка. М.: Высшая школа, 1986 5. Альбертс Б. и др. Молекулярная биология клетки. М.: Мир, 1994 6. Уотсон Д. Молекулярная биология гена. М.: Мир, 1978. 7. Ленинджер А. Основы биохимии: В 3-х т. - М.: Мир, 1985.- 368 с. 8. Берёзов Т.Т. Биологическая химия: Учебник / Т.Т. Берёзов, Б.Ф. Коровкин.- М.: Медицина, 1982.- 1-е издание; 1998.- 2-е издание; 2002.- 3-е издание (704 с.) 9. Степанов В.М.. Молекулярная биология. Структура и функции белков. 1996. 10. Зелди И.П. Методы экспериментальной биологии: Учеб. пособие / И.П. Зелди, А.В. Смирнов, Л.Б. Киселева, В.Н. Самарцев / Под ред. И.П. Зелди.- Йошкар-Ола: МарГУ, 2002.- 152 с. Адреса в сети Интернет, содержащие информацию, касающуюся генома человека: http://www.nhgri.nih.gov http://genlink.wustl.edu http://www.geneletter.org http://www.hhmi.org http://www.mpimg-berlin-dahlem.mpg.de http://ftp.tigr.org http://cancernet.nci.nih.gov/ord/index http://www.wiley.co.uk/genetherapy http://www.genom.gov | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
