|
|
Апоптоз у прокариот. Апоптоз у прокариот
Апоптоз у прокариот[править | править код]
Предполагается, что механизмы программируемой клеточной смерти возникли ещё у прокариот, подтверждением чему служит целый ряд экспериментальных данных. В частности, выявлена роль апоптоза в противовирусной защите бактериальных популяций. К примеру, некоторые штаммы E. coli несут гены, вызывающие гибель клетки после внедрения фага T4. При этом вирусные белки активируют в заражённых клетках протеазы, которые инактивируют и расщепляют бактериальный фактор трансляции (EF-Tu), что приводит к гибели заражённой бактерии.[3][22]
Прокариотическим аналогом апоптоза также считается гибель части бактерий в условиях стазиса — остановки роста бактериальной популяции (при исчерпании питательного субстрата или под влиянием стрессорных факторов). Например, голодающая популяция E. coli разделяется на две субпопуляции, одна из которых погибает и подвергается автолизу. Выжившая популяция в итоге использует продукты автолиза в качестве питательного субстрата и продолжает расти. Механизм программируемой клеточной гибели в данном случае основан на формировании модулей зависимости. Модуль зависимости представляет собой неактивный комплекс из стабильного цитотоксического белка и его нестабильного супрессора. В условиях голода прекращается синтез обоих белков. В результате нестабильный супрессор разрушается, а цитотоксический белок вызывает гибель и автолиз.[22]
Имеются данные о функциональной роли программируемой клеточной смерти в процессах развития и морфогенеза прокариот. Так, в условиях гибели значительной части клеточной популяции протекает образование плодового тела и споруляция у Myxococcus xanthus. Другим примером может служить процесс спорообразования у бациллы Bacillus subtilis: материнская вегетативная клетка погибает и активно лизируется при высвобождении споры.[3][22]
Апоптоз у одноклеточных эукариот[править | править код]
Примеры программируемой клеточной гибели описаны и для представителей одноклеточных эукариот, принадлежащих к различным таксонам. Причём во многих исследованиях установлен факт участия цистеиновых протеаз и митохондрий в гибели клеток, что может указывать на очень древнее происхождение и относительную консервативность механизмов апоптоза. Основными маркерами апоптоза у одноклеточных эукариот, как и у большинства эукариот вообще, являются: фрагментация ДНК и последующий распад клетки на отдельные апоптозные тельца.[3]
Предполагается, что отдельные механизмы и компоненты апоптоза возникли постепенно в процессе эволюции. Одними из самых ранних эволюционных приобретений считаются ингибиторы апоптоза, которые встречаются практически у всех эукариот. Вероятно, ингибиторы имеют вирусное происхождение, а их изначальная функция сводилась к предотвращению апоптоза и продлению жизни инфицированной клетки. Ещё одним общим для подавляющего большинства эукариот[ 3] эволюционным приобретением является митохондриальный путь активации апоптоза, в котором участвуют высвобождаемые из межмембранного пространства митохондрий цитохром c и AIF (или их гомологи).[3]
Подобные каспазам белки впервые появились у мезокариотических водорослей — динофлагеллят. Причём инициаторные каспазы возникли, предположительно, раньше, чем эффекторные.[
4] Рецепторы смерти, вероятно, впервые возникли у относительно высокоорганизованных простейших — дрожжей и инфузорий. Белки, способные взаимодействовать с белками семейства Bcl-2, вероятно, появились в процессе филогенеза у гетеротрофных жгутиконосцев, хотя идентифицированы они только у дрожжей.[3]
Одной из основных функций апоптоза у одноклеточных эукариот является уничтожение мутантных или инфицированных клеток. Механизмы программируемой клеточной гибели могут быть сопряжены с процессами дифференцировки. Примерами чему служат избирательная гибель ядра у конъюгирующих инфузорий или массовая гибель эпимастигот с появлением трипомастигот в процессе жизненного цикла паразитического жгутиконосца Trypanosoma cruzi.[22] Апоптоз также интегрирован в процессы морфогенеза при образовании плодовых тел у миксобактерий и слизевиков. В дрожжевых популяциях стареющие и повреждённые клетки погибают путём апоптоза в условиях недостатка питательного субстрата с целью обеспечения питания молодых и здоровых особей.[3]
Апоптоз у многоклеточных эукариот[править | править код]
Принципиально апоптоз у многоклеточных эукариот сходен с программируемой клеточной гибелью у одноклеточных эукариот. На протяжении всего эволюционного процесса прослеживается общность основных функций апоптоза, сводящихся к удалению дефектных клеток и участию в процессах дифференцировки и морфогенеза. В различных литературных и электронных источниках постулируется эволюционная консервативность генетического механизма апоптоза.[3][16][79] В частности, подобные выводы делаются на основании выявленной генетической и функциональной гомологии процессов апоптоза у нематод Caenorhabditis elegans и млекопитающих,[3] или же у растений и животных.[16]
Апоптоз можно рассматривать как небольшое видоизменение митоза, как эволюционную надстройку над делением. Внешне апоптоз также напоминает процесс деления, только в отличие от последнего он заканчивается не образованием двух полноценных дочерних клеток, а несколько большим количеством апоптозных микротелец, также несущих в себе генетический материал и удобных для фагоцитирования. При таком подходе к апоптозу становится понятным тот факт, что широкий набор генетических маркеров пролиферации являются и маркерами апоптозной гибели[80].
Апоптоз у Caenorhabditis elegans[править | править код]
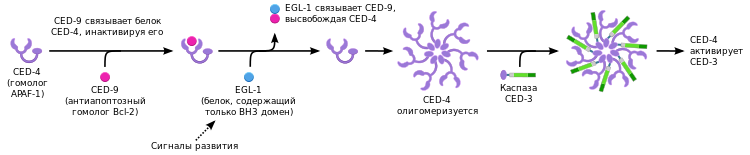
Апоптоз в развивающемся организме С. elegans[81]
Нематода C. elegans была одним из первых модельных организмов, на примере которого изучался процесс апоптоза. В процессе развития C. elegans путём апоптоза погибает 131 из 1090 соматических клеток взрослого организма нематоды. Механизм программируемой клеточной гибели нематод напоминает митохондриальный путь апоптоза позвоночных, но в то же время имеет и существенные отличия.[82]
В реализации программированной клеточной гибели по пути апоптоза у нематоды участвует одна каспаза, являющаяся продуктом гена ced-3 (англ. C. elegans death gene, CED-3). Каспаза CED-3 содержит CARD-домен. Активация каспазы CED-3 осуществляется при взаимодействии её CARD-домена с CARD-доменом адаптерной молекулы CED-4. Стоит отметить, что адаптерная молекула CED-4 по структуре гомологична APAF-1 и аналогичным образом олигомеризуется перед активацией каспазы CED-3. В свою очередь, каспаза CED-3 содержит CARD-домен и активируется за счёт димеризации, также как каспаза-9 у позвоночных.[82]
Регуляция апоптоза у нематоды обеспечивается за счёт белков CED-9 и EGL-1. CED-9 является гомологом антиапоптотического белка Bcl-2 позвоночных, но функционально отличается от него. CED-9, вероятно, блокирует адаптерный белок CED-4 за счёт прямого связывания. Связывание CED-9 и CED-4 нарушается белком BH3-семейства — EGL-1 (egg laying deficient). В результате высвобождения адаптерного белка CED-4 активируется каспаза CED-3, что в итоге приводит к клеточной гибели.[81]
Апоптоз у Drosophila melanogaster[править | править код]
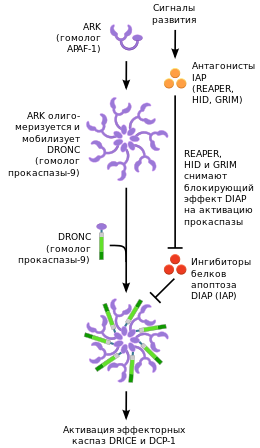
Апоптоз у Drosophila[46]
Как и у нематод, апоптоз у насекомых схож с митохондриальным путём этого процесса у позвоночных, но в то же время характеризуется существенными различиями. У Drosophila melanogaster апоптоз наступает в процессе развития (под действием гормона экдизона) или при клеточном стрессе (например, при повреждении ДНК).[81]
Апоптоз у насекомых протекает с участием двух эффекторных каспаз: DRICE и DCP-1. Активацию эффекторных каспаз обеспечивает инициаторная каспаза DRONC в комплексе с белком ARK (англ. APAF-1 related killer), который представляет собой гомолог APAF-1. Однако пути активации и функциональная активность белка ARK остаются пока малоизученными.[81]
Важным фактором, обеспечивающим регуляцию и протекание апоптоза у Drosophila melanogaster является белковый ингибитор апоптоза IAP, и в особенности, DIAP 1. Ингибиторы апоптоза блокируют инициаторную каспазу DRONC и эффекторные каспазы DRICE и DCP-1, предотвращая гибель клетки. В связи с этим для запуска апоптоза у Drosophila экспрессируются один или несколько белков, являющихся антагонистами IAP: Reaper, Hid, Grim, Sickle. Эти белки блокируют действие IAP, вследствие чего высвобождаются инициаторные и эффекторные каспазы, участвующие в апоптозе.[81]
Апоптоз у растений[править | править код]
Программируемая клеточная смерть (ПКС) растений имеет морфологические и биохимические сходства с апоптозом животных. Однако особенности строения и функционирования растительной клетки обуславливают и ряд отличий. Например, наличие клеточной стенки препятствует фагоцитозу, поэтому в растительных клетках продукты апоптоза ликвидируются за счёт аутофагии и автолиза. А имеющиеся в клетках растений вакуоли при этом используются в качестве гидролитических отсеков.[83]
Программируемая клеточная смерть играет ключевую роль во многих вегетативных и репродуктивных фазах развития растений, включая старение листьев, ксилогенез, отмирание лепестков после оплодотворения, постэмбриональный распад алейроновых слоёв, развитие корневого чехлика, соматический и зиготический эмбриогенез, определение пола. ПКС в растениях может развиваться в ответ на биотические и абиотические раздражители. Авирулентные инфекции, как правило, характеризуются локальной гибелью клеток, известной как гиперчувствительный ответ, приводящий к образованию некротических поражений вокруг инфицированных областей. В ответ на абиотический стресс также может происходить активация ПКС. Наилучшим примером служит образование аэренхимы в условиях низкой концентрации кислорода, при которой кортикальные клетки корня подвергаются индуцированной гибели и тем самым формируют крупные воздушные резервуары, обеспечивая поступление воздуха из верхней части растения. ПКС у растений также может происходить при воздействии высоких температур.[84
Апопто́з (др.-греч. ἀπόπτωσις — «листопад», от ἀπό- + πτωσις «падение») — регулируемый процесс программируемой клеточной гибели, в результате которого клетка распадается на отдельные апоптотические тельца, ограниченные плазматической мембраной. Фрагменты погибшей клетки обычно очень быстро (в среднем за 90 минут[1]) фагоцитируются макрофагами либо соседними клетками, минуя развитие воспалительной реакции. Морфологически регистрируемый процесс апоптоза продолжается 1—3 часа.[2] Одной из основных функций апоптоза является уничтожение дефектных (повреждённых, мутантных, инфицированных) клеток. В многоклеточных организмах апоптоз к тому же задействован в процессах дифференциации и морфогенеза, в поддержании клеточного гомеостаза, в обеспечении важных аспектов развития и функционирования иммунной системы. Апоптоз наблюдается у всех эукариотов, начиная от одноклеточных простейших и вплоть до высших организмов. В программируемой смерти прокариотов участвуют функциональные аналоги эукариотических белков апоптоза.[3] |
|
|
 Скачать 104.16 Kb.
Скачать 104.16 Kb.

