1. Бактериологический метод исследования, его этапы.. микра 4 пара. Бактериологический метод исследования, его этапы. Цель бактериологического метода
 Скачать 155.42 Kb. Скачать 155.42 Kb.
|
|
Бактериологический метод исследования, его этапы. Цель бактериологического методазаключается в выделении чистой культуры возбудителя заболевания из исследуемого материала, накопление чистой культуры и идентификация данной культуры по набору свойств: морфологических, тинкториальных, культуральных, биохимических, антигенных, по наличию факторов патогенности, токсигенности и определение его чувствительности к антимикробным препаратам и бактериофагам. Бактериологический метод исследования включает: 1. посев исследуемого материала в питательные среды 2. выделение чистой культуры 3. идентификацию микроорганизмов (определение принадлежности к виду). Выделение и идентификация чистых культур аэробных и анаэробных бактерий предусматривает проведение следующих исследований: I этап (работа с нативным материалом) Цель: получение изолированных колоний 1. Предварительная микроскопия дает ориентировочное представление о микрофлоре 2. Подготовка материала к исследованию 3. Посев на плотные питательные среды для получения изолированных колоний 4. Инкубация при оптимальной температуре, чаще всего 37°С, в течение 18-24 часов II этап Цель: получение чистой культуры 1. Макроскопическое изучение колоний в проходящем и отраженном свете (характеристика величины, формы, цвета, прозрачности, консистенции, структуры, контура, поверхности колоний). 2. Микроскопическое изучение изолированных колоний 3. Постановка пробы на аэротолерантность (для подтверждения присутствия в исследуемом материале строгих анаэробов). 4. Посев колоний, характерных для определенного вида, на среды накопления чистой культуры или элективные среды и инкубация в оптимальных условиях. III этап Цель: идентификация выделенной чистой культуры 1. Для идентификации выделенной культуры по комплексу биологических свойств изучается: морфология и тинкториальные свойства культуральные свойства (характер роста на питательных средах) биохимические свойства (ферментативная активность микроорганизмов) серологические свойства (антигенные) вирулентные свойства (способность к продукции факторов патогенности: токсины, ферменты, факторы защиты и аггресии) патогенность для животных фаголизабельность (чувствительность к диагностическим бактериофагам) чувствительность к антибиотикам другие индивидуальные свойства IV этап (Заключение) 2. Охарактеризивать вид, подвид, штамм, клон бактерий. Нумерическая таксономия признает равноценность всех фенотипических признаков. Для ее применения необходимо иметь информацию о многих десятках признаков. Видовая принадлежность исследуемого микроорганизма устанавливается по числу совпадающих признаков. Расчеты проводят с помощью компьютера. Трудности получения информации о многочисленных признаках исследуемого микроорганизма ограничивает возможность применения нумерической таксономии. Для хемотаксономии применяют физико-химические и биохимические методы: газово-жидкостная хроматография, электрофорез и др., с помощью которых исследуют липидный, аминокислотный состав (протеиновые профили) микробной клетки и ее компонентов, например клеточной стенки. Генотаксономия основана на генетических признаках, которые устанавливаются в опытах трансформации, трансдукции и конъюгации, а также анализе внехромосомных факторов наследственности — плазмид, транспозонов и фагов (см. 6.2). Серотаксономия основана на определении соответствующих антигенов, содержащихся в бактериальной клетке (см. главу 13) с помощью диагностических сывороток. Данный метод особенно часто применяется в медицинской микробиологии. Для определения родовой и видовой принадлежности бактерий используют справочник «Определитель бактерий Берджи», первое издание которого было опубликовано в 1923 г. После смерти Д. Берджи справочник неоднократно переиздавался коллективом авторов, в число которых входили многие ученые разных стран. Последнее издание в переводе на русский язык вышло в свет в 1997 г. Как во всех предыдущих изданиях, в его основе лежит фенотипическая или полифункциональная система, содержащая справочный материал, необходимый для практических бактериологических лабораторий. Данное издание, не претендуя на эволюционные формально-таксономические построения, видимо, завершает период систематики бактерий на основании фенотипических тестов и вряд ли сохранит свое значение в XXI столетии. Показано, что определение филогенетического положения прокариотов, т.е. их родовой и видовой принадлежности, должно проводиться по нуклеотидным последовательностям 16-рРНК исследуемых бактерий. Усовершенствованная методика секвенирования и обработки данных привела к получению идентичных результатов в различных лабораториях многих стран, что свидетельствует об их объективности. Видовая принадлежность бактерий оценивается при этом по степени гомологии ДНК–ДНК, т.е. ДНК исследуемого микроорганизма с эталонной. Таким образом, на смену классическим микробиологическим тестам, разработанным еще в эпоху Р. Коха, пришли молекулярнобиологические и генетические методы, из которых генетические зонды, цепная полимеразная реакция (ЦПР) и др. нашли широкое применение в настоящее время для диагностики многих инфекционных заболеваний (см. 4.5). Надцарство прокариотов, царство эубактерий в справочнике Берджи разделены на 33 группы, отличающиеся друг от друга по морфологии, окраске по Граму, спорообразованию, типу дыхания и некоторым другим признакам. Патогенные и условно-патогенные бактерии относятся к 18 группам. Некоторые группы подразделены на подгруппы и семейства. Каждая группа, подгруппа, семейство включает многочисленные роды. В главе 20 «Медицинская бактериология» все рассмотренные бактерии расположены по группам, семействам и родам согласно последнему изданию определителя Берджи. Для названия микроорганизмов используется биноминальная номенклатура К. Линнея, по которой первое слово обозначает род, второе — вид. Обычно название рода дается по фамилии автора, открывшего или описавшего данный микроорганизм, либо по его принадлежности к определенной морфологической группе. Например, Vibrio, Streptococcus, Shygella, Neisseria. Видовое название связано с наименованием заболевания либо с источником обитания, например C. diphteriae, V. cholerae, E. coli. В микробиологии широко применяются специальные термины: «штамм», «клон», «чистая культура». Штаммом называют культуру, выделенную из определенного источника или из одного и того же источника в разное время. Обычно штаммы обозначают либо протокольными номерами, либо по источнику выделения (человек, животное, внеш няя среда), либо по местности (городу), где он был выделен. Например, вирусы гриппа Гонконг, Сингапур. Штамм — более узкое понятие, чем вид. Штаммы одного и того же вида могут быть идентичными или различаться по некоторым признакам, не выходящим за пределы вида. Клоном называют культуру микроорганизма, выделенную из одной клетки (одноклеточная культура). Чистая культура представляет собой микробные особи одного и того же вида, выращенные из изолированной колонии на твердой питательной среде. В практических бактериологических лабораториях принадлежность выделенной бактериальной культуры к определенному виду (идентификация культуры) проводится по фенотипическим признакам: морфологическим, тинкториальным (отношение к красителям, особенно к окраске по Граму), культуральным, биохимическим (ферментация углеводов, образование индола, сероводорода и других соединений), антигенным в серологических реакциях in vitro. 3. Культуральные свойства бактерий и способы их изучения. 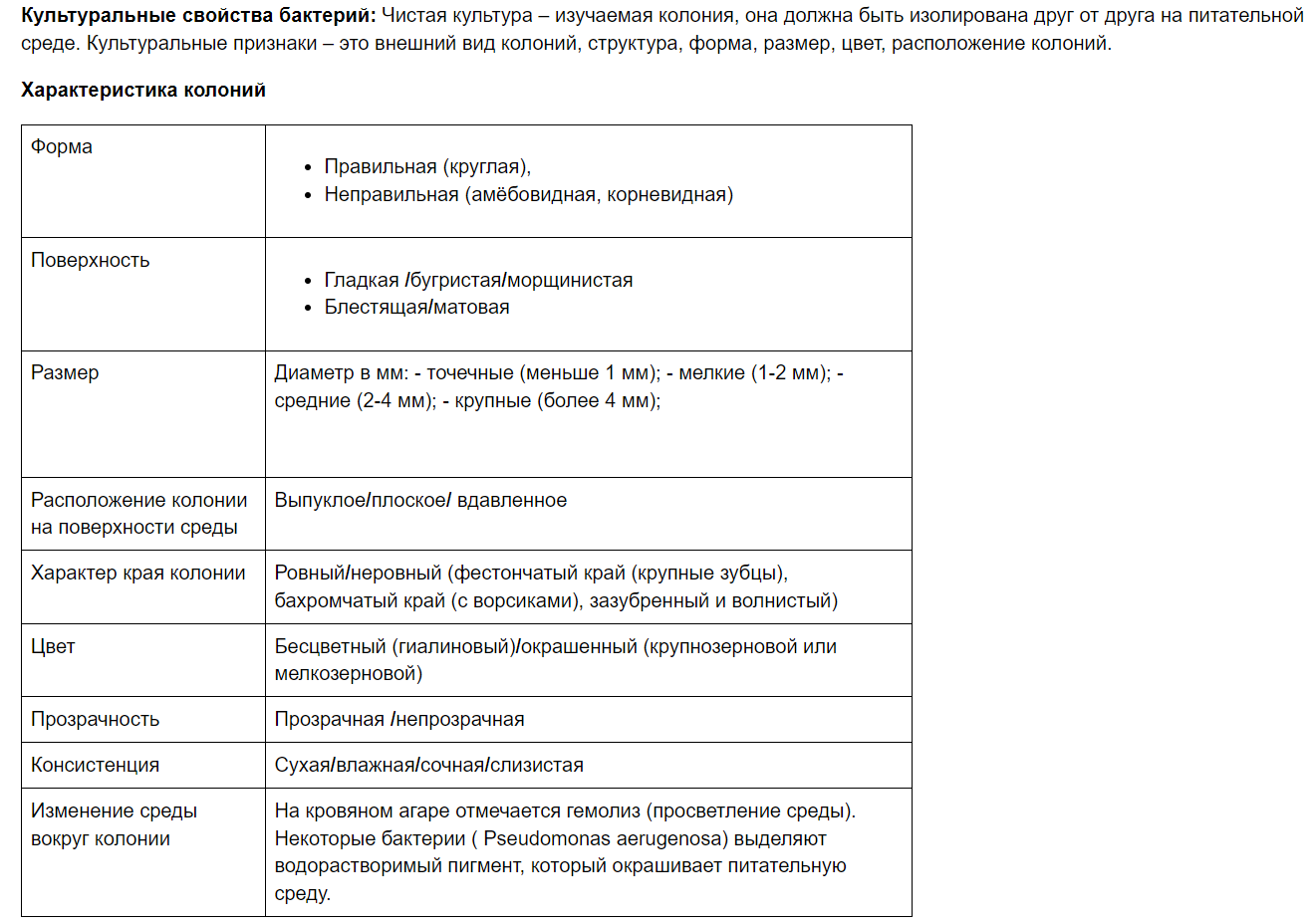 4. Чистая и смешанная культура бактерий.Оценка чистоты культур аэробных бактерий на 2 этапе бактериологического исследования. Изучение колоний и выделение чистых культур. Через сутки инкубации на чашках вырастают колонии, причем на первом штрихе рост сплошной, а на следующих – изолированными колониями. Колония – это скопление микробов одного вида, выросших из одной клетки. Таккак материал представляет собой чаще всего смесь микробов, то вырастает несколько видов колоний. Карандашом маркируют разные колонии,очерчивая их кружком со стороны дна, и изучают их (табл. 11). Прежде всего, изучают колонии невооруженным глазом: макроскопические признаки. Чашку просматривают (не открывая ее) со стороны дна в проходящем свете, отмечают прозрачность колоний (прозрачная, если не задерживает свет;полупрозрачная, если частично задерживает свет; непрозрачная, если свет через колонию не проходит), измеряют (в мм) размер колоний. Затем изучают колонии со стороны крышки, отмечают форму (правильная круглая, неправильная, плоская, выпуклая), характер поверхности (гладкая, блестящая, тусклая, шероховатая, морщинистая, влажная, сухая, слизистая), цвет (бесцветная, окрашенная). Еще лучше можно увидеть различия колоний при рассмотрении их с увеличением. Для этого закрытую чашку дном кверху помещают на предметный столик, слегка опускают конденсор, используют небольшое увеличение объектива (х8), передвигая чашку, изучают у колоний микроскопические признаки: характер края (ровные, волнистые, зазубренные, фестончатые), структуру (гомогенная, зернистая, волокнистая, однородная, или различающаяся в центре и по периферии). Далее изучают морфологию микробных клеток из колоний. Для этого из части каждой из отмеченных колоний делают мазки, окрашивают по Граму. Во время взятия колоний обращают внимание на консистенцию (сухая, если колония крошится и берется с трудом; мягкая, если берется легко на петлю; слизистая, если колония тянется за петлей; твердая, если часть колонии не берется петлей, можно снять только всю колонию). При просмотре мазков устанавливают, что колония представлена одним видом микроба, следовательно, могут быть выделены чистые культуры бактерий. Для этого из изученных колоний делают пересев на скошенный агар. При пересеве из колоний нужно тщательно следить, чтобы взять именно намеченные колонии, не задевая петлей близлежащих колоний. Пробирки подписывают и инкубируют в термостате при температуре 37°С в течение 24 часов. 5. Способы определения ферментативных свойств бактерий. В микробиологической практике изучение ферментативной активности используют для идентификации микроорганизмов, поскольку каждый микробный вид обладает определенным набором ферментов. Для определения протеолитической активности микробы засевают уколом в столбик желатина и после 3-5 суток инкубирования при комнатной температуре отмечают характер разжижения желатина: в виде воронки, гвоздя, чулка или в виде опрокинутой елки. Протеолитическую активность определяют также по образованию продуктов разложения белка: индола, сероводорода, аммиака. Для их определения засевают микроорганизмы в мясо-пептонный бульон, и между горлышком пробирки и ватной пробкой помещают индикаторные бумажки, исключая их контакт со средой. При образовании индола бумага, пропитанная насыщенным раствором щавелевой кислоты, приобретает розовый цвет; в присутствии сероводорода бумага, пропитанная ацетатом свинца, чернеет; при образовании аммиака красная лакмусовая бумажка синеет. Для определения сахаролитических свойств микробов применяют дифференциально-диагностические среды такие, как среды Гисса, среда Олькеницкого, среда Эндо, среда Левина, среда Плоскирева. Среды Эндо, Левина, Плоскирева в чашках Петри применяются для дифференцировки бактерий кишечной группы по их способности сбраживать лактозу. Эти среды содержат питательный агар, лактозу и индикатор, изменяющий свой цвет в кислой среде - индикатор рН. Если посеять на такую среду бактерии, которые сбраживают лактозу, например кишечную палочку, то в результате сбраживания лактозы образуется кислота, и индикатор изменит свой цвет в кислой среде. Поэтому колонии кишечной палочки на таких средах будут окрашенными соответственно цвету индикатора: на среде Эндо и среде Плоскирева - в красный цвет, на среде Левина - в черно-синий. Колонии бактерий, не сбраживающих лактозу, таких как сальмонеллы и палочки дизентерии, будут бесцветными. Среды Гисса (среды "пестрого ряда") готовятся на основе пептон-ной воды или полужидкого мясо-пептонного агара. Содержат какой-либо один углевод или многоатомный спирт и индикатор. При росте на среде Гисса микроба, сбраживающего данный субстрат с образованием кислоты и газа, среда изменит цвет, в полужидкой среде появятся пузырьки и разрывы в толще агара, в жидкой среде - пузырек газа в стеклянном поплавке. При сбраживании субстрата только до кислоты происходит лишь изменение цвета среды. Применяются также комбинированные среды, содержащие не один углевод, а два или три, например, среда Олькеницкого. Одна пробирка этой среды заменяет скошенный агар и среды Гисса с лактозой, глюкозой и сахарозой. После стерилизации в расплавленном виде среду в пробирке скашивают так, чтобы получился столбик и скошенная часть. Посев производится штрихом по скошенной части и уколом в столбик. При сбраживании лактозы или сахарозы изменяется цвет всей среды, при сбраживании одной глюкозы изменяется цвет только столбика. Образование газа определяется по наличию пузырьков в столбике агара. При выделении микробами аммиака цвет среды не меняется. Образование сероводорода проявляется почернением в столоике агара Для экспресс-метода определения ферментативной активности бактерий применяются микротестсистемы и система индикаторная бумажная (СИБ) Микротестсистема представляет собой контейнер из прозрачного полистирола, состоящий из нескольких ячеек Ячейки содержат высушенные питательные среды с углеводами и индикаторами рН В каждую ячейку засевают взвесь культуры бактерий определенной густоты В контрольные ячейки наливают физ раствор Результат учитывают после 3 - 4-хчасовой инкубации в термостате по изменению цвета индикатора Системы индикаторные бумажные (СИБ) для идентификации семейства энтеробактерий представляет собой диски или полоски хроматографической бумаги, покрытые защитной пленкой и содержащие определенный субстрат и индикатор В пробирки с физиологическим или буферным раствором вносят исследуемую культуру, затем помещают диски В контрольные пробирки культуру бактерий не вносят Результат учитывают по изменению цвета индикатора Для определения сероводорода диск помещают на поверхность МПА, засеянного уколом, что позволяет одновременно определить подвижность Во всех пробирках учитывают предварительный результат в тот же день и окончательный - на следующий день Оксидазная активность определяется путем растирания культуры на индикаторной бумажке Результат учитывается через минуту. 6. Среды Гисса, их состав и использование. 7. Методы определения продукции бактериями аммиака, индола и сероводорода. 1. Для определения продукции бактериальной культурой индола применяется способ Мореля. Культуру засевают в мясопептонный бульон или пептонную воду (лучше с добавлением триптофана, при утилизации которого выделяется значительное количество этого газа) и под пробку помещают фильтровальную бумагу, пропитанную щавелевой кислотой. а. При продукции бактериальной культурой индола нижняя часть бумажки краснеет. б. Если культура не продуцирует индол – бумажка остается бесцветной. 2. Более надежен способ Эрлиха. В пробирку с изучаемой культурой добавляют специальный реактив. 2. Более надежен способ Эрлиха. В пробирку с изучаемой культурой добавляют специальный реактив. а. В присутствии индола реактив краснеет. б. Если индола нет – реактив остается бесцветным. в. У микробов, обладающих протеолитической активностью, при утилизации белкового субстрата может образовываться (или не образовываться) аммиак. Для выявления этого признака под пробку пробирки с засеянной питательной средой помещают лакмусовую бумагу так, чтобы она не касалась поверхности среды. 1. При образовании аммиака лакмусовая бумажка синеет. 2. Если аммиак не образовывается, лакмусовая бумажка цвет не изменяет. г. У микробов, обладающих протеолитической активностью, при утилизации белкового субстрата может образовываться (или не образовываться) сероводород. 1. С этой целью под пробку пробирки с засеянной питательной средой помещают фильтровальную бумагу, пропитанную ацетатом свинца. а. При продукции бактериальной культурой сероводорода нижняя часть бумажки чернеет. б. Если культура не продуцирует сероводород – бумажка остается бесцветной. 2. Однако, метод с использованием бумажки с ацетатом свинца не надежен и в настоящее время практически не используется. Продукцию бактериями сероводорода лучше определять с помощью сред Клиглера или Олькеницкого (см. выше). 2. В ряде случаев для идентификации выделенной бактериальной культуры необходимо определить продуцирует ли она конкретные ферменты. Чаще всего выясняется наличие оксидазной и каталазной активностей. 8. Какие свойства бактерий необходимо изучить для определения их видовой принадлежности? |
