Биоэнергетический обмен. Общие пути метаболизма. Биологическое окисление.
Понятие об обмене веществ. Процессы ката- и анаболизма, их характеристика, отличия и взаимосвязь
|
Обмен веществ – совокупность процессов превращения веществ и энергии в организме и обмен веществами и энергией между организмом и окружающей средой.
Включает 3 этапа:
Поступление
Метаболизм
Выделение конечных продуктов из организма
Метаболизм:
Катаболизм
|
Анаболизм
|
Распад ВМС до мономеров с выделением энергии АТФ и НАДН2
|
Синтез макромолекул с затратой энергии
|
Отличаются по:
Локализации
Количеству реакций
Локализации
Взаимосвязь катаболизма и анаболизма основывается на единстве биохимических превращений, обеспечивающих энергией все процессы жизнедеятельности и постоянное обновление тканей организма.
Процессы анаболизма и катаболизма находятся в организме в состоянии динамического равновесия или временного превалирования одного из них.
Преобладание анаболических процессов
|
катаболических
|
приводит к росту, накоплению массы тканей
|
к частичному разрушению тканевых структур, выделению энергии
|
Состояние равновесного или неравновесного соотношения зависит от возраста:
В детском возрасте
|
У взрослых людей
|
в старческом
|
Преобладает анаболизм
|
находятся в равновесии
|
катаболизм
|
Их соотношение зависит также от состояния здоровья, физической или психоэмоциональной деятельности.
|
Метаболические пути, их виды
|
Общий путь катаболизма – реакция окислительного декарбоксилирования ПВК и цикла Кребса.
Метаболические пути:
Главные
|
Добавочные
|
Побочные
|
Универсальны
Поставляют энергию
Синтез основных биополимеров клетки
|
Менее универсальны
Синтез важных веществ
Энергия НАДФН2
В определенных тканях
|
Пути происходят при патологии
В норме иногда
|
Пример1:
Глюкоза
|
Главный
|
Добавочный
|
Побочный
|
Дихотомический (аэробный) распад:
38АТФ из 1 глюкозы
|
Пентозный цикл: В эритроцитах, эндокринных железах, печени (т.е. в определенных тканях)
Синтез пентоз, Энергия НАДФН2
|
Лактоза (пример нормы)
|
Пример2:
Фенилаланин
|
Главный
|
Добавочный
|
Побочный
|
Биосинтез белка
|
Синтез тироксина (только в щитовидной железе)
|
ФенилПВК (токсичное соединение)
|
|
Основные фазы унификации питательных веществ в организме. Центральные метаболиты
|
Фазы:
Подготовительная – не является поставщиком энергии (1%).
ВМС распадаются в ЖКТ до мономеров.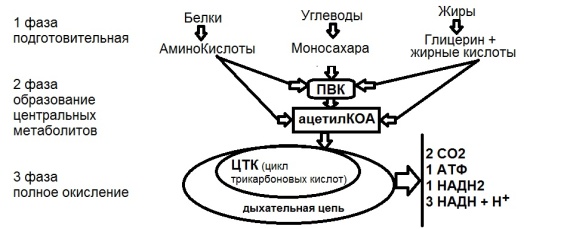
Образование центральных метаболитов – протекает в цитоплазме, завершается в митохондриях (20-30% энергии)
Полное окисление – Цикл Кребса (70-80% энергии) – в аэробных условиях полное окисление поступивших с пищей веществ.
|
Цикл Кребса, как основной «метаболический котел» клетки (формулы). Регуляция и локализация цикла Кребса
|
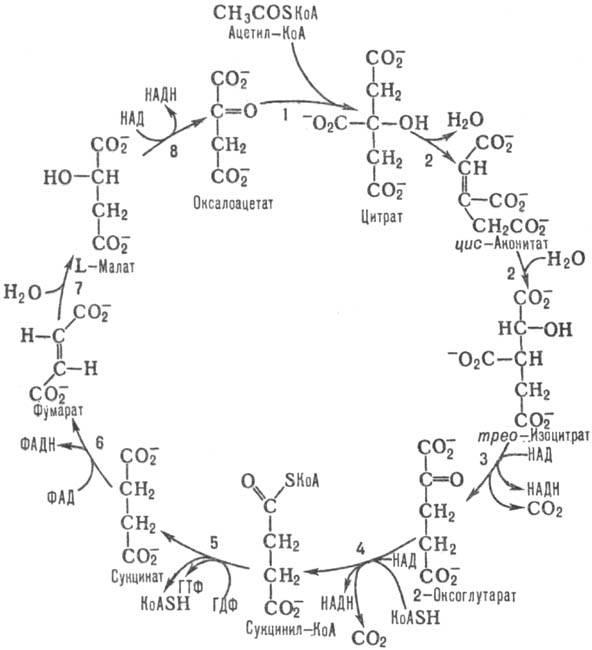
Цикл Кребса (ЦТК, цикл трикарбоновых кислот, лимоннокислый цикл)
Циклический, в аэробных условиях, в матриксе митохондрий
Реакции:
Цитрат-синтетазная
(цитрат-синтетаза: класс 4 – лиазы)
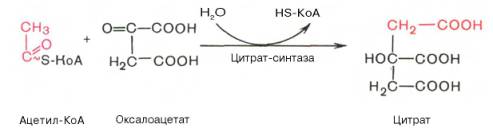
|
Изомеризация цитрата
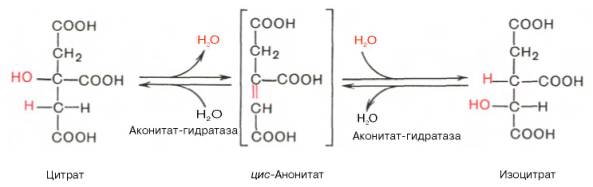
|
Изоцитрат-дегидрогеназная
(класс 1 – оксидоредуктазы)
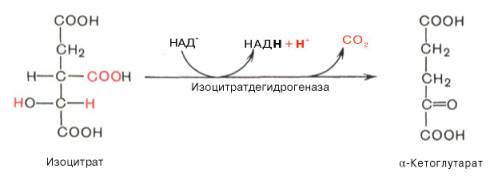
Кофактор: С, Мg2+
Кофермент: НАД, НАДФ
|
Окислительное декарбоксилирование
α-кетоглутаровой кислоты
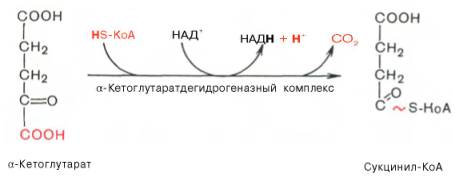
Кофактор: Мg2+
Коферменты(5): ТПФ, HS-KoA, ФАД, НАД+, амид липоевой кислоты
|
Реакция субстратного фосфорилирования (за счет энергии субстрата)
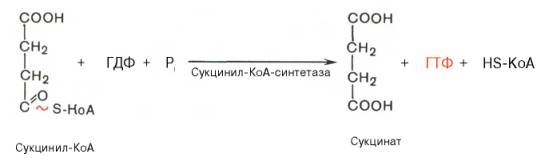
|
Сукцинат-дегидрогеназная
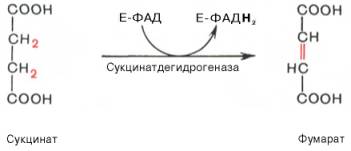
(встроена в мембрану митохондрии)
Кофермент: ФАД
|
Фумаразная реакция (класс – гидролазы)
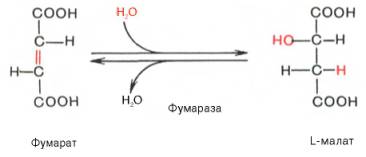
|
Малат-дегидрогеназная

|
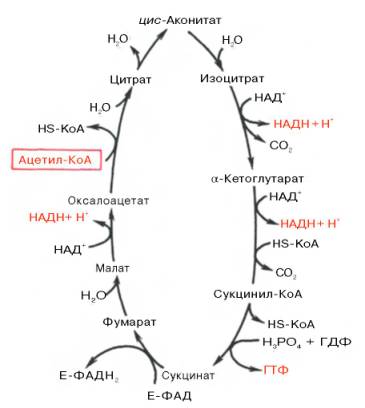 
При окислении 1 молекулы Ацетил-КОА в цикле Кребса и в системе окислительного фосфорилирования образуется 12АТФ:
1АТФ – субстратное фосфорилирование, 11АТФ – окислительное
СН3СоSКоА + 2Н2О + 3НАД + ФАД + АДФ + Рн = > 2СО2 + 3НАДН2 + АТФ + ФАДН2 + НSКоА
Функции ЦТК (Цикла Кребса):
Интегрирующая (взаимосвязь БЖУ)
Энергообразующая (12АТФ)
Анаболитическая (синтез соединений из метаболитов ЦТК)
Пример:
сукцинилКОА
|
Оксало-ацетат
|
α-кетоглутарат
|
Синтез гема
|
Глюкоза
|
глу
|
Регуляция цикла.
Регуляторные энзимы:
Цитратсинтаза
Изоцитрат-дегидрогеназа
α-кетоглутарат-дегидрогеназный комплекс
Роль витаминов:
Витамин
|
Рибофлавин (В2)
|
РР
|
Тиамин (В1)
|
Пантотеновая кислота
|
В составе кофермента
|
ФАД
|
НАД
|
ТПФ
|
КоА
|
Кофермент реакции
|
СДГ, α-кетоглутарат-ДГ комплекс
|
МДГ, ИДГ, α-кетоглутаратДГ
|
α-кетоглутаратДГ
|
ацетилКоА, сукцинилКоА
|
|
Понятие о биологическом окислении, его отличие от горения
|
Биологическое окисление – совокупность реакций окисления субстратов в живых клетках.
Главные функции окислительных процессов:
Запас энергии в утилизируемой форме
Рассеяние энергии в виде теплоты
Образование полезных соединений
Расщепление вредных веществ
Отличие БО от горения:
БО
|
Горение
|
Не является одноступенчатой реакцией
|
Одноступенчатая реакция
|
Ферментативный процесс
|
|
Только в мягких условиях
|
|
Освобождение энергии за счет восстановления водорода + Н2О
|
Освобождение энергии за счет
С => СО2
|
Часть энергии переходит в тепло,
Часть - в энергию макроэргических связей АТФ
|
Вся энергия переходит в тепловую
|
Окисление в основном частичное
|
Окисление полное
|
Сущность окисления:
Fe3+ + электрон ↔ Fe2+
Fe3+
|
Fe2+
|
Окислитель, акцептор, антиоксидант
|
Восстановитель, донор, прооксидант
|
Каждая редокс-пара – имеет свой потенциал.
Редокс-потенциал указывает направление движения электронов
|
Тканевое дыхание. Субстраты тканевого дыхания
|
Тканевое дыхание– вид биологического окисления, при котором акцептором электронов.
Субстраты ТД:
(коферменты реакций НАД,ФАД: изоцитрат, α-кетоглутарат, сукцинат, малат)
ПВК
Лактат
АК
α-глицерофосфат
жирные кислоты
Осуществляется благодаря оксидоредуктазам дыхательной цепи.
|
Дыхательная цепь, ее структура, локализация, биологическая роль
|
Дыхательная цепь – последовательность оксидоредуктаз во внутренней мембране митохондрий, осуществляющих перенос электронов и протонов от субстрата на молекулярный кислород.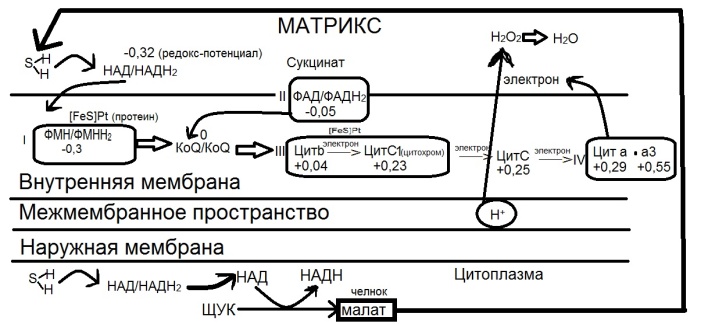
Функции:
Поставщик энергии для синтеза АТФ
50% энергии – выделяется в виде тепла
Поступление водорода в виде НАДН2 либо ФАДН2
|
Характеристика ферментных комплексов дыхательной цепи
|
Комплексы ДЦ:
Комплекс
|
Функция
|
Состав
|
Реакция
|
НАДН-КоQ-редуктаза
|
Перенос электронов от НАДН к KoQ
|
Белки и липиды негемовые [FeS]Pt, НАДН-ДГ (является флавопротеином => в составе кофермента ФМН)
|
ФМН+НАДН2=>ДМНН2+НАД
(димононуклеотидаш2)
|
Сукцинат-KoQ-редуктаза
|
Перенос электронов от сукцината к KoQ
|
СДГ (кофермент ФАД), негемое железо, липиды и белки КоQ (убихинон): Источники – витамин К и Е (антиоксиданты)
Убихинон коллектор (собирает на себя электроны и протоны)
|
КоQ+ФМНН2=>КоQН2+ФМН
|
КоQН2-цитС-редуктаза
|
Катализирует перенос электронов от КоQH2 к цитС
|
цитВ, цитС, негемовое железо, липиды и белки
В центре цитохрома железо, которое меняет валентность (редокс-пара)
|
|
Цитохром-оксидаза
|
Катализирует перенос электронов от цитС к О2
|
Цит а, цит а3, негемовое железо, липиды и белки
|
Отличия от других: аутокситабельность (перенос электронов на О2), наряду с Fe есть Cu
|
|
Использование цитоплазматического НАДН2 в дыхательной цепи. Характеристика челночных механизмов
|
Челночные механизмы – переносят восстановленные нуклеотиды (НАДН2) из цитоплазмы в митохондрии.
Челнок – малат.
В цитоплазме происходит восстановление оксоло-ацетата до малата, который проникает в митохондрию.
В митохондрии по действием митохондриальной МДТ малат переходит в ЩУК, а НАДН2 передает электроны и протоны дыхательной цепи.
|
Ингибиторы тканевого дыхания
|
Ингибиторы:
Барбитураты – блокируют переход электронов от первого комплекса к убихинону.
Ряд антибиотиков блокирует переход электронов от цитохромаВ к цитохромуС (комплекс3).
Цианиды, угарный газ – ингибиторы цитохромоксидазы (комплекс4)
Цианиды – ингибиторы Fe2+
Угарный газ - ингибитор Fe3+
|
Окислительное фосфорилирование. Свободнорадикальное окисление
Окислительное фосфорилирование, его механизм и значение
|
Фосфорилирование – образование АТФ из АДФ и неорганического фосфата за счет энергии.
Различают 2 вида (в зависимости от вида энергии):
Окислительное фосфорилирование
|
Субстратное фосфорилирование
|
Энергия дыхательной цепи (тканевого дыхания)
|
Энергия субстрата
|
Для образования 1 молекулы АТФ необходимо:
затрата 7,3ккал
перепад редокс-потенциалов между соседними участками дыхательной цепи 0,2В
Р/О (фосфор/кислород) – коэффициент фосфорилирования – число моль неорганического фосфата переведенных в органическую форму (АТФ) в расчете на каждый поглощенный атом кислорода.
Механизмы окислительного фосфорилирования (ОФ)
Основные положения ОФ:
движущей силой ОФ является протонный градиент ∆ μН+ /дельта мю аш/
Электроны, пробегая по ДЦ, каскадно дробно теряют энергию.
За счет этой энергии против градиента концентрации происходит перемещение протонов через мембрану (4Н+ на уровне 1го, 4Н+ на уровне 3го, 2Н+ на уровне 4го) из матрикса.
Заряд с одной стороны мембраны
|
отрицательный
|
положительный
|
Среда с одной стороны мембраны
|
щелочная
|
кислая
|
∆ μН+=∆ᴪ +∆рН+
∆ᴪ - мембранный потенциал, ∆рН – градиент рН
Протоны в дальнейшем возвращаются в матрикс митохондрий по градиенту концентрации по каналу, образованному белком-ферментом АТФ-синтазой, которая состоит из 2х компонентов F0F1
При этом выделяется энергия для синтеза АТФ
ОФ требует целостности мембраны (внутренней митохондриальной)
Внутренняя мембрана митохондрий не проницаема для ионов (Н+,К+…)
|
Сопряжение тканевого дыхания и окислительного фосфорилирования
|
Для образования 1 молекулы АТФ необходимо:
затрата 7,3ккал
перепад редокс-потенциалов между соседними участками дыхательной цепи 0,2В
Пункты фосфорилирования (точки сопряжения)
В дыхательной цепи – 3 участка (с перепадом в 0,2В):
На уровне 1,3,4 ферментного комплекса.
2й ферментный комплекс не задействован.
Вывод:
Тканевое дыхание заряжает мембрану, ОФ разряжает мембрану
Энергопреобразующие мембраны сначала генерируют ∆ μН+, а затем реализуют его через АТФ-синтазу
АТФ-синтаза (похож на гриб)
«Шляпка гриба»
|
«Ножка гриба»
|
Фермент АТФ-аза (F1), состоит из 9 субъединиц
|
F0 – канал, встроенный в мембрану, по которому пробегают протоны.
«О» - олиголизин, ингибитор фермента
|
|
Регуляция окислительноего фосфорилирования (дыхательный контроль, действие разобщителей)
|
Уровни регуляции:
Дыхательный контроль
– изменение скорости дыхания с изменением концентрации АДФ.
 При повышении концентрации АДФ => активизируется ЦТК, ДЦ, ОФ При повышении концентрации АДФ => активизируется ЦТК, ДЦ, ОФ
При снижении концентрации АДФ => тормозится ЦТК, ДЦ, ОФ
Разобщители
– разобщают перенос электронов и синтез АТФ.
Разобщают тканевое дыхание (ТД) и ДЦ.
ДЦ работает, но энергия ТД идет на тепло, а не на АТФ.
Примеры разобщителей:
Естественной природы (прогестерон, тестостерон, холод)
Патологические (дифтерийный токсин)
Искусственные (ряд антибиотиков)
|
Свободное окисление. Бурый жир
|
Свободное (нефосфорилирующее) окисление
В митохондриях дыхание не всегда сопровождается фосфорилированием.
Бурый жир – термогенная ткань.
У человека бурый жир находится у ключиц и вдоль позвоночника.
Бурый – т.к. содержит много цитохромов (а в них Fe), а так же много митохондрий, кровеносных сосудов, симпатических нервных волокон.
Внутренняя мембрана митохондрий бурого жира имеет специальные поры для ионов Н+. В них белок термогенин (из гема).
Термогенин встроен в мембрану. Он разобщающий белок.
|
Субстратное фосфорилирование, его отличие от окислительного фосфорилирования
|
Субстратное фосфорилирование (СФ) – образование АТФ за счет превращения субстрата, имеющего макроэргическую связь.
Пример1: (реакция №5 из ЦТК)

Реакция проходит в митохондриях в аэробных условиях.
ГТФ – образуется за счет субстрата
Пример2: пируват-киназная реакция (из гликолиза)
Отличия ОФ от СФ:
Окислительное фосфорилирование
|
Субстратное фосфорилирование
|
За счет энергии окисления (электроны в ДЦ)
|
За счет энергии субстрата
|
В митохондриях
|
В митохондриях и в цитоплазме
|
Главный генератор энергии
|
Дополнительный (но может стать главным при нехватке кислорода)
|
Аэробный процесс
|
Аэробный, анаэробный
|
Зависит от разобщителей
|
Не зависит от разобщителей
|
|
Пути образования свободных радикалов, микросомальное окисление. Биологические эффекты свободных радикалов
|
Использование кислорода в организме:
80-90% расходуется в ДЦ
В цепи микросомального окисления
Реакции катализируемые: оксигеназами (моно- и диоксигеназами)
Свободно-радикальное окисление.
Свободный радикал – молекула с неспаренным электроном на орбите.
Свободно-радикальное окисление – универсальный процесс, сопровождающий нормальную жизнедеятельность и активизирующийся при патологии.
Свободный радикал образуется в организме:
В ДЦ (при образовании эндогенной воды на уровне убихинона)
При фагоцитозе
При микросомальном оксилении
При синтезе ряда гормонов
Активные формы кислорода:
Перекись водорода
Свободный радикал
Супероксид радикал
Гидроксил радикал (самый мощный мутаген)
Оксид азота
Образование активных форм кислорода:
О2 + электрон => супероксид радикал (Ȱ2)
Супероксид радикал + электрон + 2Н+ => вода
Вода + электрон + Н+ => вода + гидроксил радикал (ȮН)
Гидроксил радикал + электрон + Н+ => вода
Пути образовании супероксид радикала:
Ферментативный
|
Неферментативный
|
Под влиянием УФ-излучения
|
Ксантин-оксидазная реакция
|
Образование адреналина
|
|
Перекись водорода – цитотоксична
Пути образования:
Ферментативный
|
Неферментативный
|
В митохондриях: СОД-фермент
В пероксисомах: уратоксидаза
|
|
Образование гидроксил радикала:
Н2О2 + супероксид радикал (Ȱ2) => гидроксил радикал (ȮН) + ОН-+ О2
Образуется при облучениях.
Активные формы кислорода:
повреждают все молекулы
инактивируют ферменты
перекисное окисление липидов (ПОЛ)
окисление модификаций белков
полимеризация углеводов
разрыв связей НК
ПОЛ необходим для синтеза простагландинов, лейкотриенов,…
ПОЛ: повреждаются полиненасыщенные жирные кислоты фосфолипидов мембран
RH (жирная кислота) => R∙ => ROO∙ (пероксидный радикал) => ROOH (гидропероксид)
ROOH => RO∙ + ȮН (гидроксил радикал – самый страшный)
В результате избыточного ПОЛ образуются:
Активация ПОЛ (и др окислителей) – при многих радикальных окислениях:
Лучевые поражения
Опухоли
Гипоксия
Ишемия
Старение
|
Антиоксидантная система организма. Ферменты – антиоксиданты. Неферментативные антиоксиданты
|
Антиоксидантная система – система защиты биополимеров от деструкции
Ферментативные антиоксиданты
|
Неферементативные
|
Богаты эритроциты
Н2О2 + АН2 => (пероксидаза) => 2Н2О + А
АН2 – донор протонов
Супер-оксид-дисмутаза (СОД)
Богаты эритроциты
Ȱ2 (супероксид радикал)+ Ȱ2 + 2Н+ => (сод) => Н2О2 + О2
Сu и Zn – кофакторы СОД
Лечение ожогов глаз
Н2О2 + 2GSH(восстановленный)=> (глутатион-пероксидаза) => 2Н2О + GSSG (окисленный)
(он работает при малых концентрациях, при больших вкл остальные)
GSH – в активном центре содержит Se
Глутатион-редуктаза
Церулло-плазмин
Главный антиоксидант плазмы крови
Кроме АО, еще и фермент (Fe2+=> Fe3+ -антиоксидант)
|
(С, α-токоферол, β-каротин, К, Р)
(церуло-плазмин, лактоферрин, трансферрин, альбумин)
(Se, Zn)
(эстроген, тироксин)
(серотонин)
АК (ароматические)
Пигмент меланин
Убихинон
Глутатион
|
Антиоксиданты могут быть:
Внутриклеточные
|
Мембранные (α-токоферол)
|
Во внеклеточных жидкостях
|
Антиоксиданты могут быть:
Первичные
|
Вторичные
|
Третичные
|
Предупреждают образование свободных радикалов (СОД)
|
Удаляют уже образованные (витамины)
|
ДНК-репарирующие ферменты
Восстанавливающие поврежденные ДНК структуры
|
|
Перекисное окисление липидов
|
Перекисное окисление липидов (ПОЛ) — окислительная деградация липидов, происходящая, в основном, под действием свободных радикалов. Одно из главных последствий радиоактивного облучения.
Реакции биологического окисления сопровождаются образованием свободных радикалов. Это обусловливает высокую химическую активность этих радикалов. Например, они вступают в реакцию с ненасыщенными жирными кислотами мембран, нарушая их структуру.
Через стадию перекисных производных ненасыщенных жирных кислот осуществляется:
биосинтез простагландинов и лейкотриенов
тромбоксаны, оказывающие мощное влияние на адгезивно-агрегационные свойства форменных элементов крови и микроциркуляцию, сами являются гидроперекисями.
Образование гидроперекисей холестерина — одно из звеньев в синтезе прогестерона
|
Цитохромы – структура, биологическая роль, локализация в дыхательной цепи.
|
ЦИТОХРОМЫ - сложные белки (гемопротеиды), содержащие в качестве простетической группы гем.
Служат переносчиками электронов в процессах внутриклеточного дыхания, окислительного фосфорилирования, фотосинтеза, ферментативного гидроксилирования и в других биологических ОВР.
В зависимости от природы гема цитохромы делят на 4 группы: а, b, с и d.
У цитохрома а
|
цитохром b
|
у цитохрома с
|
у цитохрома d
|
гем имеет строение протопорфирина и содержит формильный заместитель
|
содержит протогем (ферропрото-порфирин), нековалентно связанный с полипептидной цепью
|
боковые заместители протопорфирина ковалентно связаны с полипептидной цепью
|
гем представлен дигидро-порфирином (хлорином)
|
Атом Fe, входящий в состав гемов цитохромов и подвергающийся окислению и восстановлению, координирован 4 связями с атомами N порфириновых колец и 2 - с лигандами, принадлежащими полипептидным цепям (остатки гистидина, цистеина).
Все цитохромы ярко окрашены и имеют характерные спектры поглощения света в видимой области, меняющиеся при их окислении или восстановлении.
Донорами электронов для цитохромов
|
акцепторами
|
обычно служат флавины, гидрохиноны, железо-серные белки или другие цитохромы
|
другие цитохромы или кислород (цитохромоксидазы)
|
Некоторые цитохромы (цитохромоксидаза, цитохром Р-450) прочно связаны с мембранами митохондрий, микросом (липопротеидные комплексы) и не растворимы в воде, другие (напр., цитохром с) растворимы в ней.
Цитохромы реагируют с лигандами, конкурирующими с естественным координационным окружением атома Fe гемов (СО, анионы азида, цианида и др.). Связывание этих лигандов приводит к инактивации цитохромов.
|
Микросомальное окисление
|
Микросомальное окисление – один из путей использования кислорода в клетке.
O2 – окончательный акцептор, внедряется в молекулы окисляемых веществ – ксенобиотиков, выполняя пластическую функцию.
Микросомальное окисление осуществляется при участии групп ферментов – микросомальных монооксигеназ.
RH + HAДФН2 + O2 => (моноксигеназы, Р450) => ROH + НАДФ +Н2О + R∙
RH – плохо растворимые гидрофобные соединения
RОH – гидроксилированные производные
Цитохром Р-450 – фермент, связывающий и метаболизирующий в организме множество неполярных химических соединений и во многих случаях являющийся первым барьером, определяющим характер и степень воздействия химических веществ на клетку.
Ксенобиотики – вещества, не являющиеся участниками нормально протекающих биохимических реакций в клетках: лекарства, антибиотики, инсектициды, пестициды… Некоторые из них не имеют фармакологические, токсикологические, канцерогенные, мутагенные свойства.
Роль микросомального окисления:
Повышение гидрофильности токсического вещества, улучшение его выведения, снижение токсичности
Химическая модификация структуры ксенобиотика, в результате – частичная или полная потеря его токсичности
Особенности действия:
Обезвреживание ксенобиотиков в норме зависит от их структуры, некоторые вещества не способны обезвреживаться и концентрируются в организме.
В результате окисления ряда ксенобиотиков изменяется их метаболическая активность, повышается токсичность
Каждый ксенобиотик имеет предельно допустимую концентрацию, превысив которую, он не может быть нейтрализован
Микросомальные монооксигеназы – комплекс ферментов, катализирующих восстановление одного атома молекулы О2 с образованием воды и включение другого атома кислорода в окисляемое вещество.
Все ферменты микросомальной системы – мембранные белки, активные центры которых локализованы на цитоплазматической поверхности ЭР.
Основной ее компонент – гемопротеин цитохром Р-450
|
АТФ - синтетаза, структура и функция.
|
АТФ-синтаза (Н+-АТФ-аза) - интегральный белок внутренней мембраны митохондрий.
Расположен в непосредственной близости к дыхательной цепи.
АТФ-синтаза состоит из 2 белковых комплексов:
Гидрофобный F0
|
F1
|
погружён в мембрану
служит основанием, которое фиксирует АТФ-синтазу в мембране
состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс
|
выступает в митохондриальный матрикс
состоит из 9 субъединиц (Зα, 3β, γ, ε, δ)
субъединицы уложены попарно, образуя "головку"
между α- и β-субъединицами располагаются 3 активных центра
γ-, ε-, δ- субъединицы связывают комплекс F1 с F0
|
Повышение концентрации протонов в межмембранном пространстве активирует АТФ-синтазу. Электрохимический потенциал ΔμH+ заставляет протоны двигаться по каналу АТФ-синтазы в матрикс. Параллельно под действием ΔμH+ происходят конформационные изменения в парах α, β-субъединиц белка F1, в результате чего из АДФ и неорганического фосфата образуется АТФ. Электрохимический потенциал, генерируемый в каждом из 3 пунктов сопряжения в ЦПЭ, используют для синтеза одной молекулы АТФ.
|
Энергетический баланс цикла Кребса.
|
В ЦТК образуется:
2 молекулы СО2 (в изоцитрат-дегидрогеназной и α-кетоглутарат-дегидрогеназной реакциях)
3 молекулы НАДН2
1 молекула ФАДН2
Окисление НАДН2 в дыхательной цепи митохондрий дает:
3 молекулы АТФ на каждую молекулу НАДН2
2 молекулы АТФ на каждую молекулу ФАДН2
За счет субстратного фосфорилирования:
ИТОГ: при полном окислении 1 молекулы ацетилКоА => СО2 + Н2О + 12 молекул АТФ
|
Дыхательный контроль – основной механизм регуляции окислительного фосфорилирования
|
Сопряжение окисления с фосфорилированием в митохондриях отличается прочностью: если невозможен синтез АТФ, то прекращается и перенос электронов в дыхательной цепи.
Внесение АДФ => начинается дыхание + синтез АТФ
Дыхания прекращается, когда вся АДФ превратится в АТФ
Дыхательный контроль - зависимость дыхания митохондрий от концентрации АДФ
Некоторые вещества разобщают окисление и фосфорилирование. Тогда потребление кислорода и окисление субстратов продолжаются, но синтез АТФ невозможен. Энергия окисления при разобщении рассеивается в форме теплоты.
|
KoQ, его структура, место и роль в дыхательной цепи, связь с витаминами
|
KoQ играет важную роль в механизме транспорта протонов через митохондриальную мембрану в пунктах сопряжения. 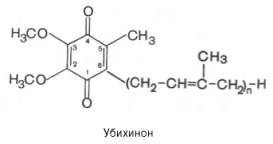
KoQ обязательный компонент дыхательной цепи:
осуществляет в митохондриях перенос электронов от мембранных дегидрогеназ (в частности, НАДН-дегидрогеназы дыхательной цепи, СДГ и т.д.) на цитохромы.
| |
 Скачать 305.09 Kb.
Скачать 305.09 Kb.













 При повышении концентрации АДФ => активизируется ЦТК, ДЦ, ОФ
При повышении концентрации АДФ => активизируется ЦТК, ДЦ, ОФ