Биоэнергетика
 Скачать 314 Kb. Скачать 314 Kb.
|
|
БИОЭНЕРГЕТИКА Биоэнергетика занимается изучением энергетических превращений, сопровождающих биохимические реакции. Реакции, сопровождающиеся уменьшением свободной энергии (G), называют экзергоническими. Такие реакции протекают самопроизвольно. Реакции, сопровождающиеся возрастанием свободной энергии, называют эндергоническими. Эти реакции будут протекать только при поступлении свободной энергии извне. Сопряжение эндергонических процессов с экзергоническими На практике эндергонический процесс не может протекать изолированно. Т.е. он должен быть компонентом сопряженной экзергонической/ эндергонической системы, которая в целом является экзергонической. Катаболические превращения обычно являются экзергоническими реакциями, тогда как анаболические – эндергоническими. Совокупность катаболических и анаболических процессов и составляют метаболизм. Жизненно важные процессы – реакции синтеза, мышечное сокращение, проведение нервного импульса, активный транспорт – получают энергию путем химического сопряжения с окислительными реакциями. Например, превращение метаболита А в метаболит В сопровождается выделением свободной энергии. Оно сопряжено с другой реакцией – превращением метаболита С в метаболит Д, которое может происходить лишь при поступлении свободной энергии. 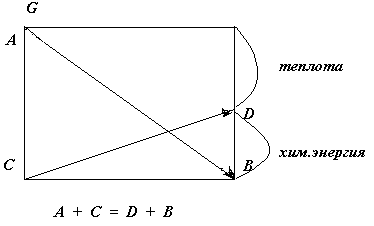 Механизм сопряжения экзергонических и эндергонических процессов, как правило, заключается в синтезе в ходе экзергонической реакции соединения с высоким энергетическим потенциалом и последующем включении этого нового соединения в эндергоническую реакцию, что обеспечивает передачу свободной энергии от экзергонической реакции к эндергонической. В живых клетках главным высокоэнергетическим промежуточным продуктом служит АТФ. Свободная энергия гидролиза АТФ и других органических фосфатовСтандартная свободная энергия гидролиза концевого фосфата АТФ составляет –30,5 кДж/моль. Эта величина разделяет все органические фосфаты на две группы. Если у фосфатов свободная энергия гидролиза меньше, чем у АТФ – это низкоэнергетические фосфаты, если же свободная энергия гидролиза у фосфатов больше, чем у АТФ – это высокоэнергетические фосфаты. стандартная свободная энергия гидролиза некоторых органических фосфатов фосфоенолпируват - 61,9 кДж/моль карбамоилфосфат - 51,4 1,3-дифосфоглицерат - 49,3 креатинфосфат - 43,1 АТФ АДФ + Фн - 30,5 АДФ АМФ + Фн - 27,6 глюкозо-1-фосфат - 20,9 АМФ - 14,2 Другими биологически важными соединениями, которые классифицируются как богатые энергией являются тиоловые эфиры, образуемые коферментом А (например, ацетил-КоА), S-аденозилметионин (SAM), УДФ-глюкоза, ЦДФ-холин, эфиры аминокислот, участвующих в синтезе белков (аа-тРНК) и т.д. Роль высокоэнергетических фосфатов как “энергетической валюты” клетки Среднее положение АТФ по величине стандартной свободной энергии гидролиза позволяет ему служить донором высокоэнергетического фосфата для соединений, имеющих меньшую, чем АТФ величину стандартной свободной энергии гидролиза. В то же время при наличии соответствующих ферментных систем АДФ может акцептировать высокоэнергетический фосфат (с образованием АТФ) от тех соединений, которые обладают большей величиной стандартной свободной энергии гидролиза. Т.о., цикл АДФ/АТФ связывает процессы, генерирующие высокоэнергетический фосфат, с процессами, потребляющими энергию высокоэнергетических фосфатов. Понятие об энергетическом заряде клеткиСуммарная концентрация адениловых нуклеотидов в клетке постоянна, но относительные концентрации адениловых нуклеотидов могут изменяться вследствие их взаимопревращений. Во многих клетках концентрации АТФ, АДФ и АМФ относятся примерно как 100 : 10 : 1. Отсюда следует, что небольшие изменения концентрации АТФ могут приводить к значительным изменениям концентрации других нуклеотидов. Это имеет существенное значение, поскольку адениловые нуклеотиды способны выступать в роли аллостерических эффекторов и изменять активность ряда аллостерических ферментов энергетического обмена. Для оценки влияния системы адениловых нуклеотидов на метаболические процессы пользуются величиной энергетического заряда клетки: Если весь фонд адениловых нуклеотидов представлен только АТФ (максимум высокоэнергетических связей), то энергетический заряд равен единице. Если в клетке имеется только АМФ (высокоэнергетических связей нет), то энергетический заряд равен нулю. В большинстве клеток энергетический заряд равен 0,8-0,9, т.е. адениловая система клетки почти насыщена энергией. При уменьшении энергетического заряда скорость потребления кислорода и реакций общего пути катаболизма возрастает. Механизмы образования АТФ в клетке Имеется два пути синтеза АТФ в клетке: 1) окислительное фосфорилирование и 2) субстратное фосфорилирование. Окислительное фосфорилирование является главным путем синтеза АТФ из АДФ и Фн. С помощью этого механизма в клетках миокарда и скелетных мышц синтезируется около 90% АТФ. Реакция энергетически сопряжена с переносом электронов с восстановленных коферментов на кислород и требует наличия неповрежденной митохондриальной мембраны. Альтернативный путь синтеза АТФ из АДФ и Фн – субстратное фосфорилирование. В этом случае происходит перенос фосфата с высокоэнергетических фосфатов клетки на АДФ с образованием АТФ. Это происходит в ходе а) креатинкиназной реакции: Креатинфосфат + АДФ → креатин + АТФ и в ходе 2-х реакций гликолиза: б) фосфоглицераткиназной 1,3-дифосфоглицерат + АДФ → 3-фосфоглицерат + АТФ и в) пируваткиназной фосфоенолпируват + АДФ → пируват + АТФ В этом случае механизм сопряжения не нуждается в наличии кислорода и неповрежденной митохондриальной мембраны. Цепь переноса электронов (ЦПЭ) или дыхательная цепь Окисление субстратов в процессе дыхания можно представить как перенос электронов и протонов от органических веществ на кислород: S·H2 + ½ O2 S + H2O Перенос электронов на кислород происходит при участии системы переносчиков, встроенных во внутреннюю мембрану митохондрий и образующих цепь переноса электронов (ЦПЭ) или дыхательную цепь. В состав ЦПЭ входят 4 ферментативных комплекса: НАДН-дегидрогеназа (I), сукцинатдегидрогеназа (II), Q·H2-дегидрогеназа (III), цитохромоксидаза (IV), а также 2 низкомолекулярных переносчика: гидрофобная молекула кофермента Q и цитохром С – небольшой по размерам белок. Все компоненты ЦПЭ расположены в митохондриальной мембране в порядке возрастания редокс потенциала (окислительно-восстановительного потенциала); самый высокий редокс–потенциал у кислорода. Это обеспечивает последовательное перемещение электронов от НАДН·Н+ на кислород, при этом происходит выделение энергии на каждом этапе ЦПЭ. Атомы водорода или электроны перемещаются по цепи от более электроотрицательных компонентов к более электроположительному кислороду. Изменение окислительно-восстановительного потенциала при переходе от системы НАД+/НАДН к системе О2/Н2О составляет 1,1 В.  Водород от первичных доноров (цитрат, 2-оксоглутарат, малат, пируват, глутамат) вводится в дыхательную цепь при участии НАД-зависимых дегидрогеназ (с образованием НАДН·Н+). С НАДН·Н+ водород поступает на I ферм. комплекс (НАДН-дегидрогеназу), который состоит из нескольких пептидных цепей и в качестве простетической группы содержит флавинмононуклеотид (ФМН): НАДН·Н+ + Е1(ФМН) → НАД+ + Е1(ФМН·Н2) С ФМН·Н2 электроны переносятся на ряд железосерных белков (FeS), играющих роль второй простетической группы в молекуле НАДН-дегидрогеназы. От железосерных белков электроны переносятся на кофермент на КоQ (убихинон) с образованием КоQ·H2 (убихинола). КоQ является митохондриальным липидом. Молекулы убихинона в зависимости от источника, из которого они выделены, различаются длиной углеводородной цепи. У млекопитающих она содержит 10 изопреноидных звеньев и обозначается как Q10. Убихинон выполняет функцию сборщика, присоединяя электроны от НАДН-дегидрогеназы и других флавинзависимых дегидрогеназ, в частности, от сукцинатдегидрогеназы: Е1(ФМН·Н2) + КоQ → Е1(ФМН) + КоQ·Н2 Поскольку содержание КоQ значительно превосходит содержание других компонентов дыхательной цепи, считается, что он является подвижным компонентом ЦПЭ, который получает восстановительные эквиваленты от фиксированных флавопротеиновых комплексов и передает их на цитохромы.  Цитохромы – это электронпереносящие белки, молекула которых содержит в качестве простетической группы гем. Цитохромы дыхательной цепи выстроены в порядке возрастания окислительно-восстановительного потенциала и обозначаются латинскими буквами: b, c1, c, a и a3. КоQ·Н2-дегидрогеназа (комплекс III) состоит из двух типов цитохрома b (b562 и b566) и цитохрома с1. КоQ·Н2-дегидрогеназа переносит электроны от КоQ·Н2 на цитохром с. Внутри комплекса III электроны последовательно передаются от цитохрома b на FeS, с него на цитохром с1, и затем на цитохром с. Цитохром с – периферический водорастворимый мембранный белок, имеющий одну полипептидную цепь из 100 аминокислотных остатков и молекулу гема, ковалентно связанную с полипетидом. Терминальный цитохром а-а3, называемый также цитохромоксидазой, осуществляет перенос восстановительных эквивалентов на молекулярный кислород. Цитохромоксидаза содержит медь и имеет очень высокое сродство к кислороду, что позволяет дыхательной цепи функционировать с максимальной скоростью до тех пор, пока в ткани не будет практически исчерпан кислород: О2 + 4 e + 4 H+ 2 Н2О Хемиосмотическая гипотеза сопряжения окисления и фосфорилирования Для объяснения механизма сопряжения окисления и фосфорилирования было выдвинуто несколько гипотез, из которых экспериментальное подтверждение получила только хемиосмотическая теория, предложенная Питером Митчеллом в 1961 году. Согласно этой теории первичным процессом в окислительном фосфорилировании является транслокация протонов (Н+) на наружную сторону внутренней митохондриальной мембраны. При этом предполагается, что мембрана непроницаема для ионов вообще и особенно для протонов, которые накапливаются на наружной стороне мембраны, создавая по обе стороны мембраны разность электрохимических потенциалов (н+). Она складывается из химического потенциала (разность рН) и электрического потенциала. Разность электрохимических потенциалов обеспечивает действие локализованной в мембране АТФ-синтазы, которая в присутствии АДФ и Фн синтезирует АТФ. Предполагается, что дыхательная цепь уложена в мембране в виде трех окислительно-восстановительных петель, каждая из которых состоит из переносчиков водорода и переносчиков электронов: АТФ-синтаза по своей структуре похожа на гриб. При этом шляпка гриба, представляющая собой фосфорилирующие субъединицы (F1-субъединица), ответственные за образование АТФ, находятся на поверхности внутренней мембраны, обращенной в матрикс. А ножка гриба представляет собой канальную часть (Fo-субъединица) АТФ-синтазы, пронизывающей всю толщу внутренней мембраны. Электрохимический потенциал заставляет протоны двигаться с наружной поверхности внутрь, к F1-субъединице, обладающей каталитической активностью, т.е. способностью катализировать образование АТФ из АДФ и Фн. Коэффициент фосфорилирования Оценка эффективности улавливания энергии интактными митохондриями показывает, что при окислении субстратов, идущем с участием НАД-зависимых дегидрогеназ и дыхательной цепи, происходит включение 3 молей неорганического фосфата в АДФ и образуется 3 моля АТФ на ½ моля потребленного кислорода. Отношение Р/О (коэффициент фосфорилирования) = 3. В то же время при окислении субстрата через флавопротеиновую дегидрогеназу образуется только 2 моля АТФ, т.е. Р/О = 2. Дыхательный контроль Образующийся АТФ при участии АДФ/АТФ-транслоказы транспортируется из матрикса на наружную сторону мембраны в обмен на АДФ и попадает в цитозоль. Поэтому именно АДФ определяет скорость дыхания митохондрий. Это обусловлено тем, что окисление и фосфорилирование жестко сопряжены, т.е. функционирование дыхательной цепи не может осуществляться, если оно не сопровождается фосфорилированием АДФ. Зависимость скорости дыхания митохондрий от концентрации АДФ называется дыхательным контролем. Этот механизм регуляции имеет очень важное значение, т.к. в результате его действия скорость синтеза АТФ определяется потребностью клетки в энергии: при увеличении расходования АТФ в клеточных процессах увеличивается концентрация АДФ, а это автоматически ведет к ускорению дыхания и фосфорилирования. Разобщение окисления и фосфорилирования Н  екоторые вещества способны разобщать окисление и фосфорилирование. К таким веществам в частности относится 2,4-динитрофенол. Это липофильное вещество легко диффундирует через митохондриальную мембрану как в ионизированной, так и в неионизированной форме и т.о. может переносить ионы водорода через мембрану в сторону их меньшей концентрации. Поэтому 2,4-динитрофенол уничтожает н+ митохондриальной мембраны, а энергия рассеивается в форме теплоты. Потребление кислорода и окисление субстратов при этом продолжается, но синтез АТФ невозможен. Ингибиторы тканевого дыхания Ингибиторы окисления прерывают поток электронов на участках дыхательной цепи, блокируя одно из трех звеньев образования протонного потенциала, Первая группа препаратов блокирует поток электронов на участке между НАД и КоQ. К этим препаратам относятся барбитураты - амитал или барбамил (малые транквилизаторы), ротенон (инсектицид), пиерицидин (антибиотик). Вторая группа ингибиторов окисления, к которым относится антимицин А (антибиотик) блокирует поток электронов на участке цит. b566-FeS-белок, т.е. на уровне второго звена сопряжения. Третья группа ингибиторов окисления, к которым относятся цианиды, азиды, оксид углерода, сероводород блокируют цитохромоксидазу. Ингибиторы фосфорилирования действуют на АТФ-синтазу, препятствуя использованию протонного потенциала для синтеза АТФ. К этим веществам относятся олигомицин и дициклокарбодиимид.
Энергетический обмен и теплопродукция  На всех этапах превращения энергии пищевых веществ в энергию АТФ, а также в процессе использования АТФ для совершения работы часть энергии рассеивается в форме теплоты (см. рис.). Свободная энергия окисления НАДН в дыхательной цепи (НАДН·Н+ + ½ О2 НАД+ + Н2О) равна 220 кДж/моль. На образование трех макроэргических связей (Р/О = 3) используется 150 кДж/моль. Т.о. на этом этапе используется несколько больше половины (68%) всей энергии; остальная часть рассеивается в форме теплоты. При использовании АТФ для совершения работы значительная часть энергии также превращается в теплоту. Именно поэтому при напряженной физической работе, когда синтезируется и расходуется много АТФ, человеку становится жарко: теплоты образуется столько, что включаются специальные механизмы для удаления ее избытка из организма. Наоборот, при снижении температуры тела включается механизм дрожания для увеличения продукции теплоты. В состоянии покоя, в лежачем или сидячем положении расходование энергии на внешнюю работу минимально и теплопродукция становится главным путем расхода энергии организмом. Такое состояние энергетического обмена называют основным обменом. Интенсивность основного обмена можно оценить количественно по величине теплопродукции или косвенно по количеству потребленного кислорода. Для взрослого человека она составляет 350 кДж/ч. В других состояниях энергетические траты складываются из энергии основного обмена и энергии, затрачиваемой на внешнюю работу. Нарушения энергетического обмена У клеток, находящихся в состоянии покоя, скорость дыхания определяется доступностью АДФ. При повышении скорости дыхания, вызванном, например, физической работой, факторами, лимитирующими скорость дыхания, становятся доступность кислорода или возможности самой дыхательной цепи при насыщающих количествах всех субстратов и компонентов. При голодании фактором, лимитирующим скорость дыхания, становится доступность субстратов – доноров водорода. Наиболее частой причиной гипоэнергетических состояний в клинике является гипоксия. Причинами гипоксии могут быть нарушение кровообращения вследствие нарушения проходимости дыхательных путей, сердечной недостаточности, кровопотерь, при спазме или тромбозе сосудов, блокировании гемоглобина. Гипоксия мозга является наиболее частой непосредственной (последней) причиной смерти. Поэтому среди реанимационных мероприятий важное место занимают меры, направленные на восстановление снабжения органов кислородом. Таблица. Гипоэнергетические состояния
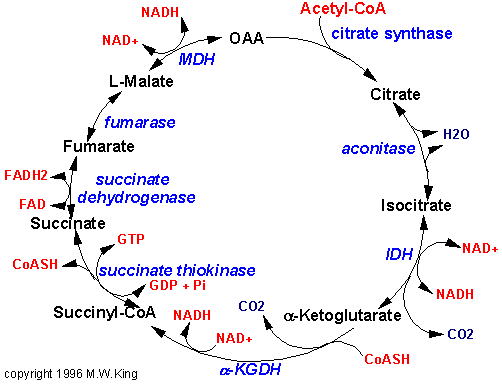
Фазы освобождения энергии из питательных веществВ ходе извлечения энергии из различных субстратов можно условно выделить три фазы катаболизма питательных веществ. Первая фаза - подготовительная. Она необходима для превращения полимеров, поступающих с пищей или находящихся внутри клетки, в удобную для извлечения энергии форму - мономеры. Протекает под действием гидролаз ЖКТ и цитоплазмы клетки. На этом этапе  освобождается около 1% всей энергии, запасенной в питательных веществах. Эта энергия рассеивается в форме теплоты. Вторая фаза – специфические пути каталолизма, которые включают частичный распад мономеров до ключевых промежуточных продуктов: пирувата, ацетил-КоА и некоторых метаболитов цикла Кребса (2-оксоглутарата, сукцинил-КоА, фумарата, оксалоацетата). На этом этапе освобождается около 20% энергии, заключенной в субстрате, часть из которой запасается в форме АТФ. Третья фаза - окончательный распад всех веществ до CO2 и H2O. Этот этап включает 1) реакции общего пути катаболизма (окислительное декарбоксилирование пирувата, цикл Кребса) и 2) цепь переноса электронов. Все реакции этой фазы локализуются в митохондриях. В эту фазу освобождается примерно 80% всей энергии, заключенной в субстратах, часть из которой запасается в форме АТФ. Общие пути катаболизма Начальные этапы катаболизма питательных веществ, получившие название специфических путей катаболизма, происходят при участии ферментов, специфичных для каждого класса веществ, и завершаются образованием пировиноградной кислоты (пирувата) и уксусной кислоты в форме ацетил-КоА. После образования пирувата дальнейший путь распада веществ до конечных продуктов СО2 и Н2О происходит одинаково в общем пути катаболизма (ОПК). Общий путь катаболизма включает: 1) окислительное декарбоксилирование пирувата; 2) цикл лимонной кислоты (цикл Кребса или цикл трикарбоновых кислот). Реакции ОПК происходят в матриксе митохондрий и образующиеся в ОПК восстановленные коферменты передают водород непосредственно на компоненты ЦПЭ, расположенные во внутренней мембране митохондрий. Окислительное декарбоксилирование пирувата Пируват, образовавшийся в результате гликолиза, окисляется до ацетил -КоА в ходе процесса, называемого окислительным декарбоксилированием пирувата. В этом процессе участвуют ферменты, работающие в определенной последовательности и объединенные в мультиферментный пируватдегидрогеназный комплекс (ПДГК). В состав этого комплекса входит 3 фермента и 5 коферментов. Ферменты: Пируватдегидрогеназа (Е1) Дигидролипоилацетилтрансфераза (Е2) Дигидролипоилдегидрогеназа (Е3). К  оферменты: Тиаминдифосфат (ТДФ) - производное витамина В1 Никотинамидадениндинуклеотид (НАД+) – производное витамина РР (никотиновой кислоты) Флавинадениндинуклеотид (ФАД) - производное витамина В2 Кофермент А (КоА-SH) Л  ипоевая кислота ковалентно связана с боковой цепью лизина фермента Е2 (липоамид) |