ЛР3 теплоемкость идеального газа. теплоемкость идеального газа. Бланк выполнения лабораторной работы 3 Теплоемкость идеального газа Цель работы
 Скачать 93.73 Kb. Скачать 93.73 Kb.
|
|
Бланк выполнения лабораторной работы № 3 «Теплоемкость идеального газа» Цель работы: • Знакомство с теплоемкостью идеального газа в изохорическом и изобарическом процессах. • Экспериментальное подтверждение закономерностей изопроцессов. • Экспериментальное определение количества степеней свободы и структуры молекул газа в данной модели. Результаты измерений и расчетов: 1. Одноатомный газ: V0=40*10-3 м3, p0=140*103 Па, ν=2,3*10-3кмоль Таблица 2
*Значения абсолютной температуры может не совпадать с рекомендуемым, но должно быть близким по значению и одинаковым для Qp и QV в столбце. Графики зависимостей QV=f(T) и Qp=f(T) для одноатомного газа (на одном чертеже) по табл.2. 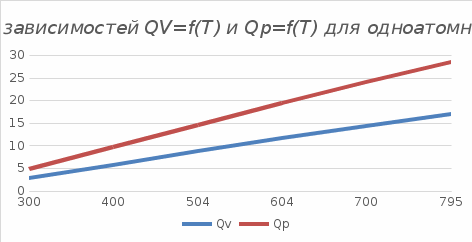 (Все графики могут быть выполнены с использованием спецсредств MSOffice или др. приложений Определение Cp теплоемкости и cp молярной теплоемкости газа при постоянном давлении: 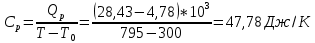 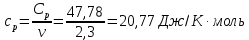 Определение CV теплоемкости и cV молярной теплоемкости газа при постоянном объеме: 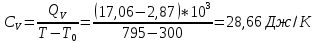 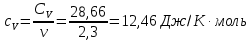 Определение γ постоянной адиабаты: 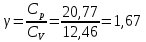 Определение iчисла степеней свободы молекул газов: 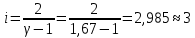 2. Двухатомный газ: V0=40*10-3 м3, p0=140*103 Па, ν=2,3*10-3кмоль Таблица 3
Графики зависимостей QV=f(T) и Qp=f(T) для двухатомного газа (на одном чертеже) по табл.3: 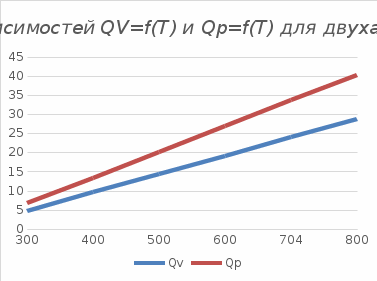 Определение Cp теплоемкости и cp молярной теплоемкости двухатомного газа при постоянном давлении: 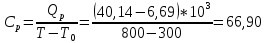 Дж/К Дж/К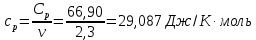 Определение CV теплоемкости и cV молярной теплоемкости двухатомного газа при постоянном объеме: 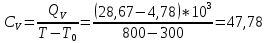 Дж/К Дж/К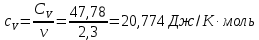 Определение γ постоянной адиабаты: 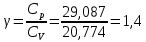 Определение iчисла степеней свободы молекул газов: 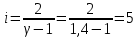 3. Трехатомный газ: V0=40*10-3 м3, p0=140*103 Па, ν=2,3*10-3кмоль Таблица 4
Графики зависимостей QV=f(T) и Qp=f(T) для трехатомного газа (на одном чертеже) по табл.4: 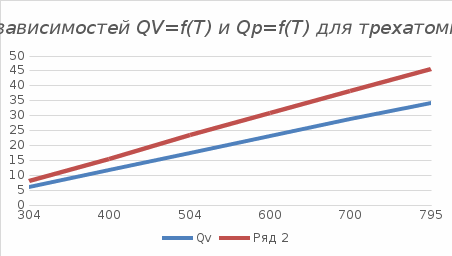 Определение Cp теплоемкости и cp молярной теплоемкости трехатомного газа при постоянном давлении: 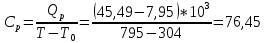 Дж/К Дж/К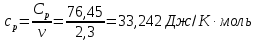 Определение CV теплоемкости и cV молярной теплоемкости трехатомного газа при постоянном объеме: 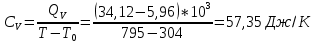 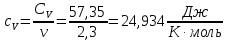 Определение γ постоянной адиабаты: 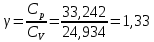 Определение iчисла степеней свободы молекул газов: 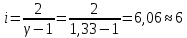 Вывод: Таким образом, мы смогли познакомиться с теплоемкостью идеального газа в изохорическом и изобарическом процессах. Экспериментально подтвердить закономерности изопроцессов. Построить графики различных газов при изохорическом и изобарическом процессах, которые незначительно отличаются друг от друга, возрастают и убывают равномерно. Экспериментально определить, теплоемкости, количества степеней свободы и структуры молекул газа в данной модели. Вопросы: 1. Опишите модель «идеальный газ». "Идеальный газ" - это термодинамическая модель, которая описывает поведение газа при очень низкой плотности и высокой температуре. Идеальный газ не имеет внутреннего взаимодействия между молекулами, и молекулы не оказывают друг на друга никакого влияния. 2. Для какого физического газа можно применить модель «идеальный газ»? Модель «идеальный газ» может быть применена для описания поведения любого физического газа при очень высокой температуре и низкой плотности. Это означает, что модель идеального газа может быть использована для описания газа в очень широком диапазоне условий: от высокотемпературных и низкодавленных плазм до газов в космосе. Однако, если говорить о конкретных газах, то модель идеального газа применима для газов с малым количеством молекул, например для гелия. 3. Какова модель частицы в атомарном газе? В модели частицы в атомарном газе атомы считаются идеальными газовыми частицами, которые не имеют внутреннего взаимодействия между собой и движутся в случайном направлении с константной скоростью. Эти частицы не имеют структуры и не имеют свойств, таких как заряд или спин. Они не имеют никакого внутреннего взаимодействия друг с другом, кроме механического столкновения при небольшой плотности и высокой температуре. 4. Как движется частица в атомарном газе? движутся в случайном направлении с постоянной скоростью. 5. Какова модель частицы в молекулярном газе? Модель частицы в молекулярном газе считает молекулы как структурированные частицы, состоящие из атомов, которые связаны между собой механическими или химическими связями. Эти молекулы имеют свою собственную конфигурацию и способны к ротационному и вибрационному движению. В зависимости от температуры и давления, молекулы могут быть в различных состояниях движения (трансляция, ротация, вибрация), и их состояние определяет свойства молекулярного газа. 6. Как движется частица в молекулярном газе? Эти молекулы имеют свою собственную конфигурацию и способны к ротационному и вибрационному движению. 7. Что такое тепловое движение частицы газа? Тепловое движение - это движение частиц газа, которое связано с их кинетической энергией. Частицы газа имеют случайное движение в различных направлениях и с различной скоростью, которое обеспечивает их тепловую энергию. Чем выше температура газа, тем больше кинетической энергии у частиц и тем более активное случайное движение они имеют. 8. Как сталкиваются частицы атомарного идеального газа? 9. Какие законы сохранения выполняются при столкновении частиц атомарного идеального газа? При столкновении частиц атомарного идеального газа выполняются следующие законы сохранения: Закон сохранения импульса, который гласит, что импульс системы до и после столкновения остается неизменным. Закон сохранения энергии, который гласит, что энергия системы до и после столкновения остается неизменной. Закон сохранения количества движения, который гласит, что количество движения системы до и после столкновения остается неизменным. Эти законы сохранения применяются к идеальному газу, поскольку при столкновении частиц не происходит потери энергии и импульса в результате внутренних соединений или внешних сил действующих на газ. Также в идеальном газе нет взаимодействия между частицами, кроме как при столкновении. 10.Что такое внутренняя энергия идеального газа? Внутренняя энергия идеального газа - это суммарная энергия кинетической и потенциальной энергии всех частиц в газе. В идеальном газе нет взаимодействия между частицами, кроме как при столкновении, поэтому каждая частица имеет только кинетическую энергию. Идеальный газ не имеет внутренней энергии в связи с внутренними состояниями частиц, такими как волновые функции или взаимодействия. 11.Напишите формулу для внутренней энергии атомарного идеального газа. Формула для внутренней энергии атомарного идеального газа: U = 3/2 * N * k * T, где N - число атомов, k - Больцманова константа, T - температура в Кельвинах. 12.Напишите формулу для внутренней энергии молекулярного идеального газа. Формула для внутренней энергии молекулярного идеального газа: U = 3/2 * N * R * T, где N - число молекул, R - универсальная газовая постоянная, T - температура в Кельвинах. 13.Что такое тепловая энергия? Тепловая энергия - это энергия, которая обменивается между телом и окружающей средой в результате разности температур. Это может быть как кинетическая энергия движения молекул или атомов внутри тела, так и потенциальная энергия в связи с их взаимодействием. 14.Сформулируйте и запишите первый закон термодинамики. Первый закон термодинамики гласит: "Энергия системы не может быть создана или уничтожена, а только передаваться или преобразовываться между системой и ее окружением." 15.Что такое работа газа и работа над газом? Работа газа - это процесс преобразования энергии газа в другой вид энергии, например, механическую энергию. Работа над газом - это любой процесс, который влияет на состояние газа, например, изменение его давления или температуры. 16.Какому уравнению подчиняется состояние идеального газа? Напишите его. Состояние идеального газа подчиняется уравнению состояния идеального газа PV = nRT, где P - давление, V - объем, n - количество молекул, R - универсальная газовая постоянная, T - температура в Кельвинах. 17.Дайте определение теплоемкости тела. Теплоемкость - это способность тела поглощать и накапливать тепло. Она измеряется в единицах калорий или Джульей на градус Цельсия (J/°C). Чем больше теплоемкость тела, тем больше тепла необходимо, чтобы изменить его температуру на единицу. 18.Дайте определение удельной теплоемкости. Удельная теплоемкость - это отношение теплоемкости тела к его массе. Она измеряется в Дж/кг·К и определяет, сколько теплоты необходимо добавить или извлечь из 1 килограмма вещества для изменения его температуры на 1 Кельвин. 19.Дайте определение молярной теплоемкости. Молярная теплоемкость - это количество теплоты, необходимого для изменения температуры одного моля вещества на 1 Кельвин. Она обычно измеряется в Дж/кол или Дж/моль. 20.Напишите формулу для теплоемкости при постоянном объеме. Cv = (∂U/∂T)V 21.Напишите формулу для теплоемкости идеального газа при постоянном давлении. Cp = Cv + R, где Cp - теплоемкость идеального газа при постоянном давлении, Cv - теплоемкость идеального газа при постоянном объеме, R - универсальная газовая постоянная (около 8.314 J / (mol * K) для молекулярных газов и 1.986 cal / (mol * K) для атомных газов). 22.Что такое число степеней свободы? Число степеней свободы - это количество неограниченных координат, которые необходимо задать для определения состояния системы. В физике число степеней свободы используется для описания механической системы, такой как молекулы в газе или частицы в твердом теле. 23.Напишите общую формулу для числа степеней свободы. 24.Чему равно число степеней свободы для одноатомной молекулы? Число степеней свободы для одноатомной молекулы равно 3, так как она может свободно двигаться в трех направлениях (вдоль x, y и z). Это включает движение вдоль каждой из осей и вращение вокруг каждой из осей 25.Вычислите число степеней свободы для двухатомной молекулы с жесткой связью. Для двухатомной молекулы с жесткой связью число степеней свободы равно 3. Это потому, что молекула может двигаться в пространстве в двух направлениях (трансляционные степени свободы) и может вращаться вокруг своей оси (вращательная степень свободы). 26.Вычислите число степеней свободы для двухатомной молекулы с упругой связью. Для двухатомной молекулы с упругой связью число степеней свободы равно 3. Это включает в себя 2 степени свободы для каждого из атомов (по одной для движения по каждой оси) и 1 степень свободы для изменения расстояния между атомами. 27.Напишите формулу связи отношения теплоемкостей с числом степеней свободы молекулы идеального газа. Отношение теплоемкости к числу степеней свободы молекулы идеального газа может быть выражено через равенство удельной теплоемкости к соответствующему числу степеней свободы: Cv/N = (3/2)k где Cv - удельная теплоемкость молекулы, N - число степеней свободы молекулы, k - Больцманова константа. 28.Дайте определение изопроцесса. Перечислите известные изопроцессы. Изопроцесс - это термодинамический процесс, в ходе которого теплота передается из тела с высокой температурой в тело с низкой температурой. Известные изопроцессы: Конвекция Радиация Контактная теплотрансференция Теплотрансфер при ионной и электронной кондукции. 29.Напишите уравнение и нарисуйте PV-диаграмму изотермического процесса. Уравнение изотермического процесса заключается в том, что система проходит процесс при стабильной температуре. Математически это можно выразить следующим образом: ΔQ = ΔU где ΔQ - производная теплоты, ΔU - изменение внутренней энергии системы. 30.Напишите уравнение и нарисуйте PV-диаграмму изобарического процесса. Уравнение изобарического процесса заключается в сохранении количества баротермической работы, то есть dU = dQ, где U - внутренняя энергия системы, Q - тепло переданное системе из окружающей среды. 31.Напишите уравнение и нарисуйте PV-диаграмму изохорического процесса. Уравнение изохорического процесса: Q = W. PV-диаграмма изохорического процесса представляет собой горизонтальную линию, так как давление и объем не меняются во время процесса. Это означает, что работа производится только на основе теплового обмена. |
