фывфыввфывфывфывфы. 7.Термодинамика. Что изучает термодинамика
 Скачать 0.53 Mb. Скачать 0.53 Mb.
|
 Н.А.Кормаков Основы термодинамики 10 класс Что изучает термодинамикаMKT объясняет свойства тел и явления, происходящие в веществе, исходя из рассмотрения характера движения и взаимодействия частиц - молекул или атомов. Например, давление идеального газа объясняется бомбардировкой огромного числа молекул стенок сосуда, а зависимость его от температуры описывается исходя из представлений о связи давления со средней кинетической энергией поступательного движения молекул газа. Но в ряде случаев методы MKT оказываются слишком сложными для количественного описания явлений. Оказывается, что многие соотношения между параметрами состояния вещества можно вывести, ничего не зная о внутреннем "механизме" явлений. Раздел физики, в котором изучаются свойства тел без использования представлений о характере движения и взаимодействия частиц, из которых они состоят, называетсятермодинамикой. Исторически начало развития термодинамики связано с изучением КПД тепловых машин. Развитие техники и повсеместное распространение тепловых машин в первой половине XIXв. настоятельно требовали развития теории тепловых процессов. Однако физика того времени не могла дать стройной теории тепловых процессов на основе молекулярных представлений, поэтому развитие теории пошло по своеобразному пути. В 1824г. французский физик и инженер Сади Карно в работе "Размышления о движущей силе огня, сформулировал принцип, согласно которому производительность тепловой машины зависит не от рабочего вещества, а от разности температур нагревателя и холодильника. В дальнейшем термодинамика получила развитие в работах Клапейрона, Джоуля, Клаузиуса, Майера, Томсона и др. Термодинамика относится к феноменологическим теориям физики, которые имеют следующие общие черты: онинерассматриваютатомнуюструктуруматерии; используют величины, которые определяются только длямакроскопическойсистемы; построениетеорииосновываетсяна известныхопытных данных;4.свойства вещества выражаются в форме характеристическихпараметров(плотность,вязкостьит.д.) Термодинамика изучает тепловые свойства макроскопических систем, не обращаясь к микроскопическому строению тел, составляющих систему. Она строится на базе нескольких основных принципов - начал термодинамики, которые представляют собой обобщение известных многочисленных опытных данных. При изучении основ термодинамики необходимо помнить следующие определения. Физическая система, состоящая из большого числа частиц - атомов или молекул, которые совершают тепловое движение и взаимодействуя между собой, обмениваются энергиями, называется термодинамическойсистемой. Примером такой системы может быть любая тепловая машина. Состояние термодинамической системы определяется макроскопическими параметрами, например объемом, давлением, температурой. Термодинамика рассматривает только равновесные состояния, т.е. состояния, в которых параметры термодинамической системы не меняются со временем. Термодинамическим процессом называется переход системы из начального состояния в конечное, через последовательность промежуточных состояний. Процессы бывают обратимыми и необратимы. Обратимымназываетсятакойпроцесс, при котором возможно осуществить обратный переход системы из конечного состояния в начальное через те же промежуточные состояния, чтобы в окружающих телах не произошло никаких изменений. Обратимый процесс является физической абстракцией. Примером процесса, приближающегося к обратимому, является колебание тяжелого маятника на длинном подвесе. В этом случае кинетическая энергия практически полностью превращается в потенциальную и обратно. Колебания происходят долго без заметного уменьшения амплитуды ввиду малости сопротивления среды и сил трения. Любой процесс, сопровождаемый трением или теплопередачей от нагретого тела к холодному, являетсянеобратимым. Примером является расширение газа, даже идеального, в пустоту. Расширяясь, газ не преодолевает сопротивление среды, не совершает работы, но для того, чтобы вновь собрать все молекулы газа в прежний объем, т.е. привести газ в начальное состояние, необходимо затратить работу. Таким образом, все реальные процессы являются необратимыми. Внутренняя энергияОдним из важных параметров термодинамической системы является внутренняя энергия. Внутренняя энергия — это сумма энергий молекулярных взаимодействий и энергии теплового движения и является однозначной функцией состояния. Внутренняя энергия зависит только от состояния системы. Изменение состояния системы характеризуется параметрами состояния p,V,T; одному и тому же состоянию системы соответствует определенное значение внутренней энергии U. При нагревании газа увеличивается скорость движения молекул и атомов, что приводит к увеличению внутренней энергии; следовательно, внутренняя энергия зависит от температуры. При изменении давления или объема меняются межмолекулярные расстояния, т.е. потенциальная энергия взаимодействия атомов или молекул тоже меняется, а, следовательно, изменяется и внутренняя энергия. Началом отсчета внутренней энергии считается такое состояние системы, при котором внутренняя энергия равна нулю. Обычно считают, что внутренняя энергия равна нулю при Т=0. При переходе системы из одного состояния в другое практический интерес представляет изменение внутренней энергии ∆U, поэтому выбор начала отсчета внутренней энергии не имеет значения. Способы изменения внутренней энергии. 1.Совершение работы∆𝑼 = 𝑨тр -обработка деталей напильником, резцом; -работа по преодолению Fтр. 2.Теплопередача∆𝑼 = 𝑸 где Q - количество теплоты, переданное телу. Виды теплопередачи.а.теплопроводность - называется процесс передачи внутренней энергии от одних частей тела к другим. Обусловлен этот процесс хаотическим движением молекул без переноса вещества. б.конвекция- теплообмен, который происходит при перемешивании неравномерно нагретых газов или жидкостей под действием силы тяжести. в.излучениетела, которое определяется только его температурой, называетсятепловымизлучением.Процесс передачи внутренней энергии от более нагретого теле к менее нагретому. Внутренняя энергия идеального газаГаз, состоящий из отдельных атомов, а не молекул, называется одноатомным.К одноатомным газам относятся инертные газы - гелий, неон, аргон. В случае идеальных газов пренебрегают силами взаимодействия молекул, т.е. их потенциальная энергия полагается равной нулю, поэтому внутренняя энергия теплового движения представляет собой кинетическую энергию теплового движения молекул. т.е. изменение внутреннейэнергииидеальногогазапропорциональномассе газаиизменениюеготермодинамическойтемпературе. Внутренняя энергия многоатомного газаМолекула одноатомного газа рассматривается как материальная точка, т.к. масса атома сосредоточена в основном в ядре, размеры которого малы. Положение одноатомной молекулы в пространстве задается тремя координатами. Говорят, что одноатомныйгазимееттристепенисвободы(i=3).Эта молекула находится в хаотическом движении, все направления движения являются равноправными, т.е. средняя кинетическая энергия хаотического теплового движения молекулы равномерно распределена между тремя степенями свободы. На каждую степень свободы поступательного движения одноатомной молекулы приходится одинаковая кинетическая энергия. Внутренняя энергия многоатомного газа представляет собой кинетическую энергию всех движений частиц. Все степени свободы многоатомной молекулы являются равноправными, поэтому они вносят одинаковый вклад в ее среднюю кинетическую энергию. Работа в термодинамикеВ современном производстве широкое распространение получили тепловые двигатели, в которых энергия, выделяемая при сгорании топлива, превращается в механическую. Процесс превращения энергии в тепловых двигателях осуществляется при помощи расширения пара или газа. Чтобы понять принцип действия тепловых двигателей, необходимо рассмотреть условия, при которых газ может выполнять работу, и знать, как ее можно вычислить. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ-законсохраненияипревращенияэнергиидлятепловыхпроцессов. Количество теплоты, сообщенное телу, идет на увеличение его внутренней энергии и на совершение телом работы над внешними силами. Первое начало термодинамики.Основу термодинамики составляют два закона (или начала). Исторически в формулировке первого начала термодинамики важную роль сыграли неудачные попытки человека построить машину, которая производила бы работу, не потребляя эквивалентного количества энергии; такую машину называли вечным двигателем (от лат."перпетуум мобиле")первогорода. Первое начало термодинамики формулируют в виде следующего утверждения: невозможнопостроить«перпетууммобиле»первогорода. Первое начало термодинамики — это закон сохранения и превращения энергии; при разнообразных процессах, протекающих в природе, энергия не возникает из ничего и не уничтожается, но превращается лишь из одних видов в другие. Для того чтобы записать первое начало термодинамики в математической форме, рассмотрим, как происходит изменение внутренней энергии системы. В общем случае внутренняя энергия тела может возрастать как за счет механической работы внешних сил, так и за счет теплообмена. При обмене энергией с окружающими телами внутренняя энергия тела в зависимости от обстоятельств может, как возрастать, так и уменьшаться: знак Qуказывает направление теплообмена. Если при теплообмене окружающие тела нагреваются, т.е. отнимают энергию у рассматриваемого тела, то Q<0. Если при изменении внутренней энергии тела совершается работа Анад окружающими телами, то эта работа считается положительной (+А), если же окружающие тела совершают работу над рассматриваемым телом, то эта работа отрицательна (-А). Так как в общем случае внутренняя энергия тела меняется как при сообщении телу количества теплоты, так и при совершении над ним работы, то учитывая правила знаков, закон сохранения энергии применительно к происходящему процессу можно записать в виде: ∆𝑼 = 𝑸 − 𝑨 Применение первого закона термодинамики а. изобарный процесс.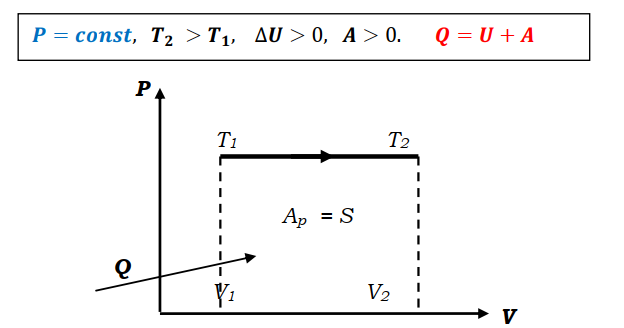 Передаваемоегазуколичествотеплотыидетнаизменениееговнутреннейэнергииинасовершениеимработыприпостоянномдавлении. б. изохорный процесс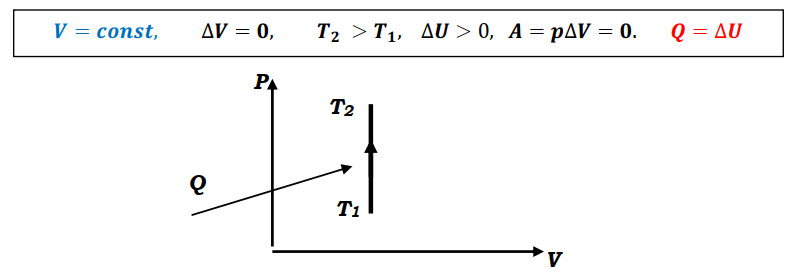 Количествотеплоты,передаваемоесистемеравноизменениювнутреннейэнергии. в. изотермический процесс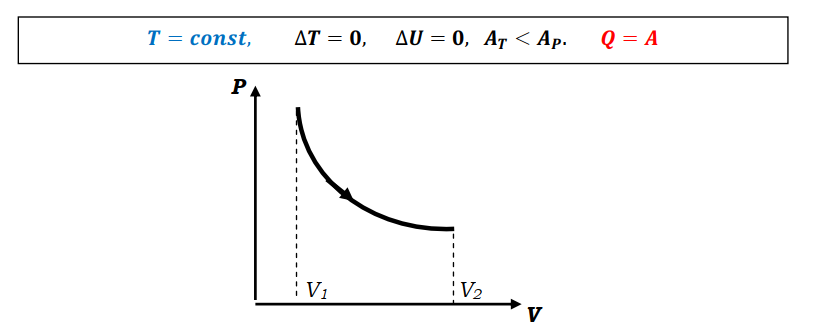 Передаваемоегазуколичествотеплотыидетнасовершениеработы. г. адиабатный процессПроцесс, протекающий в системе, которая не обменивается теплотой сокружающимителами,т.е. процессвтеплоизолированнойсистеме. При адиабатном процессе Q=0и изменение внутренней энергии происходит только за счет совершения работы. ∆𝑼 = 𝑨  Трудно окружить систему оболочкой, абсолютно не допускающей теплопередачу. Но в ряде случаев можно считать реальные процессы очень близкими к адиабатным. Для этого они должны протекать достаточно быстро, так, чтобы за время процесса не произошло заметного теплообмена. Трудно окружить систему оболочкой, абсолютно не допускающей теплопередачу. Но в ряде случаев можно считать реальные процессы очень близкими к адиабатным. Для этого они должны протекать достаточно быстро, так, чтобы за время процесса не произошло заметного теплообмена.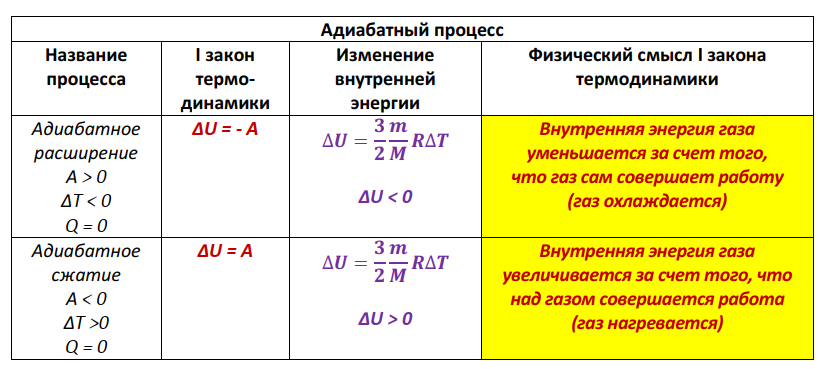  Графическое изображение адиабатного процесса Графическое изображение адиабатного процесса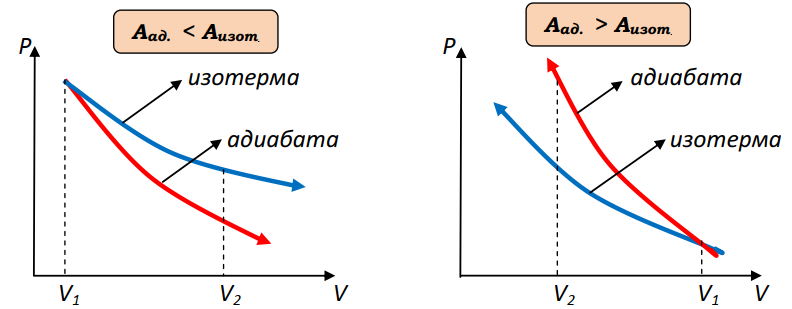 Приадиабатномрасширениитемпературагазапонижается,давлениегазасувеличениемобъемаубываетбыстрее,чемприизотермическомпроцессе. Совершаемаяработаприадиабатномрасширениигазаменьше,чемприизотермическомрасширениигаза. Приадиабатномсжатиитемпературагазаповышается,давлениегазасуменьшениемобъема растетбыстрее,чемприизотермическомпроцессе. Совершаемаяработаприадиабатномсжатиигазабольше,чем при изотермическом сжатиигаза.    Примерыадиабатныхпроцессов. 1.Нагревание газа при быстром сжатии можно получить с помощью цилиндра на дно, которого положили смоченный эфиром кусочек ваты. При быстром опускании поршня, пары эфира воспламеняются 2.Нагревание воздуха при быстром сжатии нашло применение в двигателях Дизеля. В этих двигателях отсутствует система зажигания горючей смеси. В цилиндр засасывается не горючая смесь, а атмосферный воздух. К концу такта сжатия в цилиндр впрыскивается жидкое топливо. К этому моменту температура воздуха так велика, что горючее воспламеняется. Двигатели имеют больший КПД, чем обычные карбюраторные двигатели. Охлаждение газа при адиабатном расширении происходит в грандиозных масштабах в атмосфере Земли. Это расширение сопровождается значительным охлаждением. В результате водяные пары конденсируются и образуют облака. «Пепси – кола» и другие напитки.Процесс,прикоторомпробкавылетаетизбутылкиснапиткамиилиприбыстрооткрываниипробки-являетсяадиабатным.Таккакпослевылетапробки,объем,занимаемыйвоздухомувеличивается,тогазсовершаетположительнуюработу,котораяприводиткуменьшениювнутреннейэнергии,аследовательно,иуменьшениютемпературы.Приэтомнадгорлышкомбутылкивозникаеттуман. Теплоемкость а. теплоемкость тела Теплоемкостью тела называют отношение количества теплоты, необходимое для повышения температуры тела от Т1доТ2к разности температур. б. теплоемкость вещества.Нагревая тела с одинаковыми массами, но состоящие из различных веществ, можно обнаружить, что для повышения их температуры на 1К требуются различные количества теплоты, т.е. теплоемкость тела зависит не только от вещества, но и от процесса, при котором осуществляется теплопередача. Теплоемкость тела пропорциональна его массе. Поэтому характеристикой тепловых свойств вещества является его удельная теплоемкость - величина, равная отношению теплоемкости тела к его массе Теплоемкости газа при постоянном объеме и постоянном давлении Жидкие и твердые тела расширяются при нагревании незначительно и их теплоемкости при постоянном объеме и постоянном давлении мало различаются. Но для газов это различие существенно. С помощью первого закона термодинамики можно найти связь между теплоемкостями газа при постоянном объеме и постоянном давлении. теплоемкость идеального газа при V = const.Теплоемкость одного моля вещества называется молярнойтеплоемкостью. При постоянном объеме работа не совершается. 2.теплоемкость идеального газа при Р = const.Молярная теплоемкость идеального газа при постоянном давлении большетеплоемкостиприпостоянномобъеменавеличинууниверсальнойгазовойпостояннойR. Теплоемкость идеального газа при изотермическом процессеМожно формально ввести понятие теплоемкости и при изотермическом процессе. Так как при этом процессе внутренняя энергия идеального газа не меняется, какое бы количество теплоты ему ни было передано, то теплоемкость бесконечна. Адиабатныйпроцесс. В адиабатическом процессе теплообмена с окружающей средой непроисходит,т.е.Q=0,нодавлениеитемператураменяются,т.е.∆𝑇 ≠ 0. Выводы: МолярнаятеплоемкостьгазаопределяетсятолькочисломстепенейсвободыегомолекулызначениемуниверсальнойгазовойпостояннойR. Молярныетеплоемкостинезависятоттемпературы. |
