урок химии. Электроны. Строение электронных оболочек атомов химических элементов
 Скачать 51.24 Kb. Скачать 51.24 Kb.
|
|
Урок № 9 Тема: Электроны. Строение электронных оболочек атомов химических элементов Тип урока: комбинированный Цель урока: сформировать представления об электронном строении атомов Ход урока Организационный момент Актуализация знаний Расскажите о строении атома Из каких частиц состоит атомное ядро? Как исходя из положения элемента в ПСХЭ определить заряд ядра атома химического элемента, количество протонов, нейтронов и электронов? Изучение нового материала Атом по строению напоминает Солнечную систему – такая модель называется планетарной. В центре атома – ядро, а вокруг него движутся электроны, подобно движению планет вокруг Солнца. Однако частицы, входящие в состав атома – протоны, нейтроны и электроны – это объекты микромира, не наблюдаемого нами. В нем действуют другие законы, чем в макромире. Электроны в атоме химического элемента образуют электронную оболочку. В атоме алюминия 13 электронов – электронную оболочку создают 13 электронов. В атоме водорода – один электрон – электронная оболочка атома водорода образована одним электроном. Как движутся электроны в атоме? Хаотично или в определенном порядке? Электроны движутся в определенном порядке, так как они обладают различным запасом энергии. Если энергия электронов мала, то они ближе расположены к ядру, прочнее связаны с ним, их труднее удалить из электронной оболочки. Чем больше запас энергии электронов, тем дальше от ядра атома они находятся. Близко подойти к ядру им мешает экранирование электронов, расположенных у ядра атома и имеющих малый запас энергии. Т.о., по запасу энергии электроны в атоме располагаются по электронным слоям – энергетическим уровням. Кол-во энергетических уровней в атоме соответствует номеру периода в ПСХЭ Д.И. Менделеева, в котором находится химический элемент. В атомах элементов 1-го периода электронная оболочка состоит из одного энергетического уровня, т.е. в атомах H и He один энергетический уровень. Обозначается он так:   H+1 ) энергетический уровень H+1 ) энергетический уровеньзаряд ядра He+2 ) В атомах элементов 2 периода электронная оболочка атомов химических элементов состоит из двух энергетических уровней. В атомах элементов от лития до неона два энергетических уровня. В атоме азота 7 электронов по запасу энергии распределены по двум энергетическим уровням. Соответственно, в атомах элементов 3-го периода электронная оболочка состоит из трех энергетических уровней, и т.д. Возникает вопрос: какое максимальное кол-во электронов может быть на энергетических уровнях – первом, втором, третьем и т.д.? Определяется это число по формуле N = 2n2, где N – максимальное число электронов на энергетическом уровне, n – номер энергетического уровня (номер периода, в котором расположен химический элемент). Т.о., если n = 1, то N = 2; n = 2, N = 8; n = 3, N = 18; n = 4, N = 32. Следует помнить, что последний энергетический уровень в атоме называется внешним. Количество электронов на внешнем энергетическом уровне атома химического элемента главной подгруппы равно номеру ГРУППЫ. Чтобы составить схему строения электронной оболочки атомов, будем руководствоваться алгоритмом: Определим положение элемента в ПСХЭ (его координаты) Например, углерод – С: период – 2, малый; группа IV (главная А подгруппа), Ar = 12. Охарактеризуем строение атома. Порядковый номер 6, заряд ядра +6, ē = 6, p = 6, n = 12 – 6 = 6. Энергетических уровней – два. С+6 ) ) Охарактеризуем строение энергетических уровней в электронной оболочке атома химического элемента. В атоме углерода 6 электронов по запасу энергии можно распределить по двум энергетическим уровням. На первом – максимально 2 электрона, на втором – размещаем оставшиеся из 6 электронов, т.е. 6 – 2 = 4 электрона на втором уровне. Это внешний энергетический уровень, кол-во электронов на нем соответствует номеру группы. С+6 ) ) 2 4  Распределение электронов по энергетическим уровням в атоме углерода Обратимся к учебнику стр. 55 (последний абзац) – 57. Понятия завершенный и незавершенный энергетический уровень. Электрон движется вокруг ядра с огромной скоростью, создавая облако определенной формы: в виде сферы, в виде объемной восьмерки (гантели) – рис. 39 учебника. Пространство вокруг ядра, где наиболее вероятно нахождение электрона, называется электронной орбиталью. Электронная орбиталь, имеющая форму сферы называется s-орбиталь, форму восьмерки – p-орбиталь. На одной орбитали возможно нахождение только двух электронов. Электронные орбитали на энергетическом уровне образуют подуровни. На первом энергетическом уровне один подуровень – s-подуровень (одна орбиталь, два электрона). На втором энергетическом уровне два подуровня – s-подуровень (одна орбиталь, два электрона) и p-подуровень (три орбитали, шесть электронов. Запас энергии на s-подуровне меньше, чем на p-подуровне. Составим схему энергетических уровней в атоме с учетом подуровней: Первый энергетический уровень 1s; Второй энергетический уровень 2s2p. Для элемента 2-го периода – 1s2s2p. Составим электронную формулу атома углерода, учитывая подуровни на энергетических уровнях атома: Схема строения энергетических уровней атома углерода: С+6 ) ) 2 4 Электронная формула атома углерода: 1s22s22p2 (читается: один-эс-два-два-эс-два-два-эс-два-два-пэ-два). Обратите внимание, кроме символа, порядкового номера, относительной атомной массы и названия элемента в его клетке указана электронная формула внешнего энергетического уровня (для элементов главных подгрупп). Все элементы главных подгрупп имеют одинаковую электронную формулу внешнего энергетического уровня, вследствие чего свойства их очень схожи. Энергетические подуровни
Порядок заполнения электронами энергетических подуровней 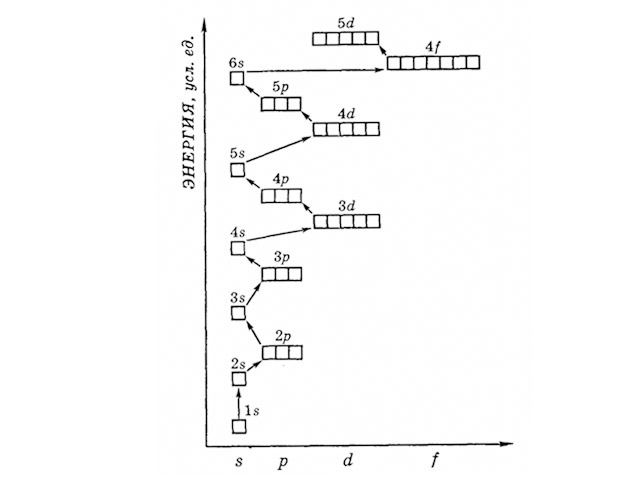 Домашнее задание: § 9, записи в тетради, упр. 1,2,3,4,5 стр. 60 |
