патфиз. Патфиз. Факторы количества воды в организме
 Скачать 0.83 Mb. Скачать 0.83 Mb.
|
|
НАРУШЕНИЕ ВОДНО-СОЛЕВОГО ОБМЕНА ОТЁКИФАКТОРЫ КОЛИЧЕСТВА ВОДЫ В ОРГАНИЗМЕ жировые клетки (cодержат мало воды, поэтому количество воды в организме снижается с увеличением содержания жира. При ожирении содержание воды снижается до 75%) Возраст. Количество воды уменьшается по мере взросления и до старости. У новорожденного общее количество воды составляет до 75% от веса тела. У пожилого человека в организме содержится 45-55% воды. Женский пол. Женщины имеют относительно меньше воды в организме, т.к. содержание жира у них относительно больше. Жидкостные компартменты (пространства). Жидкая среда организма человека состоит из двух частей: внутри- и внеклеточной жидкости. Две трети от общего объёма воды (40-45%) находится в клетках и одна треть – вне клеток. Клетки из неё получают кислород, питательные вещества, микроэлементы и гормоны, регулирующие их активность. В то же время эти клетки выделяют в жидкую среду продукты своего метаболизма. Жидкость внеклеточного пространства в свою очередь делится на жидкость плазмы, которая составляет около 5% массы тела, и интерстициальную жидкость, составляющую примерно 14% массы тела. Каким регулирующим механизмом поддерживается нормальный водный баланс организма? Водный балланс поддерживается альдостероново-антидиуретическим механизмом, который пускается в действие нервно-рефлекторным путём при изменениях в организме внеклеточной жидкости и в ней электролитов (главным образом натрия). Главным эффекторным органов обеих систем являются почки, а афферентное звено представлено волюмо- и осморецепторами. Система регуляции обмена воды в организме в целом включает центральное, афферентное и эфферентное звенья. Центральное звено системы контроля обмена жидкости – «центр жажды» (водорегулирующий). Его нейроны находятся в основном в переднем отделе гипоталамуса. Этот центр связан с областями коры мозга, участвующими в формировании чувства жажды или водного комфорта. Афферентное звено системы проявляется через чувствительные нервные окончания, нервные волокна от различных органов и тканей организма (слизистые оболочки полости рта, желудка и кишечника, сосудистое русло), зрительные и слуховые рецепторы и поступает к нейронам гипоталамуса. Наиболее важную роль при этом играют увеличение осмолярности плазмы крови, гипогидратация клеток и увеличение в плазме крови ангиотензина II(АТ II). Эфферентное звено системы регуляции водного обмена реализуется через почки, потовые железы, кишечник и лёгкие. Важными регуляторами главного механизма изменения объёма воды в организме – экскреторной функции почек – являются антидиуретический гормон (АДГ), ренин-ангиотензин-альдостероновая система (РААС), предсердный натрийуретический фактор (ПНФ), КХ, ПГ. 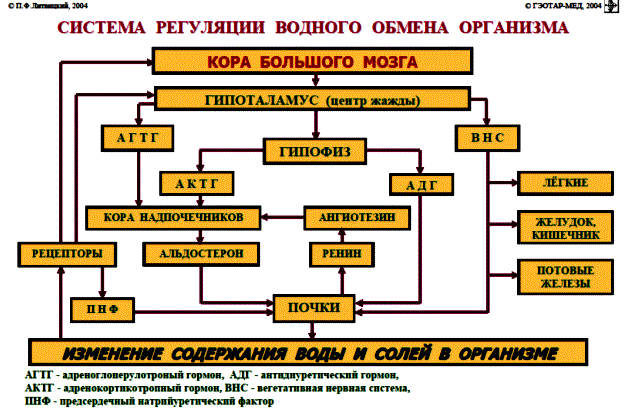 Ренин-ангиотензин Ренин – протеолитический фермент, синтезируемый и выделяемый почками в ответ на снижение почечной перфузии или возрастание стимуляции СНС. Ренин воздействует на ангиотензиноген, продуцируя ангиотензин I(АТ I), который превращается в АТ II, являющийся мощным вазоконстриктором. АТ II в свою очередь стимулирует выброс альдостерона. Альдостерон Что такое альдостерон, и каков его механизм действия? Ренин повышает АД опосредованно за счёт действия альдостерона. Альдостерон – минералокортикоидный гормон, выделяемый корой надпочечников. Он «управляет» реабсорбцией натрия в дистальных отделах канальцев – увеличивая реабсорбцию (сохранение) натрия; увеличивает секрецию и экскрецию калия и ионов водорода. Главным стимулятором секреции альдостерона является АТ II. Механизм его появления в крови можно представить следующим образом: снижение центрального венозного давления или снижение сердечного выброса приводит к раздражению барорецепторов и возбуждению СНС. Это вызывает сужение почечных сосудов, что приводит к усилению секреции ренина в клетках ЮГА в приводящей артериоле клубочка. Ренин превращает ангиотензиноген крови, синтезируемый в печени, в АТ I. Это также неактивное соединение. АТ I активируется под влиянием ангиотензин-превращающего фермента лёгких и превращается в АТ II. 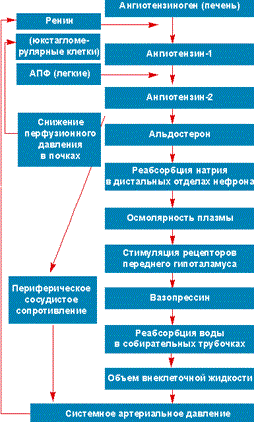 Другими стимуляторами секреции альдостерона являются: 1. увеличение содержания ренина 2. повышение содержания в крови ионов калия 3. снижение содержания в крови натрия 4. увеличение содержания АКТГ 5. стрессовые ситуации Что такое предсердный натрийуретический фактор? ПНФ недавно идентифицированный гормон (1985 г.), выделяющийся предсердиями в ответ на возрастание в них предсердного давления. Секреция этого вещества в кровь происходит при возрастании давления в предсердиях, особенно в левом, которое богаче барорецепторами (правое – осморецепторами). В отличие от РААС, ПНФ снижает АД и сосудистый объём. Считается, что он способен: 1. повышать экскрецию почками натрия и воды за счёт увеличения фильтрации 2. уменьшать синтез ренина и выброс альдостерона, т.е. подавлять активность РААС 3. снижать выброс АДГ 4. вызывать прямую вазодилятацию (расширение сосудов) с понижением давления в БКК и усиливать сердечную деятельность ПНФ выделяется в ответ на любые события, приводящие к увеличению объёма или возрастанию давления наполнения сердца (ЗХСН, ХПН, предсердная тахикардия). Регуляция осмоляльности внеклеточной жидкости Осмоляльность, или [с] внеклеточной жидкости, определяет процесс перемещения жидкости внутрь клетки или из неё. Увеличение осмоляльности внеклеточной жидкости - - - сморщивание клеток Уменьшение осмоляльности внеклеточной жидкости - - - набухание клеток Поэтому для поддержания клеточной функции весьма важно, чтобы осмоляльность внеклеточной жидкости поддерживалась в узком диапазоне. Первыми симптомами изменения осмоляльности плазмы служат неврологические признаки (раздражительность, изменение поведения, судороги, кома), отражающие нарушения функции клеток мозга. Поскольку натрий является основным веществом, растворённым во внеклеточной жидкости, он также принадлежит к основным факторам, определяющим её осмоляльность. Для сохранения соотношения натрий/вода действуют совместно две «контролирующие системы»: АДГ и жажда Что такое вазопрессин? Каков механизм его действия? АДГ – главный гормональный регулятор водовыделительной функции почек. АДГ продуцируется гипоталамусом и секретируется в системный кровоток задней долей гипофиза. Он действует на собирательные трубочки в почках, увеличивая реабсорбцию (сохранение) воды вызывая экскрецию концентрированной мочи. Какие факторы способствуют секреции вазопрессина? Факторы, повышающие, или снижающие выброс АДГ представлены в данной таблице. АДГ является также артериальным вазоконстриктором, т.к. поднимает АД посредством увеличения сосудистого сопротивления. Содержание АДГ регулируется прежде всего изменениями осмоляльности плазмы. Основным пусковым моментом секреции АДГ является гипернатриемия. Под её влиянием возбуждаются осморецепторы (ядра гипоталамуса), импульс от них идёт в ядра гипоталамуса. Секрецию АДГ усиливают болевое раздражение, страх, испуг, мышечная работа, наркотики, АХ. Дополнительными факторами, воздействующими на выброс АДГ, являются эмоции и лекарства. Кровопотеря, изоосмотическое сгущение крови, алкоголь угнетают её. Жажда. Жажда, как и АДГ, регулирует [с] внеклеточной жидкости. Она стимулируется в основном теми же факторами, которые увеличивают выделение АДГ: возрастанием осмоляльности плазмы, кровопотерей и гипотензией. Увеличение уровня АТ II и сухость слизистых оболочек (чувство сухости во рту) также стимулируют жажду. Таким образом, регуляция водно-солевого баланса определяется соотношением действия альдостерона и АДГ. Как классифицируют нарушения водно-электролитного обмена? Нарушения в-э обмена принято делить на обезвоживание (дегидратацию) и задержку воды в организме (гипергидратацию), в том числе клинически важную форму гипергидратации - отёк. 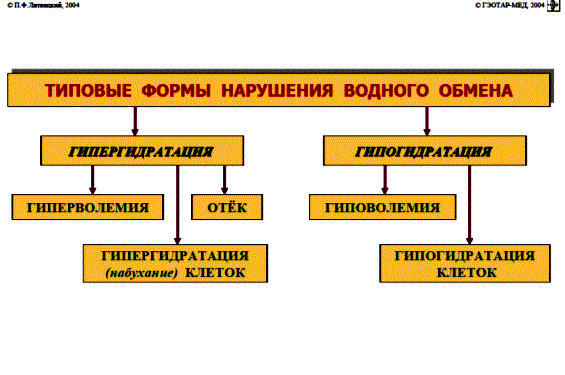 В зависимости от изменения осмотической [с] (соотношения воды и электролитов) де- и гипергидратацию подразделяют на три вида: изоосмолярную (изотоническая), гипоосмолярную (гипотоническую) и гиперосмолярную (гипертоническую). Общая осмотическая [с] всех осмотически активных веществ плазмы в норме составляет 285-295 ммоль/л раствора. Эту величину называют осмолярностью. Обежвоживание (гипогидратация, дегидратация, эксикоз) развивается в тех случаях, когда выделение воды превышаетеё поступление в организм (отрицательный водный баланс). Для всех видов гипергидратации характерен положительный водный баланс: преобладание поступления воды в организм по сравнению с её экскрецией и потерями. Потеря электролитов и воды через почки при некоторых формах нефритов, при болезни Аддисона (недостаточности альдостерона), при полиурии с высокой осмотической плотностью мочи («осмотический» диурез при сахарном диабете). Потери электролитов в этих случаях превышают потерю воды, и развивается гипоосмолярная дегидратация. При обильном потоотделении, длительных физических нагрузках также развивается гипоосмолярная дегидратация. При искусственной вентиляции легких, которую проводят без достаточного увлажнения дыхательной смеси, теряется гипотоническая жидкость. В результате данной формы обезвоживания (когда потери воды превышают потери электролитов) повышается концентрация электролитов внеклеточных жидкостей организма и увеличивается их осмолярность - развивается гиперосмолярная дегидратация. Избыточные потери воды через почки при полиурии, например, при несахарном диабете (недостаточной выработке или высвобождении АДГ) также приводят к гиперосмолярной дегидратации. При острых стремительных потерях соков желудочно-кишечного тракта (при стенозе привратника, острой бактериальной дизентерии, холере, язвенном колите, высокой тонкокишечной непроходимости) изменения осмолярности и состава внеклеточной жидкости практически не происходят. При этом возникает солевой дефицит, осложненный потерей эквивалентного количества жидкости. Развивается острая изоосмолярная дегидратация Гипергидратация гиперосмолярная может развиваться при приеме внутрь морской воды. Гипергидратация гипоосмолярная может развиваться при избыточном синтезе АДГ (гормон-зависимая опухоль гипоталямуса) ПАТОГЕНЕЗ ОТЁКОВ Что такое отёк? Понятие. Приведем общее определение этого патологического процесса (изменения) вне зависимости от его патогенеза. • Отёк – накопление избытка жидкости в межклеточном пространстве и/или полостях тела в результате нарушения водного и водно-электролитного баланса организма. • Отёк (oedema) – избыточное накопление жидкости в межклеточном пространстве, в результате нарушения обмена воды между кровью и тканями. • Внеклеточным отёком называют избыточное скопление жидкости вне сосудистого русла (в интерстициальном пространстве или серозной полости). Термин «внутриклеточный отёк» применяется только в отношении головного мозга. Патогенез местного внеклеточного отёка при локальных нарушениях периферического кровообращения и микроциркуляции Механизм развития внеклеточного отёка объясняется с позиций закона Старлинга. Отёчная жидкость отличается, прежде всего, по содержанию белка, а также по наличию лейкоцитов и остатков погибших клеток. Транссудат – это отёчная (избыточно скопившаяся в ткани или серозной полости) жидкость с низким содержанием белка (в основном альбуминов) и плотностью ниже 1,012. Он встречается при отёке, вызванном венозным застоем. Его следует отличать от экссудата, тоже имеющее плазменное происхождение, но появляющееся при воспалении. Транссудат представляет собой ультрафильтрат плазмы, образующийся в результате нарушения гидростатического баланса между сосудами и тканью при сохранении нормальной проницаемости сосудов. Значительное повышение проницаемости капилляров и венул при нарушениях микроциркуляции в месте воспаления приводит к образованию экссудата. Экссудат – это отёчная (избыточно скопившаяся в ткани или серозной полости) жидкость с высокой [с] белков и остатками клеток, плотностью выше 1,012. В состав экссудата часто входят лейкоциты, мигрировавшие в очаг воспаления, а также бактерии и другие инфекционные возбудители. Транссудат обычно прозрачен из-за отсутствия в нём клеток и наличия менее 2% белка, он не имеет цвета, а омываемые им ткани сохраняют блеск. Экссудат, напротив, мутный (из-за наличия в нём клеток и белка), часто имеет цветовой оттенок, а омываемые им ткани обычно тусклые. Виды отёка Отёк дифференцируют в зависимости от локализации, распространённости, скорости развития и патогенеза. По локализации различают анасарку (диффузный отёк подкожной клетчатки и мягких тканей) и водянку (скопление транссудата в полостях тела: брюшной, грудной, околосердечной сумки). В зависимости от распространённости различают общий (скопление жидкости во многих полостях, органах и тканях) и местный (характерен для локальных воспалительных процессов) отёк. По скорости развития отёк м.б. молниеносный (развивается в течение нескольких секунд после воздействия, например, ожог 2-ой ст., укус насекомых или змей), острый (в течение нескольких десятков минут, часов, например, отёк лёгких при ОИМ) и хронический (развивается в течение нескольких суток, недель, например, нефротический отёк, или отёк при голодании). В зависимости от основного патогенетического фактора различают: • Гидродинамический, который возникает вследствие увеличения эффективного гидростатического давления в сосудах • Лимфогенный (в результате затруднения оттока лимфы от тканей при механическом препятствии, либо избыточном образовании лимфы) • Механический, представляющий собой комбинацию двух названных выше видов • Онкотический, для которого характерно снижение онкотического давления крови и/или увеличение его в межклеточной жидкости • Осмотический (возникает при повышении осмоляльности интерстициальной жидкости, либо при снижении осмоляльности плазмы крови, либо в сочетании того и другого) • Мембраногенный, который развивается при существенном повышении проницаемости стенок сосудов микроциркуляторного русла для воды В клинической практике, как правило, не встречается отёк какого-то одного патогенетического вида. Иначе говоря, практически нет монопатогенетического отёка. Гидродинамический отек • Гидродинамический – возникает вследствие увеличения эффективного гидростатического давления в сосудах (местное и общее) Возрастание гидростатического давления м.б. местным или общим. Причины: o Местное повышение связано с ослаблением венозного оттока и венозным застоем (венозной гиперемией) в органе – при резком снижении работы сердца при ОЛСН, отёке лёгких o Общее возрастание гидростатического давления м.б. обусловлено венозным застоем в венозной системе БКК и приводит к накоплению отёчной жидкости в серозных полостях. o Местное венозное давление повышается при обтурации венозных сосудов (например, тромбом или эмболом) и при сдавления вен и/или венул (например, опухолью, рубцом, отёчной тканью). o Увеличение ОЦК (например, при гиперволемии, полицитемии, водном отравлении). Механизм гидродинамического отёка 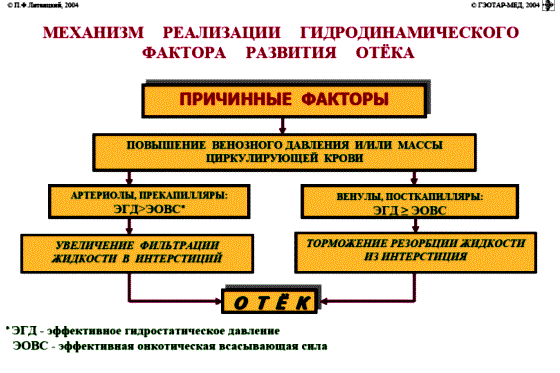 Механизм развития гидродинамического отёка связан с ростом гидростатического (венозного) давления в капилляре, и увеличивается выход жидкости из капилляров в интерстициальное пространство. Повышение давления м.б. связано с как с увеличением сопротивления к венозному оттоку при НК, сдавлении, закупорке, сужении вен, так и расширением артериол и прекапиллярных сфинктеров, приводящим к увеличению притока крови и резкому повышению внутрикапиллярного давления. Возрастание гидростатического давления ведет к увеличению площади фильтрации в артериальной части капилляра (поскольку возрастает фильтрационное давление) и нарушению реабсорбции воды в сосудистое русло. Онкотический отек. Для системы сосуд-ткань эффективными осмолями являются мелкие белки - альбумины, которые и поддерживают онкотическое давление. • Снижение капиллярного коллоидно-осмотического давления Причины: 1. Снижающие онкотическое давление крови в результате гипопротеинемии – связано со снижением [с] альбуминов в плазме крови (нарушение белковосинтезирующей функции печени), потере белков ч/з почки., алиментарное голодание) (в основном за счёт гипоальбуминемии; альбумины примерно в 2,5 раза более гидрофильны, чем глобулины) o недостаточное поступление белков в организм при общем или белковом голодании, o нарушение полостного и/или мембранного пищеварения (например, при резекции фрагментов кишечника, дисбактериозе, синдромах мальабсорбции) o снижение синтеза альбуминов в печени (например, при воздействии на неё гепатотропных ядов, выраженном циррозе) o избыточная потеря белка организмом (например, с мочой при нефротическом синдроме, с плазмой крови при обширных ожогах; с калом при расстройстве пищеварения в желудке и кишечнике) 2. Повышающие онкотическое давление интерстициальной жидкости (обусловлено повышением проницаемости сосудов, выходом белков плазмы в интерстиций, повышением онкотического давления интерстиция --- что будет способствовать привлечению жидкости в межклеточную ткань и преобладанию фильтрации над реабсорбцией) o развитие воспаления или местных аллергических реакций (под влиянием медиаторов воспаления и аллергии, например, кининов, гистамина, серотонина) o накопление ионов Н, К, Nа во время ишемии o действие некоторых химических веществ (например, хлора, фосгена, люизита) o попадание в ткань ядов насекомых и пресмыкающихся o воздействие ядов микробов (например, возбудителей дифтерии или сибирской язвы) Механизм онкотического отёка  Генерализованный отёк, который становится клинически заметным лишь при задержке и накоплении в тканях не менее 5 л жидкости, сопровождается, кроме задержки натрия, ещё и гипопротеинемией. Онкотическое давление в плазме крови обеспечивается белками, главным образом альбумином. Когда уровень альбумина падает ниже 25 г/л вследствие избыточной его потери или недостаточного синтеза, онкотическое давление снижается и возникает отёк. Большая потеря альбумина и общий отёк встречаются при нефротическом синдроме, а снижение синтеза этого белка – при циррозе печени, голодании. Во всех случаях перемещение жидкости из плазмы крови в интерстициальную ткань приводит к уменьшению объёма плазмы крови. Снижение онкотического давления плазмы крови в сосудах вследствие гипоальбуминемии. При этом уменьшается способность белков плазмы удерживать жидкость внутри сосудов, усиливается фильтрация из артериальной части капилляра и резко ухудшается реабсорбция жидкости в венозной части капилляра. В результате возрастает объём фильтрации воды из микрососудов в интерстициальную жидкость по градиенту онкотического давления и уменьшается резорбция жидкости из межклеточного пространства в посткапиллярах и венулах. Осмотический отек. Осмотический отёк - либо повышение осмоляльности интерстициальной жидкости, либо снижение осмоляльности плазмы крови Причины: 1. Факторы, снижающие осмотическое давление крови. o Парентеральное введение больших объёмов растворов, содержащих соли в недостаточном количестве. В реальной клинической практике это встречается чрезвычайно редко (являясь следствием врачебной ошибки, например, при проведении мероприятий по устранению гипогидратации организма или отклонений показателей КЩР). o Гиперпродукция АДГ. Может наблюдаться при повышении внутричерепного давления, повреждении структур гипоталамуса, после энцефалитов. Повышение в связи с этим продукции АДГ в гипоталамусе и его уровня в крови стимулирует избыточную реабсорбцию воды в почках. Также повышается продукция АДГ при активации ренин-ангиотензиновой системы. 2. Факторы, повышающие осмоляльность интерстициальной жидкости. o Выход из повреждённых или разрушенных клеток осмотически высокоактивных веществ (например, ионов Na+, K+, Ca2+, глюкозы, МК, азотистых соединений). o Повышение диссоциации в интерстициальной жидкости солей и органических соединений (например, в условиях гипоксии или ацидоза). o Снижение оттока осмотически активных веществ (ионов, органических и неорганических соединений) от тканей в результате расстройств микроциркуляции. o Транспорт Na+ из плазмы крови в интерстициальную жидкость. Это может наблюдаться, например, при гиперальдостеронизме. Осмотический отёк патогенез. Ведущим патогенетическим звеном развития данного вида отёка является увеличение градиента осмотического давления, имеющегося внутри сосуда, и межклеточной жидкостью.В этом случае по осмотическому градиенту вода перемещается из сосуда в межклеточную ткань, вызывая её отёк. Механизм реализации осмотического фактора развития отёка заключается в избыточном транспорте воды из клеток и сосудов микроциркуляторного русла в межклеточную жидкость по градиенту осмотического давления (более высокого в интерстиции). Данный механизм включается как компонент патогенеза при сердечном, почечном (нефритическом), печёночном и других отёках Гиперосмия и гиперонкия усиливают ток жидкости из капилляров в ткани. Лимфогенный отек Лимфогенный отёк (затруднение оттока лимфы в результате повреждения, сдавления или обтурации лимфатических сосудов) - характеризуется затруднением оттока лимфы от тканей вследствие либо механического препятствия, либо избыточного образования лимфы. При этом происходит накопление в интерстициальном пространстве избыточно профильтровавшейся и не подвергшейся обратному всасыванию в сосудистое русло жидкости. Т.о., при нарушениях функций лимфатической системы, избыток жидкости будет накапливаться в интерстициальном пространстве Причины: o Врождённая гипоплазия лимфатических сосудов и узлов. o Сдавление лимфатических сосудов (опухолью, рубцом). o Эмболия лимфатических сосудов (например, клетками опухоли, фрагментами тромба, паразитами, последнее нередко наблюдается при попадании в лимфатические сосуды филярий - филярия Банкофта, возбудитель слоновости (элефантизма) o Опухоль лимфоузла (лимфома или лимфосаркома), а также метастазы опухолей других тканей. o Повышение центрального венозного давления (например, при сердечной недостаточности). o Спазм стенок лимфатических сосудов (например, при активации симпатикоадреналовых влияний при стрессе, неврозе; выбросе избытка катехоламинов при феохромоцитоме). o Значительная гипопротеинемия (менее 35–40 г/л при норме 65–85 г/л). Это является результатом возрастания тока жидкости из сосудов в интерстициальное пространство по градиенту онкотического давления. Вследствие этого значительно повышается образование лимфы в тканях. o Динамическая лимфатическая недостаточность. Является результатом значительного возрастания лимфообразования. При этом лимфатические сосуды не способны транспортировать в общий кровоток существенно увеличенный объём лимфы. Подобная картина может наблюдаться при гипопротеинемии у пациентов с нефротическим синдромом или печёночной недостаточности. o Механическая лимфатическая недостаточность. Она является следствием механического препятствия оттоку лимфы по сосудам в результате их сдавления или обтурации. Формирование отёка по такому механизму на нижних конечностях обозначают как слоновость. При слоновости нога может достигать огромных размеров и веса (до 40–50 кг). Такой же механизм может лежать в основе отёка верхних конечностей, половых органов и других регионов тела, часто обширных. Существенно, что при лимфогенных отёках в тканях накапливается жидкость, богатая белком (до 3–4 г%), а также наблюдается избыточное образование коллагеновых волокон и других элементов соединительной ткани, что деформирует органы и ткани. Мембраногенный отек Мембраногенный отёк – возникает при поражении эндотелия, базальной мембраны и характеризуется резко повышенной сосудистой проницаемостью. Мембраногенный фактор характеризуется существенным повышением проницаемости стенок сосудов микроциркуляторного русла для воды, мелко и крупномолекулярных веществ (наибольшее значение среди последних имеют белки). Инициаторами могут выступать медиаторы воспаления (такие как гистамин), медиаторы аллергии, длительная ишемия, резкая активация перекисных процессов, механическое перерастяжение сосудов (особенно венул) при нарушении оттока крови. Мембраногенный отёк патогенез. 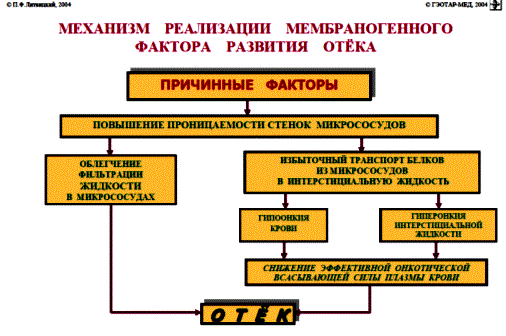 Указанный механизм обуславливает усиление выхода жидкости и мелкодисперсных белков через поврежденную стенку капилляра в интерстициальное пространство, что приводит к повышению гидростатического и онкотического давления интерстициальной жидкости и задержке воды в тканях. Нарушение нервно-гормональной регуляции водно-электролитного обмена Как известно, решающее значение в регуляции водно-электролитного обмена придается двум гормонам: альдостерону и антидиуретическому. Увеличение продукции этих гормонов или уменьшение их инактивации в печени играет существенную роль в развитии отеков. В основе патогенеза сердечной недостаточности лежит дисбаланс нейрогормонов. Основные нейрогормональные системы можно сгруппировать как вазоконстрикторные антидиуретические и пролиферативные гормоны и противостоящие им системы, способствующие усилению диуреза, вазодилатации и блокаде пролиферации клеток и ремоделирования органов-мишеней. Мы знаем, при ХСН велик дисбаланс в сторону преобладания, первых, можно сказать, условно негативных нейрогуморальный субстанций, таких как ренин-ангиотензин-альдостероновая (РААС), симпатоадреналовая (САС) системы, эндотелин, вазопрессин, которые отвечают за задержку жидкости в организме. Защитная же роль условно положительных нейрогормонов (брадикинина, оксида азота, простациклина, натрийуретических факторов) при ХСН резко снижена. Поэтому, когда мы говорим о двух системах, которые усиливают задержку жидкости в организме, мы в первую очередь имеем в виду РААС и САС. 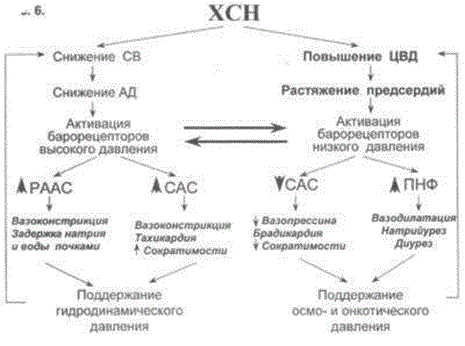 На рисунке представлены основные воздействия САС на почки в организме больного с ХСН, приводящие к задержке жидкости в организме. Как видно, здесь и прямая констрикция почечных артериол, и повышение синтеза ренина, и ухудшение почечного кровотока и реабсорбция натрия с задержкой жидкости в организме. На рисунке представлены основные воздействия САС на почки в организме больного с ХСН, приводящие к задержке жидкости в организме. Как видно, здесь и прямая констрикция почечных артериол, и повышение синтеза ренина, и ухудшение почечного кровотока и реабсорбция натрия с задержкой жидкости в организме.Ну и конечно, как видно из рисунка, очень важную роль играет РААС и прежде всего ангиотензин II (АII). АII – это важнейший гормон, который влияет на ауторегуляцию почки и можно выделить по крайней мере пять разных механизмов этого воздействия: - Констрикция отводящих артериол (vas efference). Сначала при снижении сердечного выброса это сопровождается компенсаторным повышением фильтрационной фракции, но затем длительная клубочковая гипертензия приводит к гибели клубочка. За счет большей фильтрации происходит относительное увеличение концентрации протеинов в капиллярах ниже клубочка, т.е. повышается периканальцевое онкотическое давление, что сопровождается реабсорбцией натрия и воды. - Сужение артериол канальцев сопровождается активацией Na/H-обмена и следующей за этим повышенной реабсорбцией натрия и воды. - Констрикция vasa recta, что приводит к ухудшению кровотока в мозговом слое почки и перераспределению кровотока на нефроны, обладающие повышенной натрийзадерживающей способностью. - Повышение синтеза альдостерона, которое усиливает ионообмен натрия на калий в области дистальных почечных канальцев. - И, наконец, констрикция мезангиальных клеток, что приводит к уменьшению "фильтрационных пор", в дальнейшем изменениям клубочковых мембран, протеинурии и гибели клубочков. Как видно, существует много разных механизмов, по которым эти две системы – РААС и САС – активируют задержку натрия и воды в организме, обусловливая развитие отечного синдрома. сердечная недостаточность – это процесс активации двух типов барорецепторов высокого и низкого давления. Барорецепторы высокого давления, расположенные в дуге аорты, реагируют на сниженный при ХСН сердечный выброс и ответственны за регуляцию вазоконстрикторных и антидиуретических систем (РААС и САС), которые поддерживают высокое гидродинамическое давление в периферических сосудах вплоть до мелких артериол и прекапилляров. С другой стороны, из-за развития застойных явлений при растяжении предсердий происходит активация барорецепторов низкого давления. Эта реакция является защитным механизмом – она повышает выработку НУФ и снижает активность САС, поддерживая осмо- и онкотическое давление. 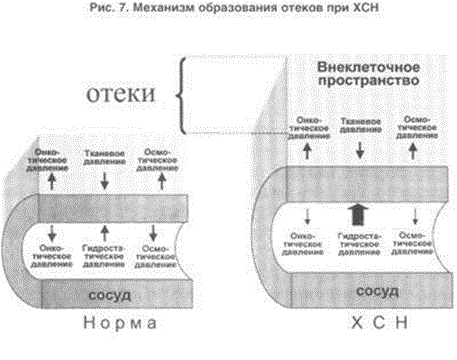 При сердечной недостаточности этот баланс нарушается: слева – норма, а справа – сосуд при сердечной недостаточности. В норме существует баланс между гидростатическим давлением, "выдавливающим" жидкость из сосуда в перисосудистое межклеточное пространство, и онкотическим и осмотическим давлением, "удерживающим" жидкость в русле. При ХСН этот баланс нарушается. Гидростатическое давление резко возрастает из-за активности РААС и САС, а противостоящие им онко- и осмотическое давление резко падают. Поэтому жидкость уходит на периферию и задерживается в межклеточном пространстве, и образуются отеки. Теоретически говоря, для того чтобы устранить отеки, мы должны баланс этих сил нормализовать. Этого можно добиться тремя путями: нормализовать баланс нейрогормонов, снизить гидростатическое давление, повысить онкотическое давление. Ситуация обостряется до предела, когда больной приходит с отеком легких или тяжелейшей одышкой, тогда стоит вопрос не только о том, каким образом, но и как немедленно убрать из организма избыточную жидкость. В этих случаях применяют диуретические или мочегонные препараты, которые призваны за счет уменьшения реабсорбции увеличить выделение натрия и воды из организма. Это снижает гидростатическое давление в капиллярах и постепенно прекращает пропотевание жидкости из капилляров в ткани, т.е. образование отеков. Клинико-этиопатогенетическая классификация отеков. В клинике выделяют несколько типов отеков, в зависимости от этиологии и патогенеза. Это - сердечные, почечные, печеночные, эндокринные, воспалительные отеки. Сердечный отек. Пусковым фактором является сердечная недостаточность, т.е. недостаточность насосной функции сердца. Следствием этого является рост давления в венозной части циркуляции и падение давления в артериальной. Это, в свою очередь, приводит к развитию венозной гиперемии и гидростатических отеков. Одновременно, редукция кровотока в корковом веществе почек при снижении артериального давления приводит к активации ренин-ангиотензин-альдостероновой системы, повышению синтеза АДГ, задержке воды и отекам. 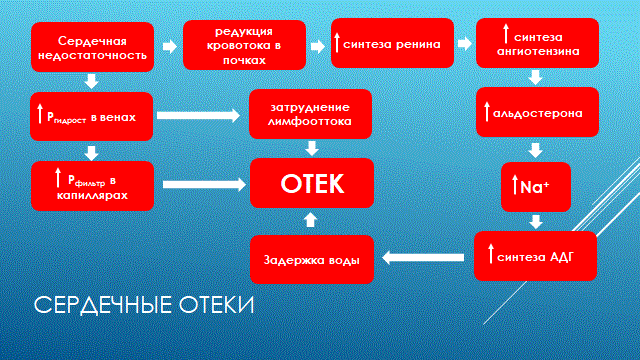 Почечные отеки. Механизмы почечных отеков зависят от того какая именно патология почек их вызывает. Если проявление повреждения почек локализовано преимущественно в клубочках (гломерулонефриты), то возникающее затруднение для кровотока в петельках клубочков из-за сдавления их эксудатом или пролиферирующими клетками приводит к редукции кровотока, активации юкстагломерулярных клеток и активации системы ренин-ангиотензин-альдостерон-АДГ. Это приводит к задержке воды и отекам, которые принято называть нефритическими. Кроме того, при хронических гломерулонефритах, когда развивается нефросклероз и уменьшается количество функционирующих нефронов, снижается выведение почками воды и это также приводит к отекам. 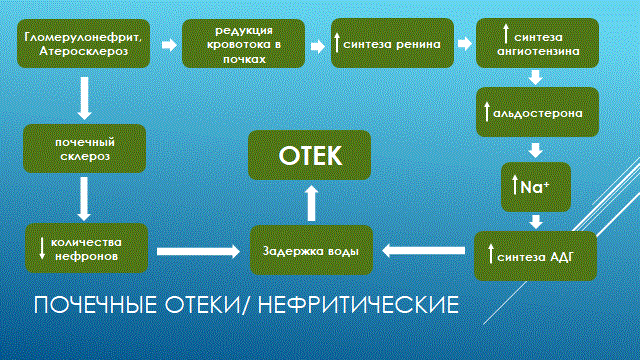 При патологиях, затрагивающих преимущественно канальцевые клетки (нефрозы) нарушается реабсорбция альбуминов, что приводит к снижению их содержания в крови (гипоальбуминемия), к гипоонкии и развитию гипоонкотических отеков. Такие отеки называют нефротическими. 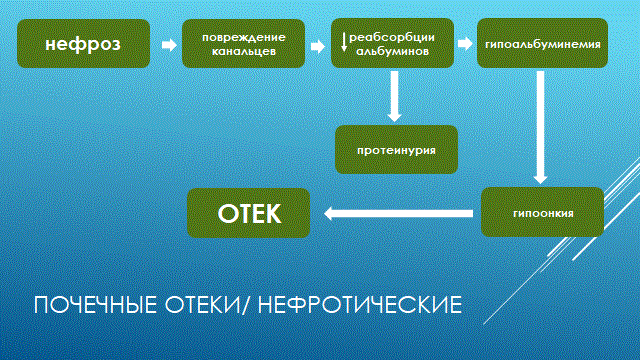 Печеночные отеки. При патологии печени может развиваться печеночная недостаточность – синдром, когда нарушается целый ряд функций, в том числе – дезинтоксикационная и белок-синтезирующая. Нарушение синтеза в печени альбуминов приводит к гипоальбуминемии, гипоонкии и развитию системных гипоонкотических отеков. С другой стороны, нарушение инактивации в печени альдостерона приводит к увеличению его активности (вторичный альдостеронизм), задержке натрия, увеличению синтеза АДГ, задержке воды и развитию системных отеков. Если патология печени сопровождается увеличением гидростатического давления в портальном тракте, как это бывает при циррозах печени, это способствует развитию отека брюшной полости или асцита. 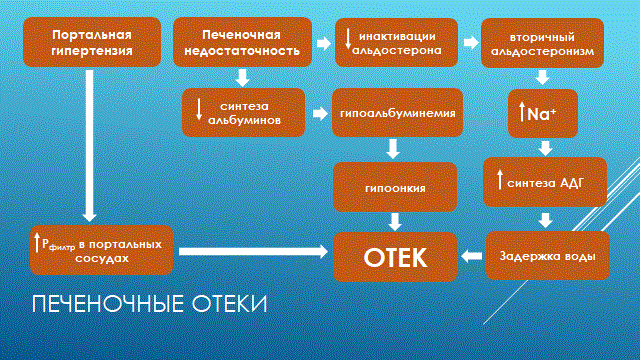 Эндокринные отеки. Примером эндокринного отека может служить отек, развивающийся вследствие избыточной секреции альдостерона надпочечниками (первичный альдостеронизм) как это бывает при образовании в клубочковой зоне коры надпочечников доброкачественной гормон-активной опухоли – альдостеромы. Избыток альдостерона приводит к задержке натрия, усилению синтеза АДГ, задержке воды и отекам. 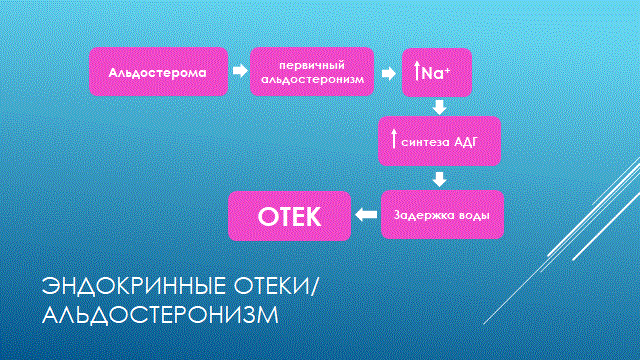 Другим примером эндокринного отека может служить отек, развивающийся вследствие избыточной секреции АДГ в гипоталямусе при его повреждении или при образовании в нем гормон-активной опухоли. Избыток АДГ приводит к задержке воды в почках и отекам.  Воспалительные и аллергические отеки. Аллергические и воспалительные отеки имеют схожие механизмы реализации в силу того, что в основе аллергии также лежит воспалительный процесс. При воспалении любого генеза на сосудистую стенку действуют медиаторы воспаления (и аллергии) такие как, гистамин, кинины, лейкотриены и др., под действием которых с одной стороны развивается воспалительная гиперемия, что увеличивает давление в капиллярах и фильтрацию жидкости из капилляра в ткань. С другой стороны эти медиаторы увеличивают проницаемость стенки капилляров и посткапилляров, что также способствует возрастанию фильтрации жидкости. Повышенная фильтрация, в свою очередь, способствует развитию отеков ткани. 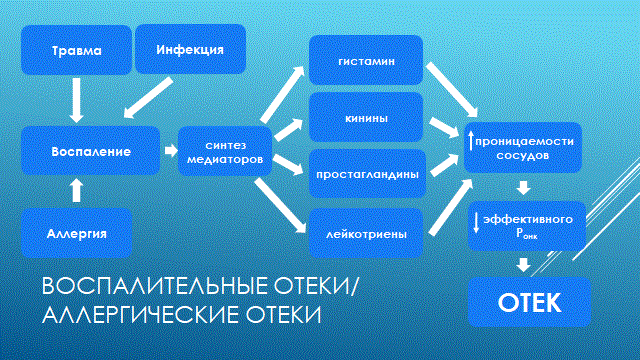 НАРУШЕНИЯ ЛИПИДНОГО ОБМЕНА ОЖИРЕНИЕОжирение – хроническое заболевание, характеризующееся избыточным увеличением массы тела на 20-30% выше нормы и связанное с избыточным накоплением жира в жировой ткани. Ожирение является фактором риска: Гипертонической болезни Атеросклероза Сердечно-сосудистой патологии (инфаркта миокарда) Диабета Ожирение может развиваться вследствие избыточного поступления энергетических субстратов по сравнению с их поступлением (переедание или гиподинамия) или вследствие нарушения регуляции пищевого поведения. В настоящее время известно, что есть гормоны и нейропептиды, стимулирующие аппетит и угнетающие аппетит. Например, в 90-е годы 20 века было установлено, что жировая ткань вырабатывает гормон лептин. В гипоталамусе есть рецепторы к лептину. Этот гормон угнетает выработку нейропептида Y, стимулирующего аппетит.    Другие медиаторы центральной нервной системы (серотонин, дофамин и т.п.) также могут влиять на пищевое поведение. Для определения соответствия массы тела «условной» норме используются разные индексы, например, окружность талии, толщина жировой складки в области лопатки и др., индекс массы тела. Индекс массы тела (ИМТ) рассчитывается по формуле: ИМТ = масса тела в кг/рост в м2 Классификация ожирения Существуют разные классификации ожирения.  Первичное ожирение возникает при нарушении гормональной связи между жировой тканью и гипоталамусом. Это генетически опосредованное нейроэндокринное заболевание, его главная черта - абсолютная или относительная лептиновая недостаточность. Вторичное ожирение - синдром, возникающий при нарушении соотношения между процессами липолиза и липогенеза, носит симптоматический характер и порождается различными расстройствами (эндокринопатии - Синдром Иценко-кушинга, сахарный диабет 2 типа; нарушениях ЦНС - опухоли мозга, нарушения мозгового кровообращения и пр.) Можно классифицировать ожирение по тому, в какой области туловища откладывается жир: Ожирение по женскому типу - гиноидный (жир откладывается в нижней части туловища) Ожирение по мужскому типу - андроидный (жир откладывается в верхней части туловища) 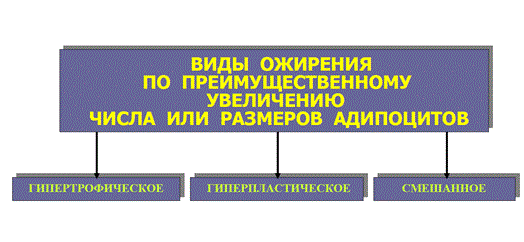 В 1997 г. Всемирной организацией здравоохранения была предложена классификация степеней ожирения, основанная на определении показателя – индекса массы тела (ИМТ) для лиц от 18 до 65 лет. ИМТ рассчитывается по формуле: вес в кг / рост в метрах в квадрате. По ИМТ выделяют следующие варианты массы тела и риска развития сопутствующих осложнений: ИМТ <18,5 (низкий) – указывает на дефицит массы тела и повышенный риск развития других патологий; ИМТ от 18,5 до 24,9 (обычный) – соответствует массе тела в норме. При таком ИМТ отмечаются наименьшие показатели заболеваемости и смертности; ИМТ от 25,0 до 29,9 (повышенный) – свидетельствует об избыточной массе тела или предожирении. ИМТ от 30,0 до 34,9 (высокий) – соответствует I степени ожирения; ИМТ от 35,0 до 39,9 (очень высокий) – соответствует II степени ожирения; ИМТ от 40 и более (чрезмерно высокий) – свидетельствует об ожирении III и IV степени. 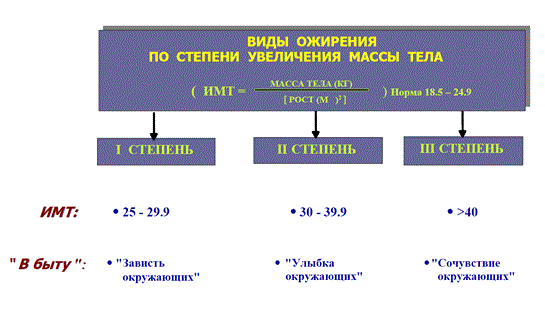 Симптомы ожирения Специфическим симптомом ожирения служит избыточная масса тела. Избыточные жировые отложения обнаруживаются на плечах, животе, спине, на боках туловища, затылке, бедрах, в тазовой области, при этом отмечается недоразвитие мышечной системы. Изменяется внешний облик пациента: появляется второй подбородок, развивается псевдогинекомастия, на животе жировые складки свисают в виде передника, бедра принимают форму галифе. Типичны пупочная и паховая грыжи. Пациенты с I и II степенью ожирения могут не предъявлять особых жалоб, при более выраженном ожирении отмечаются сонливость, слабость, потливость, раздражительность, нервозность, одышка, тошнота, запоры, периферические отеки, боли в позвоночнике и суставах. У пациентов с ожирением III—IV степени развиваются нарушения деятельности сердечно-сосудистой, дыхательной, пищеварительной систем. Объективно выявляются гипертония, тахикардия, глухие сердечные тона. Высокое стояние купола диафрагмы приводит к развитию дыхательной недостаточности и хронического легочного сердца. Возникает жировая инфильтрация паренхимы печени, хронический холецистит и панкреатит. Появляются боли в позвоночнике, симптомы артроза голеностопных и коленных суставов. Нередко ожирение сопровождается нарушениями менструального цикла, вплоть до развития аменореи. Повышение потоотделения обусловливает развитие кожных заболеваний (экземы, пиодермий, фурункулеза), появление акне, стрий на животе, бедрах, плечах, гиперпигментации локтей, шеи, мест повышенного трения. Ожирение различных видов имеет сходную общую симптоматику, различия наблюдаются в характере распределения жира и наличии либо отсутствии признаков поражения эндокринной или нервной систем. При алиментарном ожирении масса тела нарастает постепенно, жировые отложения равномерные, иногда преобладают в области бедер и живота. Симптомы поражения эндокринных желез отсутствуют. При гипоталамическом ожирении тучность развивается быстро, с преимущественным отложением жира на животе, бедрах, ягодицах. Отмечается повышение аппетита, особенно к вечеру, жажда, ночной голод, головокружение, тремор. Характерны трофические нарушения кожи: розовые или белые стрии (полосы растяжения), сухость кожи. У женщин могут развиваться гирсутизм, бесплодие, нарушения менструального цикла, у мужчин – ухудшение потенции. Возникает неврологическая дисфункция: головные боли, расстройство сна; вегетативные нарушения: потливость, артериальная гипертония. Эндокринная форма ожирения характеризуется преобладанием симптомов основных заболеваний, вызванных гормональными нарушениями. Так при длительной гиперсекреции глюкокортикоидов (при болезни Иценко-Кушинга) развивается вторичный инсулинизм и как следствие - ожирение. Распределение жира обычно неравномерное, отмечаются признаки феминизации или маскулинизации, гирсутизм, гинекомастия, кожные стрии. Своеобразной формой ожирения является липоматоз – доброкачественная гиперплазия жировой ткани. Проявляется многочисленными симметричными безболезненными липомами, чаще наблюдается у мужчин. Также встречаются болезненные липомы (липоматоз Деркума), которые располагаются на конечностях и туловище, болезненны при пальпации и сопровождаются общей слабостью и местным зудом. Лечение. Как было выяснено на основании длительных исследований, максимальный эффект при лечении ожирения имеет хирургическая операция (бариатрическая хирургия). Только хирургическое лечение даёт возможность решить эту проблему окончательно. В настоящее время в мире наиболее часто используется три вида операции при ожирении. Эти три операции были отобраны многолетней эволюцией бариатрической хирургии, как дающие максимальный эффект в отношении снижения веса при одновременном минимальном уровне побочных проявлений: Самую длительную историю имеет желудочное шунтирование (gastric bypass). Его начали использовать в 60-х годах двадцатого века. Эта операция заключается в разделении желудка на два отдела — маленький и большой, которые не контактируют между собой. К «маленькому желудку» подшивается тонкая кишка, таким образом, чтобы пища двигалась по короткому пути. Данная операция имеет два компонента действия: (1) объём малого желудка составляет около 50 мл., следовательно, пациент не может потреблять пищу в прежнем объёме, и (2) снижается всасывание питательных веществ при движении пищи по укороченному пути. Бандажирование желудка. Операция заключается в наложении силиконового кольца (желудочный бандаж) на границе пищевода и желудка. Бандаж создает препятствие для прохождения пищи, тем самым стимулируя рефлексогенную зону насыщения. Все современные бандажи являются регулируемыми, то есть их просветом можно управлять в зависимости от индивидуальной ситуации пациента. В современном виде конструкция бандажа предложена американским хирургом украинского происхождения Любомиром Кузмаком. Рукавная гастропластика (Sleeve gastrectomy). Операция заключается в удалении части желудка и превращении его в тонкую длинную трубку — «рукав». Ёмкость желудка при этом уменьшается приблизительно в 10 раз (до 150—200 мл.). К механизмам действия рукавной гастропластики в отношении снижения веса относят создания рестриктивного эффекта для прохождения пищи за счет узкого «рукава», усиленная активация фарнезоидных X-рецепторов (англ.) за счёт увеличения жёлчных кислот и гипотетический механизм удаления грелин-продуцирующей зоны (грелин — гормон голода). Как самостоятельная бариатрическая операция рукавная гастропластика применяется с 2004 года |
