Опг. Ферменты (начало)
 Скачать 0.63 Mb. Скачать 0.63 Mb.
|
|
ФЕРМЕНТЫ (НАЧАЛО) Превращения молекул в клетках организма катализируют ферменты. В условиях, характерных для живого организма, без участия ферментов эти реакции протекали бы очень медленно, поэтому практически все они идут с участием ФЕРМЕНТОВ – биологических катализаторов. Каждый фермент способен катализировать лишь очень небольшое число реакций, часто только одну. Ферменты - это белки, имеющие специфическую первичную, вторичную, третичную, а иногда и четвертичную структуру. Они могут быть простыми или сложными белками. Если фермент - сложный белок, то его небелковую часть называют кофактором, или коферментом, а белковую - апоферментом. Апофермент с коферментом образует активную форму катализатора - холофермент: Апофермент + Кофактор → Холофермент. Активность ферментов, способность ускорять реакции зависит от степени сохранности нативной структуры белка. При нарушении нативной конформации, например, при нагревании, резком изменении рН, воздействии денатурирующих агентов, они теряют каталитические свойства. Большинство ферментов проявляет активность в водных растворах при физиологических значениях рН и температуры. ОСОБЕННОСТИ ФЕРМЕНТАТИВНОГО КАТАЛИЗА Ферменты обладают высокой специфичностью и повышают скорость строго определенных биохимических реакций. Ферменты не влияют на положение равновесия ускоряемых ими реакций, в ходе реакции они не расходуются и не претерпевают необратимых изменений. Каталитическая мощность ферментов (отношение скорости реакции в присутствии катализатора к скорости реакции без катализатора) обычно лежит в диапазоне от 106 до 1014, поэтому ферменты обеспечивают проведение нервных импульсов, сердечное сокращение и другие быстротекущие процессы. Этапы ферментативного катализа Превращение субстрата (S) в продукт (Р) протекает через переходное состояние с более высокой энергией, чем энергия субстрата или продукта: S + Е → ES → Е + Р. Переходное состояние соответствует вершине энергетического (активационного) барьера 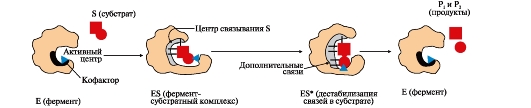 Превращение субстрата (S) в продукты (Р1 и Р2) под действием фермента (Е)  Гипотетические энергетические кривые для химических реакций в присутствие и отсутствие катализатора Ферменты ускоряют реакции путем снижения энергии активации (энергетический или активационный барьер), не влияя при этом на полное изменение свободной энергии в ходе реакции и состояние равновесия. Переходное состояние соответствует вершине энергетического (активационного) барьера. Существуют два основных пути увеличения скорости химической реакции. Первый путь - повышение температуры, приводящий к ускорению теплового движения молекул и увеличению их содержания в точке переходного состояния. Как правило, повышение температуры на 10°С вызывает ускорение химической реакции приблизительно в 2 раза. Второй путь ускорения химической реакции - участие фермента в образовании ES-комплексов, позволяющих молекулам преодолевать активационный барьер на более низком энергетическом уровне. Молекулы S, перед тем как превратиться в продукт реакции, проходят ряд промежуточных этапов, что обеспечивает протекание реакции по другому, обходному пути. • На первом этапе фермент взаимодействует с субстратом с образованием нового соединения E + S → ES. В ходе этого этапа ферментативного катализа происходит установление комплементарного соответствия между Е и S, которое сопровождается небольшими изменениями конформации фермента. Переходному состоянию вещества ES соответствует более низкая энергия активации по сравнению с переходным состоянием вещества S в реакции, идущей без катализатора. Таким образом, ферменты как катализаторы повышают скорость реакций путем снижения активационного барьера. При взаимодействии фермента (Е) с субстратом (S) реакция протекает по новому механизму, характеризующемуся более низким уровнем энергии переходного состояния, чем реакции, протекающие в отсутствие фермента. • Второй этап катализа характеризуется дестабилизацией связей в субстрате (S*): ES → ES*. • В ходе третьего этапа происходит превращение S* в продукт P: ES* → EP → E + P и высвобождение продукта из комплекса с ферментом. Часто, опуская второй этап, уравнение ферментативного катализа записывают так: E + S → ES → E + P. СВОЙСТВА ФЕРМЕНТОВ Взаимодействие субстрата с ферментом происходит в центре связывания (активном центре) и сопровождается образованием множественных связей между ними. Активный центр - это участок на молекуле белка, в котором происходит взаимодействие фермента с субстратом. Он формируется на уровне третичной структуры белка, располагается в углублении, как правило, гидрофобном кармане, или щели, и таким образом предохраняет субстрат от контакта с окружающей фермент водной фазой. В активном центре присутствуют радикалы аминокислот, сближенные в процессе формирования третичной структуры и принадлежащие разным участкам полипептидной цепи белка 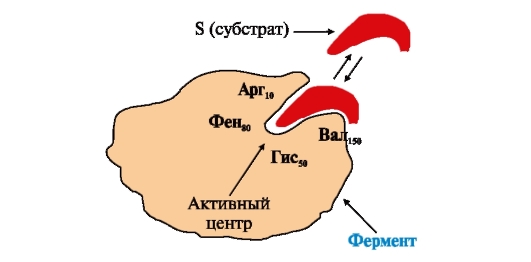 Связывание субстрата в активном центре фермента. Арг, Фен, Гис, Вал - аминокислотные остатки, радикалы которых принимают участие в формировании активного центра фермента. Кофакторы ферментов Небелковые составляющие ферментов могут быть представлены: • Ионами металлов: Zn2+, Mg2+, Fe2+, Cu2+ и т.д. Механизмы участия ионов металлов в ферментативных реакциях различны. Металл может являться частью активного центра фермента и участвовать в катализе. Он может быть связующим звеном между ферментом и субстратом, может проявлять координирующее свойство, благодаря которому субстрат оказывается в активном центре фермента; • Коферментами - сложными органическими веществами, в состав которых часто входят витамины, которые не синтезируются в организме и должны поступать с пищей. Коферменты в свою очередь делят на две группы: • органические соединения с низкой молекулярной массой, обладающие способностью обратимо связываться с апоферментом, например никотинамидадениндинуклеотид(NAD+),никотинамидадениндинуклеотидфосфат (NADP+), кофермент А (HS-KoA), тетрагидрофолиевая кислота (Н4-фолат); • простетические группы - прочно присоединенные к апоферменту, например флавинадениндинуклеотид (FAD), флавинмононуклеотид (FMN), пиридоксальфосфат (ПФ) и др. Коферменты принимают участие в связывании и превращении субстратов, поэтому в их отсутствии фермент теряет свою каталитическую активность. Свойства ферментов как биологических катализаторов Одной из важных характеристик ферментов является их высокая специфичность. Она заключается в том, что каждый фермент катализирует превращение определенного субстрата или группы субстратов, сходных по своей структуре. Специфичность действия ферментов обусловливает направленный обмен веществ в организме. Существует несколько видов специфичности ферментов. • Абсолютная специфичность. Ферменты, обладающие абсолютной специфичностью, катализируют превращение только одного субстрата. Например, фермент уреаза расщепляет единственное соединение - мочевину и не действует на другие соединения, в том числе и на производное самой мочевины - тиомочевину.  Абсолютная специфичность действия уреазы • Групповая специфичность. Ферменты могут воздействовать на ряд соединений сходных по строению. Например, липаза панкреатического сока, гидролизующая триацилглицеролы (ТАГ) с разным составом жирных кислот до 2-моноацил- глицеролов (2-МАГ) и жирных кислот, расщепляет сложноэфирные связи в различных пищевых жирах.  Гидролиз ТАГ под действием панкреатической липазы • Стереоспецифичность. Фермент катализирует превращение только одной стереоизоформы субстрата. Например, фумараза может катализировать превращение фумаровой кислоты, представляющей собой транс-изомер, и не действует на ее цис-изомер - малеиновую кислоту.  Стереоспецифичность фумаразы • Специфичность путей превращения заключается в том, что один субстрат под действием разных ферментов может превращаться в продукты, различающиеся по структуре и роли в метаболизме. 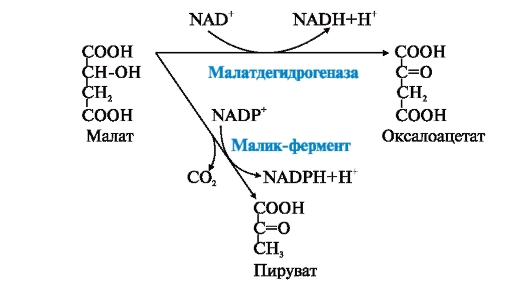 Превращения малата под действием малатдегидрогеназы и малик-фермента КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ При оптимальных условиях активность фермента зависит от: • количества субстрата (S); • количества продукта (Р); • количества фермента (Е); • концентрации кофактора; • присутствия активаторов или ингибиторов. Зависимость скорости ферментативной реакции от концентрации субстрата. Константа Михаэлиса Скорость ферментативной реакции может быть измерена по убыли субстрата S или по увеличению количества образованного продукта Р за единицу времени. При постоянной концентрации фермента скорость ферментативной реакции во многом определяется количеством субстрата. По мере увеличения концентрации субстрата нарастает скорость образования продукта, которая постепенно достигает максимальной величины (Vmax), при которой весь фермент насыщен субстратом и, следовательно, находится в виде фермент-субстратного комплекса (ES). Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, поэтому скорость реакции не возрастает. График зависимости скорости ферментативной реакции от концентрации субстрата имеет вид гиперболы. 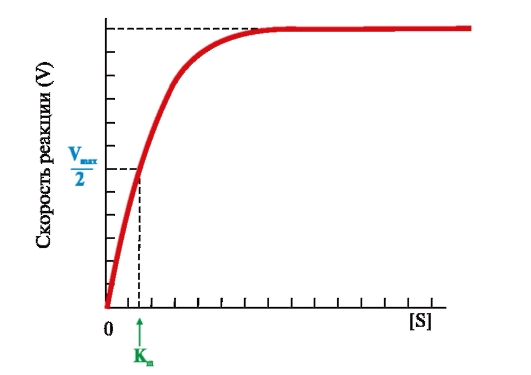 Зависимость скорости ферментативной реакции от концентрации субстрата При увеличении концентрации субстрата скорость ферментативной реакции возрастает до тех пор, пока не достигнет максимального значения (V). Это соответствует концентрации субстрата, при которой все молекулы фермента находятся в комплексе ES, ES* или ЕР. Концентрация субстрата, при которой скорость реакции составляет половину максимальной, численно равна Кm (константе Михаэлиса-Ментен). Когда половина молекул фермента находится в комплексе с молекулами субстрата, скорость реакции равна 1/2 Vmax. Концентрация субстрата, при которой скорость реакции составляет половину максимальной (Vmax), называется константой Михаэлиса-Ментен (Кm). Величина Кm характеризует сродство фермента к субстрату: чем ниже значение Кm фермента, тем выше его сродство к субстрату, и наоборот. Единицы измерения активности фермента В системе СИ активность фермента выражают в каталах: 1 катал – количество фермента, катализирующее превращение 1 моля субстрата за 1 секунду при оптимальных условиях (1кат = 1 моль/с) Оценить активность фермента можно по убыли (расходованию) субстрата или появлению (образованию) продукта при определенных значениях рН, температуры и концентрации субстрата, приближающейся к насыщающей. Обычно за единицу активности фермента принимают такое количество фермента, которое катализирует превращение 1 мкмоль субстрата (1 мкмоль = 10-6 моль) за 1 мин в оптимальных условиях проведения данной ферментативной реакции. Активность фермента = мкмоль (S или Р)/мин. Удельной активностью фермента называют число единиц ферментативной активности в расчете на 1 мг белка (фермента). Удельная активность является количественной характеристикой чистоты ферментного препарата. В процессе очистки фермента удельная активность увеличивается, становится максимальной и постоянной для очень хорошо очищенного (гомогенного) фермента. Удельная активность фермента = мкмоль (S или Р)/(мин х мг). Влияние температуры на скорость ферментативной реакции Ферментативные реакции, подобно другим химическим реакциям, ускоряются при повышении температуры, и их кинетика согласуется с правилом Вант-Гоффа. Для биологических катализаторов, которые являются белками, этот закон действует только в строго определенном температурном интервале. Температурный оптимум для большинства ферментов человека составляет 37-38°С. При увеличении температуры выше 40°С происходит денатурация фермента, сопровождающаяся изменением конформации белка. Снижение температуры замедляет броуновское движение молекул, взаимодействие фермента с субстратом, а значит, и образование продукта реакции идет с низкой скоростью. При 0°С ферменты сохраняют слабую активность, но в процессе замораживания клеток биохимические реакции приостанавливаются. После оттаивания, если соблюдаются определенные условия, ферментативные процессы могут возобновиться. 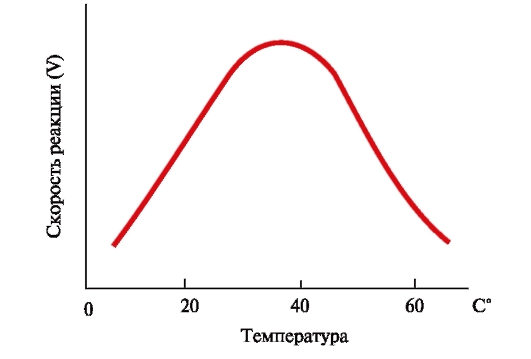 Кривая зависимости скорости ферментативной реакции(V) от температуры(t) При температуре выше оптимальной (tопт) происходит разрыв слабых водородных связей, стабилизирующих вторичную и третичную структуры фермента, наступает частичная или полная денатурация и, следовательно, изменяется конформация фермента и его активного центра; нарушается комплементарность активного центра и субстрата; снижается скорость ферментативной реакции Влияние pH на активность ферментов Ионы водорода (Н+) оказывают влияние на ферментативную активность различными путями. Они изменяют степень ионизации субстрата, продукта и самого фермента. Особое значение имеет ионизация функциональных групп активного центра фермента и фермент-субстратного комплекса, определяющих скорость реакции. При оптимальном для каждого фермента значении рН конформация активного центра фермента комплементарна субстрату. При изменении рН относительно оптимальных значений изменяется конформация фермента, активного центра, нарушается комплементарность и снижается скорость реакции. Зависимость ферментативной активности от рН среды имеет вид колоколообразной кривой Кислая и щелочная фосфатаза катализируют реакции дефосфорилирования фосфопротеинов или других органических молекул.  Эти ферменты участвуют в процессе ремоделирования костной ткани.  Кривые зависимости активности кислой (1) и щелочной (2) фосфатаз от pH Отклонение рН среды от оптимального вызывает изменение: ионизации функциональных групп фермента, а иногда и субстрата; заряда фермента и его конформации; конформации активного центра фермента; сродства фермента к субстрату; скорости ферментативной реакции. КЛАССЫ ФЕРМЕНТОВ Название ферментам в течение долгого времени давали путем добавления окончания -аза к названию субстрата, который участвует в данной ферментативной реакции. Так, ферменты, гидролизующие белки, были названы протеазами, а ферменты, гидролизующие жиры, - липазами. В настоящее время, согласно международному соглашению, ферменты подразделяются на 6 основных классов, включающих несколько подклассов. Классификация ферментов проводится в соответствии с типом катализируемой химической реакции. Название ферментов при этом складывается из названия субстрата (первая часть названия), типа катализируемой реакции (вторая часть названия) и окончания -аза. Например, ферменты, переносящие аминогруппы, называются аминотрансферазами, а переносящие фосфатную группу - фосфотрансферазами. Оксидоредуктазы катализируют окислительно-восстановительные реакции, характеризующиеся переносом электронов и протонов. В один из подклассов данного класса входят ферменты, превращающие CH-OH-группы в С=О группу. Примером может служить малатдегидрогеназа, катализирующая превращение малата в оксалоацетат с использованием кофермента NAD+, являющегося производным витамина РР. 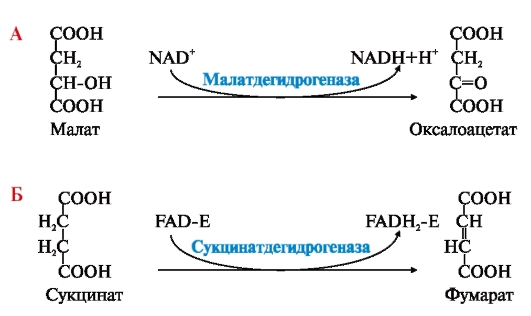 Примеры реакций, катализируемых NAD-зави- симыми (А) и FAD-зависимыми (Б ) дегидрогеназами Данный кофермент взаимодействует с апоферментом только в момент реакции и может отделяться от него в восстановленной форме (NADH), превращаясь в свободный донор водорода. В другую подгруппу входят ферменты, катализирующие образование ненасыщенных соединений, например, превращающих -CH-C2-последовательности в -НС=СН-группу. Сукцинатдегидрогеназа катализирует превращение сукцината в фумарат при участии простетической группы FAD, являющейся производным витамина В2 . В данном случае FAD всегда прочно связан с апоферментом, в отличие от кофермента NAD+. Помимо дегидрогеназ, в класс оксидоредуктаз входят оксидазы, пероксидазы и оксигеназы. Трансферазы катализируют перенос тех или иных групп (метильных, гликозильных, фосфатных, алкильных, амино-) от одного субстрата S1 (донора) к другому S2 (акцептору).  Реакция трансаминирования В зависимости от строения переносимых групп различают несколько подклассов трансфераз, например аминотрансферазы катализируют реакции переноса аминогруппы с α-аминокислоты на α-кетокислоту (трансаминирование). Результатом реакции является образование новой аминокислоты и новой кетокислоты. Простетической группой аминотрансфераз является пиридоксальфосфат - производное витамина В6. Фосфотрансферазы (киназы) катализируют реакции переноса фосфатных групп от АТФ на субстрат: 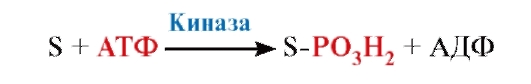 К данному классу относятся трансальдолазы, транскетолазы, метилтрансферазы, ацилтрансферазы, гликозилтрансферазы и др. Гидролазы гидролизуют пептидные, гликозидные и эфирные связи кислотных ангидридов, связи С=С, С-галоген. В реакциях гидролиза присоединение H2O идет по месту разрыва связи в молекуле субстрата. В зависимости от типа гидролизуемой связи класс гидролаз включает несколько подклассов: эстеразы, фосфатазы, пирофосфатазы, гликозидазы. Один из ферментов костной ткани - пирофосфатаза - гидролизует пирофосфат:  α-Амилаза (гликозидаза), вырабатываемая большими слюнными железами, катализирует гидролиз крахмала в ротовой полости:  Лиазы катализируют расщепление связей С-С, С-О, С-N, C-S без присоединения Н2О по месту разрыва, например превращение диоксифенилаланина в нейромедиатор дофамин.  Образование дофамина К этому же классу принадлежат ферменты, катализирующие отщепление простых молекул Н2О, Н2S образованием в продукте двойной связи или присоединение этих молекул по двойной связи. Изомеразы осуществляют взаимопревращения оптических и геометрических изомеров, перенос групп внутри молекул (мутазы).  Реакции, катализируемые изомеразами Лигазы катализируют реакции соединения двух молекул в более сложные соединения, в ходе которых образуются связи С-О, C-N, C-C и C-S. Такие превращения сопряжены с гидролизом макроэргической связи АТФ, ГТФ или другого макроэргического субстрата и освобождением энергии, использующейся для синтеза.  Реакция карбоксилирования ацетил-КоА К лигазам относятся аминоацил-тРНК-синтетазы, играющие важную роль на начальных стадиях синтеза белков клетки, ДНК-лигазы, участвующие в процессах синтеза и репарации ДНК. Карбоксилазы катализируют реакции включения молекулы СО2 в специфические субстраты. Простетической группой этих ферментов является биотин (витамин Н). |
