567-Текст статті-961-1-10-20200519. Г. А. ВакуленкоРак шейки матки Е. В. Харченко А. С. Рекута и беРеменность
 Скачать 250.31 Kb. Скачать 250.31 Kb.
|
  Огляди, лекції Огляди, лекції  Г.А. ВакуленкоРак шейки матки Е.В. Харченко А.С. Рекута и беРеменность: Национальный медицинский университет особенности им. А.А. Богомольца УДК 618.146 - 006.06 + 618.3 – 06 : диагностики и лечения 618.146 – 006.6 РезюмеВ огляді висвітлено сучасні підходи до діагностики й терапії раку шийки матки, асоційованого з вагітністю, та, зокрема, до можливості органозберігаючого лікування. Увагу приділено особливостям діагностики злоякісних новоутворень шийки матки, пов’язаних із вагітністю. Наведено відмінності в тактиці ведення таких хворих залежно від терміну гестації. ключові словаРак шийки матки, вагітність, хіміотерапія та вагітність, органозберігаючі операції. Возникновение злокачественных новообразований во время беременности – редкое явление. Регистрируется 1 случай на 1000-1500 беременностей. Однако, сталкиваясь с подобной ситуацией, многие врачи оказываются перед сложным выбором из-за отсутствия единого алгоритма лечения ввиду малого количества исследований подобных случаев. Данные литературы не устанавливают связь между состоянием беременности и онкологической патологией. Чаще всего встречаются рак шейки матки (РШМ), рак груди, меланома, Ходжскинская лимфома, рак яичников. Из них РШМ занимает первое место [1, 6, 7]: 1 на 1000-10000 беременностей (1-3% беременных среди общего числа впервые установленных случаев). Средний возраст больных – 30 лет, причем среди женщин до 35 лет такое сочетание наблюдается в 30%, а до 45 лет – в 23% [7]. Приблизительно половина этих случаев диагностируются в период беременности, остальные – в течение 12 месяцев после родов, что так же относится к опухолям, ассоциированным с беременностью. Цель работы: провести анализ литературных данных об особенностях диагностики и лечения пациенток, у которых РШМ диагностирован во время беременности. Рассмотреть варианты лечения с сохранением фертильности. материалы и методы Использованы данные результатов исследования, проведенных на базе Киевского городского онкологического центра, материалы поисковой системы PubMed, рекомендационные руководства Европейского и Американского онкологических обществ. Ключевые слова поиска: cervical cancer, cancer during pregnancy, chemotherapy and pregnancy. Вероятность выявления РШМ на ранней стадии среди беременных в три раза выше, чем среди общего числа женщин. Это объясняется обязательными регулярными гинекологическими осмотрами беременных. При исследовании 494 случаев возникновения РШМ среди беременных, было установлено, что практически в 84% случаев заболевание диагностируется на I стадии [2]. Гистологически опухоли распределились следующим образом: плоскоклеточный рак – 82,7%, аденокарцинома – 10,1%, железистосолидная карцинома – 7,1% [2]. Преобладание плоскоклеточных форм наблюдается и среди небеременных женщин. Диагностика патологических изменений шейки матки в период беременности не отличается от таковой среди общего контингента женщин, однако имеет ряд особенностей. клиническая картинаВ большинстве случаев заболевание протекает безсимптомно. При наличии симптомов в 50% случаев женщины могут жаловаться на наличие таблица 1. сравнение степени развития Ршм в момент диагностики среди беременных (n=494) и небеременных женщин [2, 4]
кровянистых выделений из половых путей [6] (что может быть ошибочно трактовано в I триместре как угроза прерывания беременности, а во II и III – как преждевременная отслойка нормально расположенной плаценты, предлежание плаценты), посткоитальные кровотечения, боли в гипогастрии. В случае более поздних стадий РШМ могут присоединяться боли в поясничной области, гематурия, дизурические явления и нарушения акта дефекации, что связано с инвазией опухоли в соседние органы или метастазированием [2, 4]. осмотр шейки матки Ввиду беременности шейка матки подвергается изменениям. Под воздействием гормонов в период беременности переходная зона между цилиндричным и многослойным плоским эпителием смещается к эктоцервиксу; это требуется учесть при осмотре [1]. Цитологическая диагностикаИзменения шейки матки не всегда можно оценить макроскопически, поэтому проведение цитологического исследования по Папаниколау (Рар-тест) является неотъемлемой частью гинекологического обследования при первом обращении женщины к гинекологу. Проведение забора материала в период беременности в большинстве случаев является безопасным, хотя возможны случаи кровотечения и спонтанного аборта. Исследования показали, что от 1,3% до 8% беременных женщин имеют изменения мазков [8-10]. Несколько факторов может усложнить трактовку результатов: наличие большого эктропиона, воспалительные изменения шейки матки и присутствие децидуальных клеток, которые часто ошибочно воспринимаются как атипичные [11, 13]. Цитолог должен быть информирован о том, что мазок взят у беременной во избежание трактовки ложно положительной реакции Ариас-Стеллы (развивающаяся в эндоцервикальных железах, аналогична изменениям в железах эндометрия при беременности; эта реакция сочетается с децидуализацией стромы и другими признаками беременности, ее следует дифференцировать от светлоклеточного рака эндоцервикса) [9]. кольпоскопия Выявление атипичных клеток в участке шейки матки может свидетельствовать о наличии цервикальной интраэпителиальной неоплазии (CIN) или о злокачественном процессе, поэтому проведение кольпоскопии является необходимым методом уточняющей диагностики. Здесь так же могут возникнуть некоторые трудности. Увеличение васкуляризации шейки матки во время беременности гиперболизирует реакцию метапластического эпителия на уксусную кислоту, таким образом визуально имитируя диспластические повреждения [10,12]. Наоборот, неопластические процессы на ранних сроках беременности могут быть ошибочно приняты как нормальное смещение переходной зоны или как доброкачественную цервикальную децидуализацию [10]. Если проведение кольпоскопии на ранних сроках беременности выполнить не удалось, то его следует повторить через 6-12 недель, так как зона трансформации «мигрирует» к эктоцервиксу, и таким образом к 20-й неделе гестации можно получить информативные результаты обследования. В зависимости от результатов кольпоскопии дальнейшая тактика ведения пациентки будет разной [11]: Шейка матки без патологических изменений или СIN I – повторный Рар-тест и диагностика вируса папилломы человека (ВПЧ) в послеродовом периоде (6 недель после родов). CIN II – повторная кольпоскопия в каждом триместре. Результаты без изменений – кольпоскопия/биопсия в послеродовом периоде (6 недель после родов). СIN III или кольпоскопическая картина злокачественного процесса – биопсия; консультация онкогинеколога. В период беременности возможна спонтанная регрессия CIN, поэтому тактика их ведения до родов – наблюдательная (исключение – прогрессия патологического процесса) [11, 13]. В случае регрессии CIN следует повторно проводить Рартестирование каждые 4-6 месяцев до получения 4 отрицательных результатов. После этого следует ежегодно делать повторные скрининговые цитологические исследования шейки матки [13]. Цервикальная биопсияПоказаниями к биопсии служат CIN III и кольпоскопическая картина атипического эпителия на шейке матки. Среди беременных женщин чувствительность биопсий составляет от 83,7 до 95,9%. Риск возникновения кровотечения – 1-3%. Такие осложнения как преждевременные роды и амниорексис являются казуистическими [4, 14]. конусовидная биопсия Конусовидная биопсия у беременных – это диагностическая, и может быть, лечебная манипуляция. Однако, существует риск развития осложнений как со стороны матери, так и со стороны плода. Отличием ее проведения является глубина конуса, которая составляет от 1,5 до 2 см у беременных, вместо 2,5-3 см. Это связано со смещением переходной зоны эпителия к влагалищной части шейки матки у беременных [26]. Показаниями к ее проведению есть определение наличия инвазии опухоли, что влияет на дальнейшую лечебную тактику. Наиболее частыми осложнениями конусовидной биопсии у беременных являются: кровотечение у 5% в I и II триместре беременности и 10% – в III-м; спонтанный аборт в 25% случаев;- преждевременные роды у 12%; - инфицирование у 2% беременных. Риск спонтанного аборта и кровотечения существенно снижается, когда манипуляция осуществляется во II триместре беременности – между 14 и 20 неделями [4]. методы визуализацииШироко используемыми в период беременности являются ультразвуковая диагностика и магнитно-резонансная томография. Однако, безопасность применения последней не доказана [16, 17]. Проведение контрастной МРТ с гадолинием возможно в период беременности [18]. Среди рентгенологических методов исследования наибольшую лучевую нагрузку на плод оказывает компьютерная томография (КТ) – табл. 1. Несмотря на то, что пороговая доза (величина пороговой повреждающей дозы для плода варьирует от 10 до 20 cГр) для проявления детерменистичных (дозозависимых) эффектов при лучевых исследованиях не достигается, нужно учесть стохастичные эффекты (независящие от дозы), так как плод имеет большое количество делящихся клеток, которые более всего подвержены негативному влиянию ионизирующего излучения. В дальнейшем, родивишиеся дети подвержены более высокому риску развития злокачественных новообразований, особенно если облучение приходилось на область живота и таза в III триместре беременности [17, 19, 20]. определение уровня онкомаркеров1. SCC (squamous cell carcinoma antigen) – антиген плоскоклеточной карциномы – выделен из печеночных метастазов плоскоклеточной карциномы шейки матки. Концентрация SCC в сыворотке крови может возрастать при злокачественных плоскоклеточных новообразованиях разных локализаций: кожы головы и шеи, пищевода, легких, анального канала, уретры, полового члена, при переходно-клеточном раке мочевого пузыря и вульвы [21]. Сегодня наиболее часто SСС используется в клинической практике для мониторинга больных плоскоклеточным раком шейки матки. По данным разных авторов, чувствительность маркера доходит до 87% при специфичности 90% [22]. На базе Киевского городского онкологического центра (КГОЦ) было проведено исследование по определению маркера SCC среди больных начальными формами рака шейки матки (T1a1), при распространенном процессе (T1b-T4) и среди здоровых женщин репродуктивного возраста (табл. 3) [27]. Как видно из табл. 3, уровень SCC среди больных начальными формами рака шейки матки был незначительно выше, чем у здоровых женщин. Однако, эти показатели находятся в рамках физиологической нормы (0-1,5 ng/ml). В группе более распространенных форм рака шейки матки этот показатель существенно возрастал (4,4-8,7 ng/ml) и превышал норму [27]. Можно сделать вывод, что данный метод не является информативным в случае диагностики ранних форм РШМ.
Однако, следует учесть, что при беременности уровень SCC повышен (в среднем 1,7 нг/мл). Это связано с развитием эпителия плода, и проведение данного исследования является неинформативным [37]. 2. Вирус папилломы человека (ВПч) – ДНК вирус, способный инфицировать клетки плоского эпителия и проявлять там репликативную активность. Папилломавирусы – это единственная группа вирусов с доказанной способностью индуцировать возникновение опухолей у человека. Известно, более 120 типов вируса, среди которых изученными есть лишь около 80. В зависимости от способности вызывать новообразования, все ВПЧ разделяются на 3 группы: низкоонкогенные; средней степени онкогенности; высокоонкогенные [25]. Риск развития рака шейки матки при присутствии ВПЧ составляет 99,7% (Peter A.Gearhart et аl., 2011). Во время беременности активизируются процессы метаплазии цервикального эпителия, который наиболее чувствителен к ВПЧ-инфекции именно в период метаплазии [26]. лечение Вопрос о лечении беременных женщин с патологией шейки матки является дискуссионным. Выбор метода лечения зависит от нескольких факторов: стадии заболевания, срока гестации и желания женщины сохранить беременность. При обнаружении начальных форм рака шейки матки (ca in situ, стадия IA1, IA2, IB) в I-II триместре и желании женщины сохранить беременность предлагается отсрочить лечение на послеродовой период с целью достижения зрелости плода [10, 17, 26]. Анализ 600 случаев преждевременных родоразрешений позволил установить закономерность в том, что ранняя неонатальная смертность уменьшается с 32,8% для рожденных в сроке 26-27 недель и до 2,7% – в 34-35 недель. Риск развития дистресс-синдрома плода также значительно варьирует: он наблюдается у 86,9% рожденных в сроке 26-27 недель, и в 12,7% случаев среди рожденных в сроке 34-35 недель [1]. Karam A., Feldman N. провели мета-анализ исследований, в которых изучалось влияние отсроченного лечения на исход заболевания и выживаемость среди матерей – табл. 4 [10]. Исходя из данных, приведенных в табл. 4, можно сделать вывод, что откладывание лечения ранних форм рака шейки матки не приводит к ухудшению прогноза для жизни пациентки и позволяет провести родоразрешение в сроки, максимально приближенные к физиологическим (37-42 нед.). Для контроля патологического процесса на шейке матки рекомендуется проведение кольпоскопии каждые 2 недели в течение беременности [26]. Показания к немедленному началу лечения: местно распространенный процесс; наличие метастазов в лимфатических узлах (наличие метастазирования в лимфатические узлы может быть установлено путем биопсии подвздошных лимфатических узлов при диагностической лапароскопии [17, 26]); желание пациентки; прогрессирование заболевания на протяжении беременности [28]. Обзор литературных данных указывает на отсутствие сведений о метастазировании рака шейки матки в плод, только в одном наблюдении был выявлен метастаз плоскоклеточного рака шейки матки в плаценту (Dildy G.A., Moise K.J., 1989). Химиотерапия и беременностьЕще недавно применение химиотерапии в период беременности казалось невозможным, ввиду опасения тератогенного эффекта. Сейчас эти взгляды изменились. Влияние химиотерапии на плод зависит от гестационного возраста, используемых лекарственных средств и их дозы. Наиболее уязвим плод в течение первых 10 недель гестации (органогенез), когда происходит активная дифференциация клеток. Использование химиотерапии в этот период может привести к порокам развития плода: монохимиотерапия – в 10% случаев [29], полихимиотерапия – в 25% [30]. «Безопасным» принято считать период после 12-14 недели гестации. Проводиться терапия может до срока 35 недель, ее следует прекратить за 3 недели до запланированной даты родов [17]. Это связано с возникновением транзиторной нейтропении у плода и угнетением костного мозга под воздействием терапии [10]. Вопрос дозирования цитотоксических препаратов для беременных оста ется не изученным, и требует дальнейших исследований. На данный момент используются схемы лечения, идентичные для небеременных женщин. лучевая терапияНа ранних сроках беременности использование дистанционной лучевой терапии приводит в 70% случаев к спонтанному выкидышу при дозе облучения 40 Гр. После этого, лечение следует продолжить брахитерапией [10, 26]. Следует извлечь плод/прервать беременность или провести экстирпацию матки перед началом лучевой терапии. лечения рака шейки матки в разные периоды беременностиI триместр. 1. Сa in situ. Лечение этой формы рака в период беременности не требует немедленного вмешательства. Возможно откладывание лечения на послеродовый период. По данным L.
Микроинвазивный рак (IA1). При желании пациентки сохранить беременность рекомендуется проведение конизации шейки матки во II триместре или откладывание лечения на послеродовый период (с проведением кольпоскопии в каждом триместре) и выполнение широкой конизации шейки матки через 4-8 недель после родов. Предпочтение отдается родоразрешению путем кесаревого сечения, но роды через естественные родовые пути возможны [26]. Гистерэктомия может быть проведена одновременно с кесаревым сечением, если пациентка больше не желает иметь детей. Ранние формы инвазивного рака шейки матки (IA2, IB, IIA). Касательно лечения этой формы рака шейки матки мнения врачей рызных стран разошлись. Урманчеева А.Ф. [26] и Коломиец Л.А. [32] рекомендуют прерывание беременности и выполнение радикальной гистерэктомии с подвздошной лимфаденэктомией и послеоперационным курсом лучевой терапии (через 2-3 недели). В отличие от российских коллег, в Европейских Руководствах по поводу ведения больных раком шейки матки в сочетании с беременностью (Guidelines of an International Consensus Metting) при постановке диагноза ранней формы рака шейки матки в I триместре и желании женщины сохранить беременность, рекомендуется отложить лечение до II триместра (см. лечение во II триместре) [17]. Рак шейки матки IIB-IV стадии. Химиорадиотерапия – это стандартный метод лечения стадий ІІВ и выше. Принципы лечения беременных не отличаются от таковых у небеременных женщин. Сохранение беременности в этих случаях невозможно. ІІ триместр. Ведение беременных пациенток с Сa in situ и микроинвазивным раком (IA1) во ІІ триместре не отличается от такового в І триместре: при Сa in situ возможно пролонгирование беременности и лечение после родоразрешения через естественные родовые пути. При микроинвазивном раке рекомендуется проведение конизации шейки матки после постановки диагноза и контрольная кольпоскопия в каждом триместре. После родов на 6-8 неделе выполняется широкая конизация. При нежелании пациентки в дальнейшем иметь детей совершается экстирпация матки без придатков.
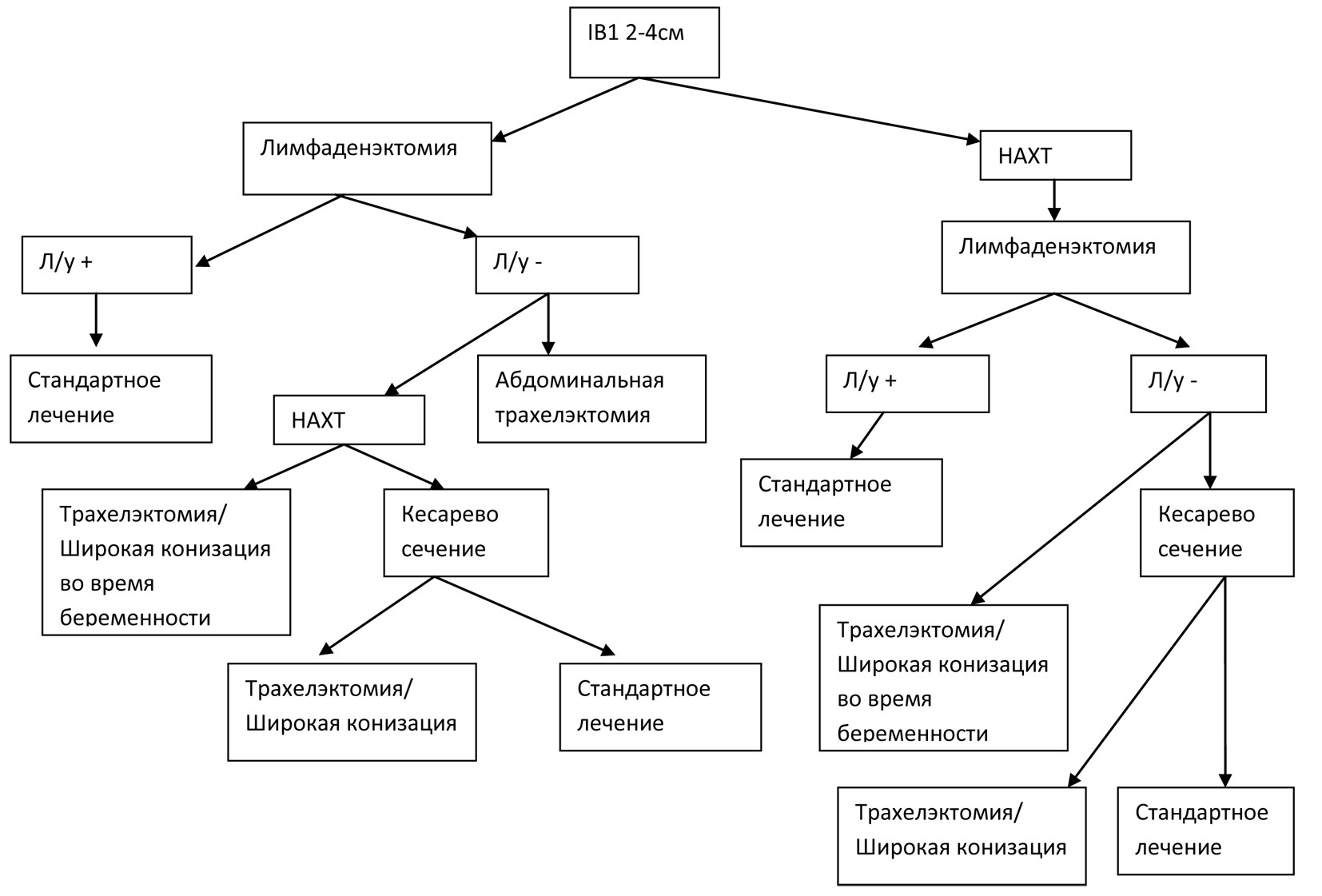
При диагностике рака шейки матки III-IV стадии беременность прерывается. Проводится курс стандартной химиолучевой терапии. Если диагноз установлен в конце ІІ триместра, есть возможность сохранения жизнеспособности плода при родоразрешении в этот период и далее продолжать лечение по стандартной схеме. ІІІ триместр. Диагностику в III триместре можно считать наиболее «благоприятной», ввиду фактической зрелости плода и возможности преждевременных родов без большой опасности для жизни новорожденного. В этом периоде все лечебные мероприятия наиболее рационально начинать после родоразрешения. Тактика ведения больных кардинальным образом не отличается от описанной выше при разных стадиях заболевания. Алгоритм лечения РШМ IB стдадии при размере опухоли 2-4 см приведен на рисунке. ПрогнозБольшинство исследований не находят разницы в прогнозе для жизни в группах беременных и небеременных женщин с инвазивным раком шейки матки [1, 33-35 ]. Как пример, в ретроспективном исследовании сравнивали 40 беременных женщин, больных раком шейки матки и 89 небеременных женщин с таким же диагнозом [1]. Показатели выживаемости матерей в течение 30-летнего наблюдения достоверно не отличались в обеих группах. В другом исследовании оценивали 53 беременных женщины с раком шейки матки ІВ стадии, которым диагноз был установлен в период беременности. Пятилетняя выживаемость была практически такой же, как и в группе небеременных женщин. Было установлено, что частота рецидивов среди беременных составляет 5,5%, такой же показатель характерен и для небеременных женщин до 50 лет [36]. Cравнивая исход беременности среди больных раком шейки матки в период беременности, уровень спонтанных абортов, снижение и экстремальное снижение веса плода при рождении наблюдались чаще. Зарегистрирован всего 1 случай метастазирования рака шейки матки в плаценту. ВыводыТаким образом, рак шейки матки во многих случаях не является приговором ни для матери, ни для плода. Регулярные гинекологические осмотры позволят установить заболевание на ранней стадии и дадут возможность не только сохранить жизнь и фертильность матери, но и жизнь ее будущего ребенка. Так как в Украине этой ние влияния щадящих операций на шейке матке проблеме не уделено должного внимания, в даль- в период беременности на течение беременности, нейшем целью наших исследований будет изуче- исход плода и прогноз для жизни женщины.  ЛитератураHoskins W.J., Perez C.A., Young R.C., Bakarat R., Markman M. Principles and practice of gynecologic oncology.; 2005.; 1279. Van Calsteren K., Vergote I., Amant F. Cervical neoplasia during pregnancy: diagnosis, management and prognosis. Best Pract. Res. Clin. Obstet. Gynaecol. 2005.;19:611-30. Toppenberg K.S., Hill D.A., Miller D.P. Safety of radiographic imaging during pregnancy. Am Fam Physician. 1999.;59:1813-1818. Carla Vitola Goncalves, Geraldo Duarte, Juvenal Soares Dias da Costa, Alessandra Cristina Marcolin. Diagnosis and treatment of cervical cancer during pregnancy. PubMed. Sheiner Eyal. Bleeding during pregnancy: a comprehensive guide. 2011:81-90. Eitan R, Abu-Rustum NR. Management of cervical carcinoma diagnosed during pregnancy. Primary Care Update for Ob/Gyns. 2003;10(4):196-200. Бохман Я. В. Руководство по онкогинекологии. – Л.: Медицина, 1989.; 464 с.: 99-103. Ruengkhachorn I., Benjapibal M. Cervical cancer in pregnancy. Siriraj Med J.; 2010; 62:47-51. Morimura Y., Fujimori K., Soeda S., Hashimoto T., Takano Y., Yamada H. et al. Cervical cytology during pregnancy – comparison with non - pregnant women and management of pregnant women with Abnormal cytology. Fukusima J Med Sci. 2002 Jun; 48(1): 27-37. Karam A., Goff B., Ramin S. M. Cervival cancer in pregnancy. PubMed. Hunter M.I., Monk J.B., Tewari K.S. Cervical neoplasia in pregnancy. Part 1: screening and management of preinvasive disease. American J of Obst and Gynecol. 2008 Jul; 88: 3-9. Burghardt E., Pickel H., Girardi F. Colposcopy-Cervical Pathology: Textbook and Atlas, 3 Rev ed, Thieme, 1998. Connolly T., Evans A.C. Atypical Papanicolaou smear in pregnancy. Clinical med and research. 2005; 1: 13-18. He G.F., Bian M.L., Wang Y., Liu X.Y. Cervical cytological screening and management in pregnant and postpartum women. Clin Med Sci J. 2005; 20(4): 242-6. Baldauf J.J., Fender M. Management of women in pregnancy. Guidelines. Nagayama M., Watanabe Y., Okumura A. et al. Fast MR imaging in obstetrics. Radiographics. 2002; 22: 563-580. Amant F., Calsteren K., Halaska M., Beijen J. et al. Gynecologic cancers in pregnancy: guidelines of an International Consensus Meeting. IGSC and ESGO. 2009; 9:2-5. Webb J.A., Thomsen H.S., Morcos S.K. The use of iodinated and gadolinium contrast media during pregnancy and lactation. Eur. Radiol. 2005; 15: 1234-1240. Doll R., Wakeford R. Risk of childhood cancer from fetal irradiation. Br. J. Radiol. 1997; 70: 130-139. Lowe S.A. Diagnostic radiography in pregnancy: risks and reality. Aust. N.Z.J. Obstet. Gynaecol. 2004; 44: 191-196. Van-der-Sijde R., de-Bruijn H., Kraws M. et al. Significance of serum SCC antigen as a tumor marker in patients with squamous cell carcinoma of the vulva . Gynecol-Oncol. 1998. Vol. 35, N 2. – P. 227-232. Сергеева Н.С., Маршутина Н.В. Серологические опухолевые маркеры . Онкология. Клинические рекомендации. 2-е изд., исправ. и доп. М.: Издательская группа «ГЭОТАР Медиа», 2009. С. 83-134. Сергеева Н.С. Серологический онкомаркер SСС в диагностике рака шейки матки. Справочник заведующего клинико-диагностической лабораторией. – №4. – 2011. Franceschi S., Plummer M., Clifford G. et al. Differences in the risk of cervical cancer and human papillomavirus infectio n by education level. British Journal of Cancer. 2009. – Vol. 101: 865-870. Гуменюк Е.Г. Роль вируса папилломы человека в возникновении гинекологической и онкологической патологи. Методические рекомендации. – Спб. – 2001. – 5 с. Урманчеева А.Ф. Рак шейки матки и беременность. – Практическая онкология. – 2002. – №3. – С. 183-191. Вакуленко Г.О. Етіопатогенетичний підхід до лікування початкових форм раку шийки матки. Дисертація на здобуття наукового ступеня доктора медичних наук. – Київ. – 2001. – С. 137-138. Duggan B., Muderspach L.I., Roman L.D. et al. Cervical cancer in pregnancy: reporting on planned delay in therapy. Obstet Gynecol 1993; 82:598. Nicholson H. Cytotoxic drugs in pregnancy: review of reported cases. J Obstet Gynecol Br Commonwealth., 75: 307, 1968. Episiotomy site recurrences following vaginal delivery. Obstet. Gynecol., 84: 179, 1994. Caluwaerts S., VAN Calsteren K., Mertens L. et al. Neoadjuvant chemotherapy followed by radical hysterectomy for invasive cervical cancer diagnosed during pregnancy: report of a case and review of the literature. Int J. Gynecol. Cancer 2006; 16: 905. Коломиец Л.А. Рак шейки матки и беременность. НИИ онкологии Томского научного центра СО РАМН. – Сибирский онкологический журнал. – 2003. – С. 21-22. Zemlickis D., Lishner M., Degendorfer P. et al. Maternal and fetal outcome after invasive cervical cancer in pregnancy. J Clin Oncol 1991; 9: 1956. Monk B.J., Montz F.J. Invasive cervical cancer complicating intrauterine pregnancy: treatment with radical hysterectomy. Obstet Gynecol. – 1992; 80: 199. Dalrymple J.L., Gilbert W.M., Leiserowitz G.S. et al. Pregnancy-associated cervical cancer: obstetric outcomes. J Matern Fetal Neonatal Med 2005; 17: 269. Pettersson B.F., Andersson S., Hellman K., Hellstr?m A.C. Invasive carcinoma of the uterine cervix associated with pregnancy: 90 years of experience. Cancer 2010; 116: 2343. Сергеева Н.С., Дубовецкая О.Б. и соавт. Антиген плоскоклеточного рака (SCC) в норме, при раке шейки матки и других патологических состояниях. Российский онкологический журнал. – 2004. – № 5. – С. 51. сervICal CanCer durIng pregnanCy: TreaTmenT and dIagnoSISG.А. Vakulenko, Е.V. Charchenko, А.S. Rekuta SummaryThis article represents literature review on modern methods of treatment of cervical cancer, associated with pregnancy; possibility of organo-saving treatment. attention was given to diagnosis of malignancies in the cervix during pregnancy. There was given differencies in treatment depend on the term of pregnancy. Keywords Cervical cancer, pregnancy, chemotherapy during pregnancy, organo – saving surgery. 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||