галогенпроизводные углеводородов. Галогенопроизводные углеводородов
 Скачать 250 Kb. Скачать 250 Kb.
|
|
ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ Галогенопроизводные углеводородов являются продуктами замещения атомов водорода в углеводородах на атомы галогенов: фтора, хлора, брома или йода. 1. Строение и классификация галогенопроизводных Атомы галогенов связаны с атомом углерода одинарной связью. Как и другие органические соединения, строение галогенопроизводных может быть выражено несколькими структурными формулами, например: 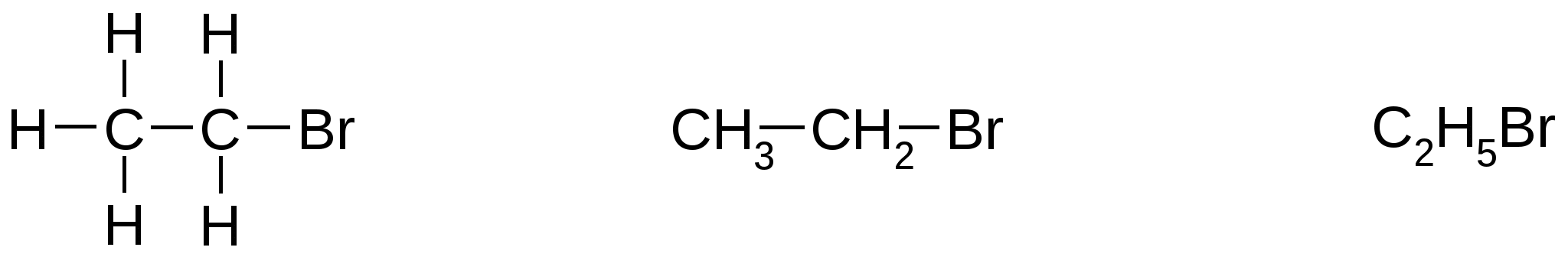 бромэтан (этилбромид) Классифицировать галогенопроизводные можно несколькими способами:
 Атомы галогенов являются более электроотрицательными, чем углерод, поэтому они являются электроноакцепторными заместителями, проявляя отрицательный индуктивный эффект (-I):  При наличии p,-сопряжения атомы галогена проявляют также и мезомерный эффект: 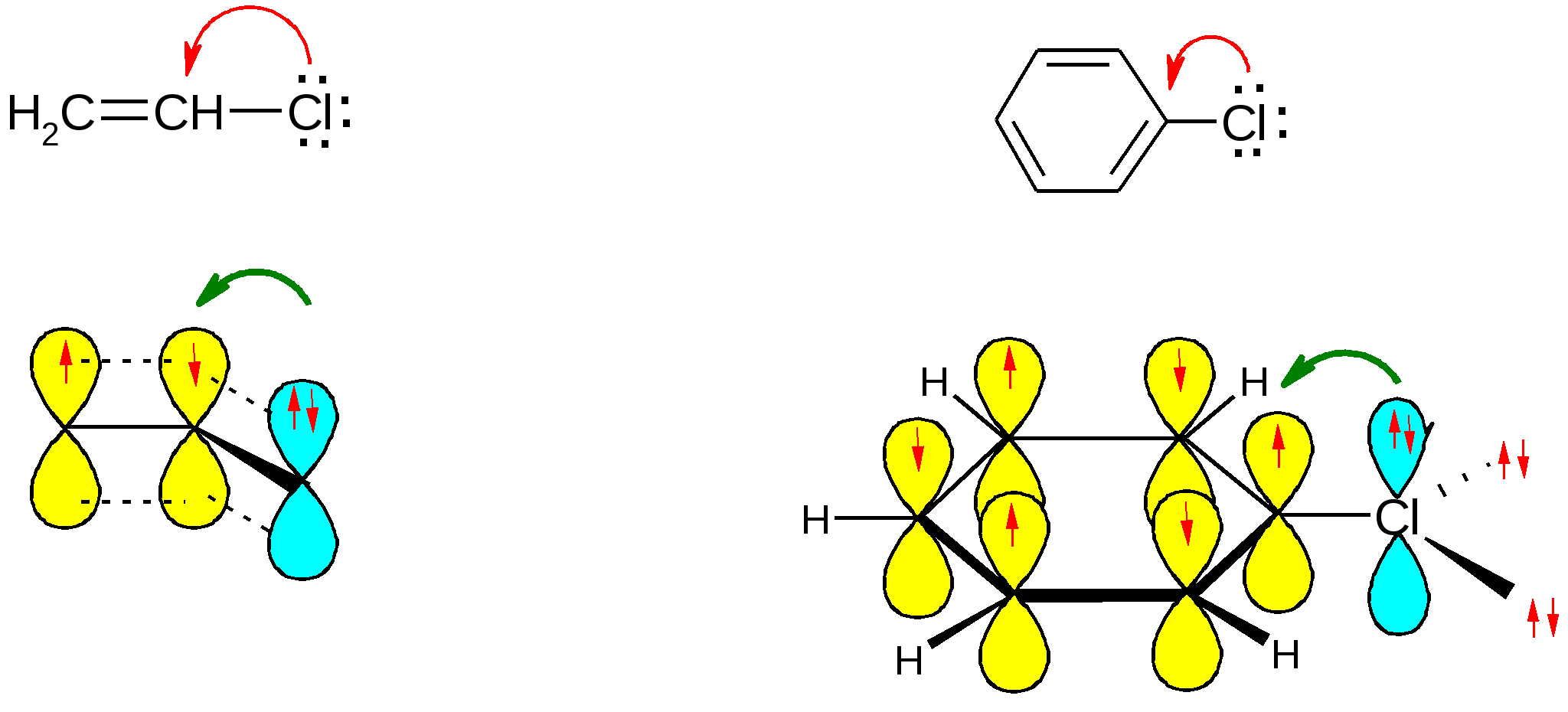 хлорэтен (винилхлорид) хлорбензол Как видно из рисунка, атом галогена подаёт электроны по системе сопряжения, проявляя положительный мезомерный эффект (+M). Таким образом, атомы галогенов проявляют и –I-эффект, и +M-эффект, причём индуктивный эффект в данном случае более выражен, чем мезомерный (–I > +M), поэтому атомы галогена всегда являются электроноакцепторными заместителями. 2. Номенклатура По номенклатуре ИЮПАК положение и название галогена указывается в приставке. Нумерация начинается с того конца молекулы, к которому ближе расположен атом галогена. Если присутствует двойная или тройная связь, то именно она определяет начало нумерации, а не атом галогена:  3-метил-1-хлорбутан 3-бромпропен До сих пор широко используется т.н. “рациональная номенклатура” для составления названий галогенопроизводных. В этом случае название строится следующим образом: углеводородный радикал + галогенид. этилхлоридбутилбромидвинилхлорид (ИЮПАК: хлорэтан 1-бромбутанхлорэтен) Некоторые галогенопроизводные имеют тривиальные названия, например ингаляционный анестетик 1,1,1-трифтор-2-бром-2-хлорэтан (CF3-CBrClH) имеет тривиальное название фторотан. Тригалогенметаны обычно называются галоформами: хлороформ бромоформ йодоформ 3. Изомерия 3.1. Cтруктурная изомерия 3.1.1. Изомерия положения заместителей 1-бромбутан 2-бромбутан 3.1.2. Изомерия углеродного скелета  1-хлорбутан 2-метил-1-хлорпропан 3.2. Пространственная изомерия Стереоизомерия может проявляться при наличии четырёх разных заместителей у одного атома углерода (энантиомерия) или при наличии разных заместителей при двойной связи, например:  транс-1,2-дихлорэтен цис-1,2-дихлорэтен 4. Физические и биологические свойства Температуры плавления и кипения повышаются в ряду: R-Cl, R-Br, R-I, а также при увеличении количества атомов углерода в радикале:  Рис. 1. Зависимость температуры кипения алкилгалогенидов от количества атомов углерода в цепи для хлор-, бром-, йодалканов (С1-С6). Как видно из графика, газами при обычных условиях должны быть метилхлорид, этилхлорид и метилбромид. Последующие члены гомологических рядов являются жидкостями, высшие алкилгалогениды (начиная с C17) являются твёрдыми телами. Температуры плавления и кипения также закономерно растут при увеличении количества атомов галогена в галогенопроизводном (за исключением фторпроизводных), например: t кип. oC -23,7 40 61,2 76,8 Галогенопроизводные являются гидрофобными веществами: они плохо растворяются в воде и хорошо растворяются в неполярных гидрофобных растворителях. Многие галогенопроизводные используются как хорошие растворители. Например, хлористый метилен (CH2Cl2), хлороформ (CHCl3), четырёххлористый углерод (CCl4) используются для растворения масел, жиров, эфирных масел. Перфторалканы (полностью фторированные алканы, “пер” означает полностью) обладают аномально высокой способностью растворять газы, например кислород, поэтому на основе перфторуглеводородов был разработан препарат перфторан (флуозол), применяющийся в качестве заменителя крови. Галогенопроизводные алканов, как правило, обладают характерным сладковатым запахом и выраженным наркотическим эффектом, поэтому, например, хлороформ раньше очень широко использовался для ингаляционного наркоза. В настоящее время очень широко используется для этой цели фторотан – 1,1,1-трифтор-2-бром-2-хлорэтан. Многие галогенопроизводные очень ядовиты; так, очень токсичен четырёххлористый углерод CCl4. ДДТ (дихлордифенилтрихлорэтан) используется как мощный инсектицид. В природе ДДТ очень стабилен и поэтому накапливается в окружающей среде, жировых тканях животных и молоке. Применение его в сельском хозяйстве во многих странах давно прекращено (в СССР с 1970 года). Тем не менее, в своё время ДДТ сыграл очень важную роль в борьбе с малярией. 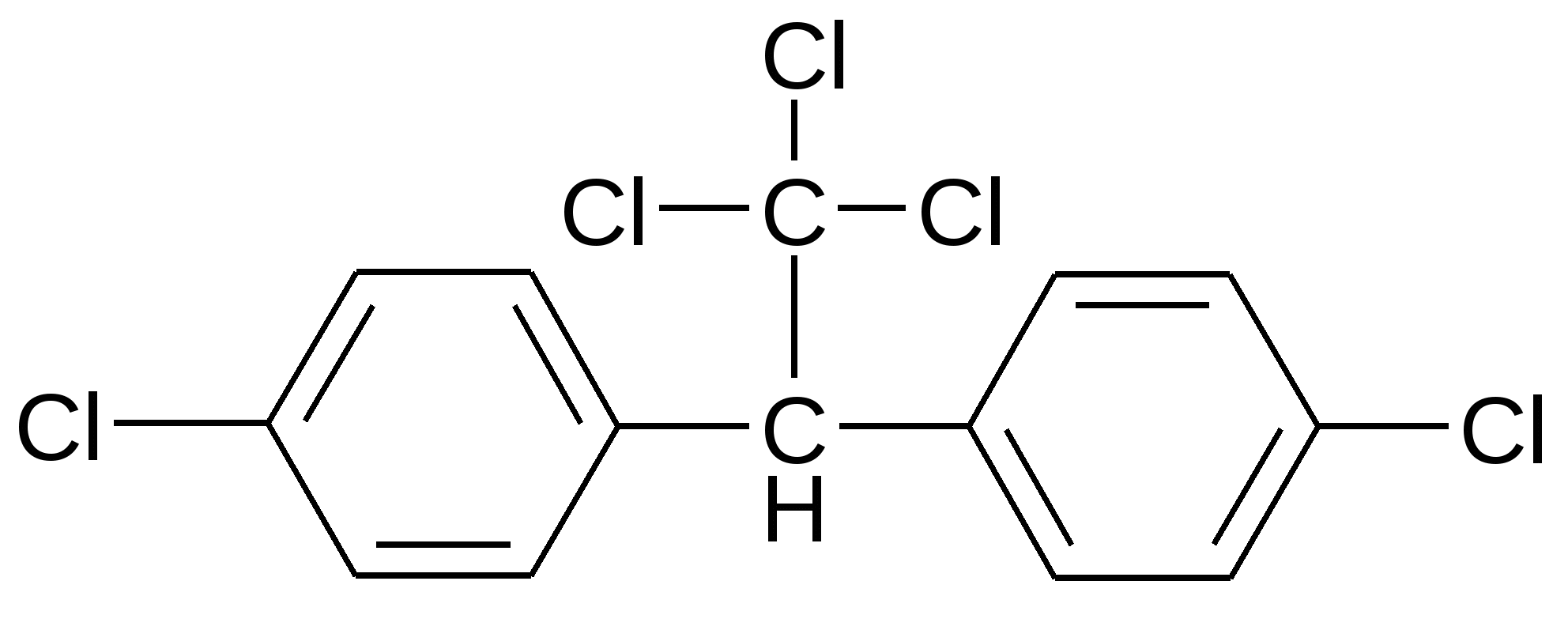 ДДТ 5. Химические свойства 5.1. Реакции нуклеофильного замещения Атомы галогенов довольно подвижны и могут замещаться под действием разнообразных нуклеофилов, что используется для синтеза разнообразных производных: 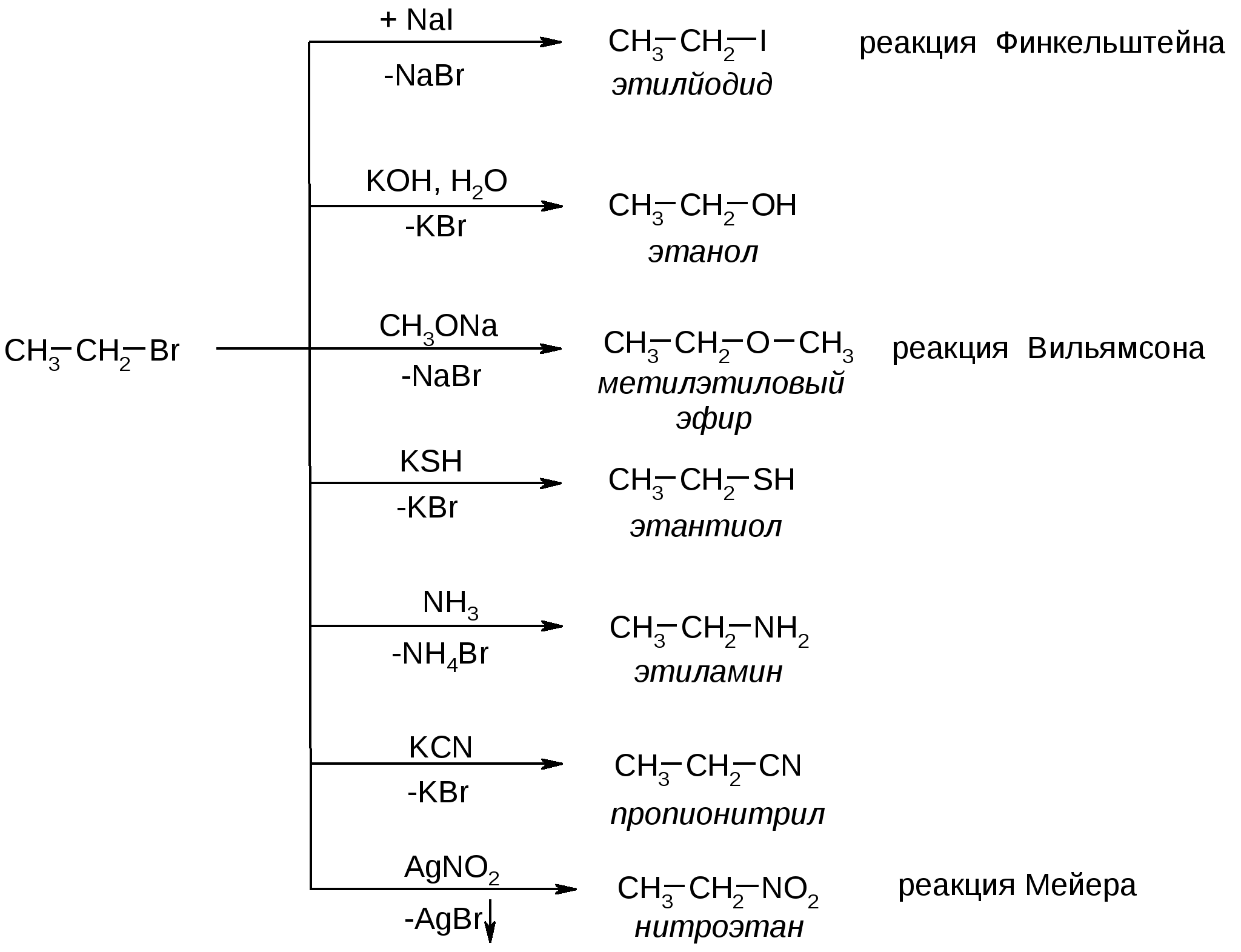 Механизм реакций нуклеофильного замещения В случае вторичных и первичных алкилгалогенидов, как правило, реакция идёт как бимолекулярное нуклеофильное замещение SN2:  SN2 реакции являются синхронными процессами – нуклеофил (в данном случае OH-) атакует атом углерода, постепенно образуя с ним связь; одновременно с этим постепенно разрывается связь С-Br. Уходящий из молекулы субстрата бромид-ион в называется уходящей группой или нуклеофугом. В случае SN2 реакций скорость реакции зависит от концентрации и нуклеофила, и субстрата: v= k [S] [Nu] v – скорость реакции, k- константа скорости реакции [S] – концентрация субстрата (т.е. в данном случае алкилгалогенида) [Nu] – концентрация нуклеофила В случае третичных алкилгалогенидов нуклеофильное замещение идёт по механизму мономолекулярного нуклеофильного замещения SN1: 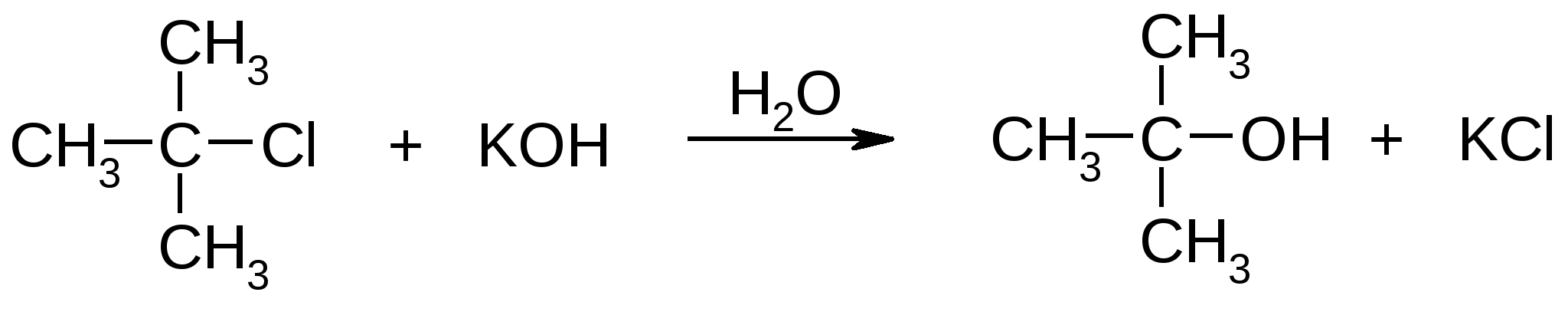 трет-бутилхлорид трет-бутанол Механизм этой реакции очень напоминает механизм реакций обмена в неорганической химии, является диссоциативным и идёт в две стадии: 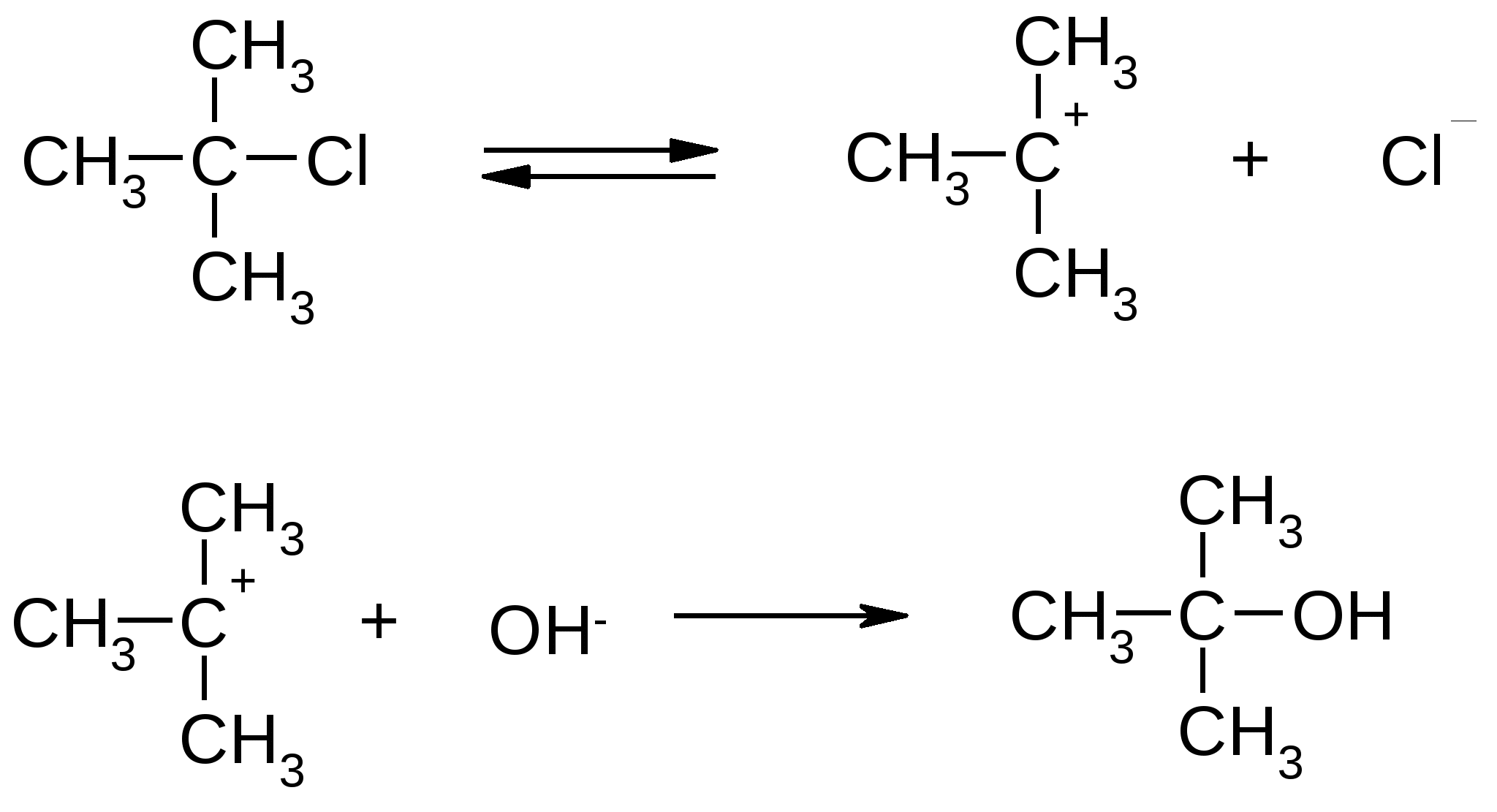 карбокатион нуклеофил продукт В случае SN1 реакций скорость реакции зависит от концентрации субстрата и не зависит от концентрации нуклеофила: v= k [S] По таким же механизмам идут реакции нуклеофильного замещения и в случае спиртов и во многих других случаях. Кроме реакций SN1 и SN2 замещение может идти по механизму SNi. Нуклеофильное замещение у винильного атома углерода может осуществляться по 10 различным механизмам, а нуклеофильное замещение в ароматических системах может идти по 4 различным механизмам. 5.2. Реакции элиминирования (отщепления) – дегидрогалогенирования В результате реакций элиминирования в случае алкилгалогенидов образуется алкены и галогеноводороды. Например, при нагревании этилхлорида с щёлочью в спирте происходит элиминирование HCl и идёт образование этилена: 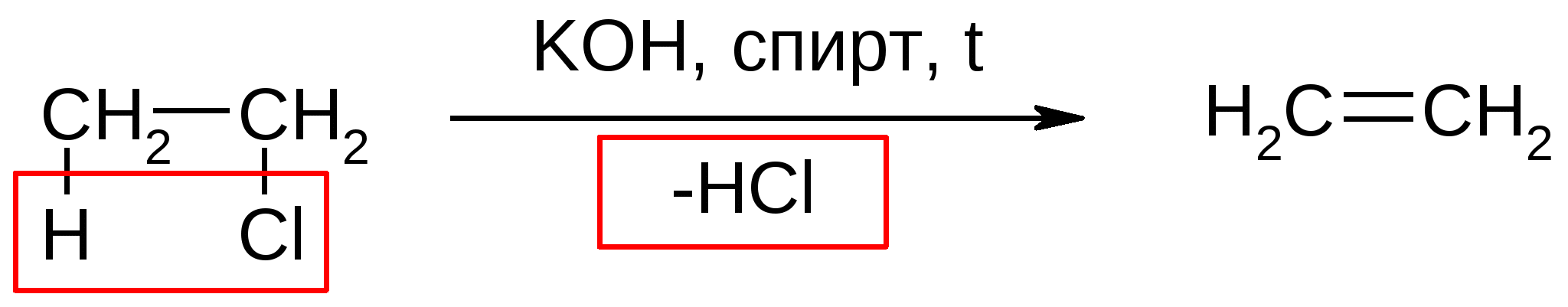 Следует обратить внимание на то, что если проводить эту реакцию в воде, а не в спирте, то основным продуктом будет спирт, а не алкен. В случае несимметричных алкилгалогенидов реакции дегидрогалогенирования идут в соответствии с правилом Зайцева: Отщепление атома водорода в реакциях отщепления HX происходит от наименее гидрогенизированного атома углерода. Например, отщепление бромоводорода от 2-бромбутана может происходить двумя путями: 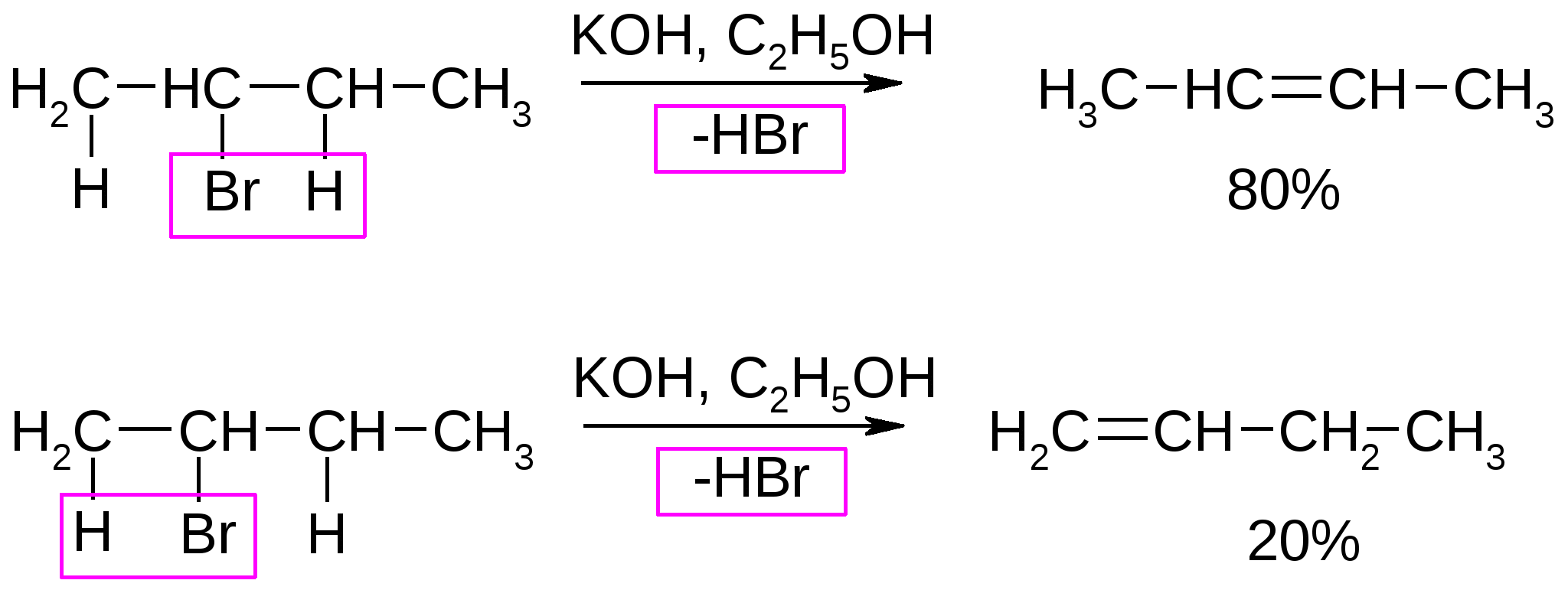 Действительно, реализуются оба пути, но преимущественно образуется бутен-2 (80%), в то время как бутен-1 образуется в малом количестве (20%). Механизмы реакций элиминирования Элиминирование галогеноводородов может осуществляться по 3 основным механизмам: E1, E2 и E1cb Механизм E1 Алкилгалогенид диссоциирует с образованием карбокатиона и галогенид-иона. Основание (B:) отрывает от образующегося карбокатиона протон с образованием продукта – алкена:  субстрат карбокатион продукт Такой механизм характерен для третичных алкилгалогенидов. Механизм E1cb В этом случае последовательность другая: основание отрывает от алкилгалогенида протон с образованием карбоаниона, от которого потом отщепляется галогенид-ион с образованием алкена: 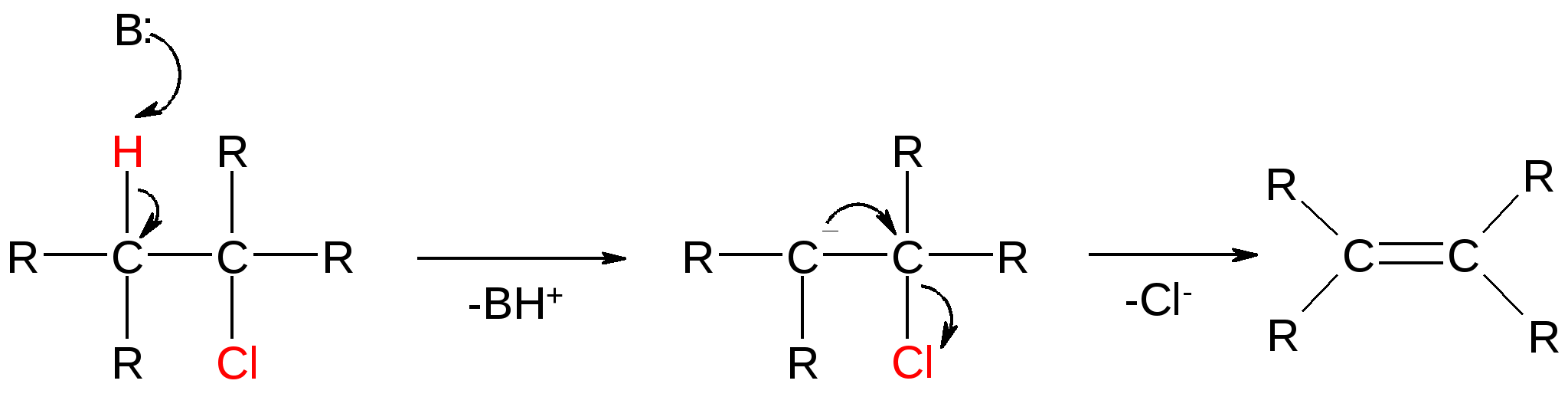 карбоанион Этот механизм встречается нечасто, например он показан для реакции элиминирования HF от 1,1,1-трифтор-2,2-дихлорэтана. Механизм E2 В этом случае отрыв протона и галогенид-иона происходит синхронно, т. е. одновременно: 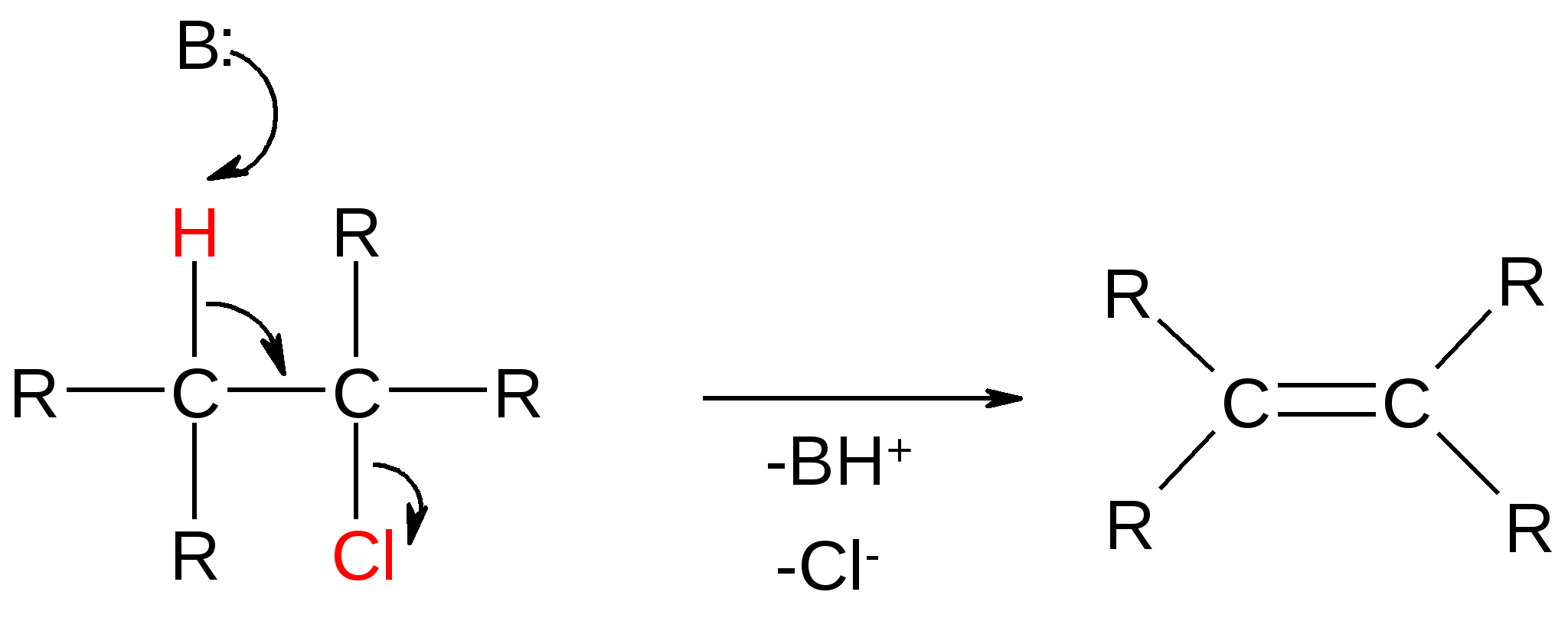 Механизм E2 характерен в основном для первичных и вторичных алкилгалогенидов. Аналогичные механизмы наблюдаются в случае элиминирования воды от спиртов и в других случаях. 5.3. Взаимодействие с металлами 5.3.1. При взаимодействии алкилгалогенидов с щелочными металлами происходит реакция Вюрца с образованием алканов: бромметан этан Реакция протекает через образование натрийорганических соединений и не идёт с третичными алкилгалогенидами. 5.3.2. При взаимодействии с активными двухвалентными металлами образуются очень полезные в синтетическом плане металлоорганические соединения: 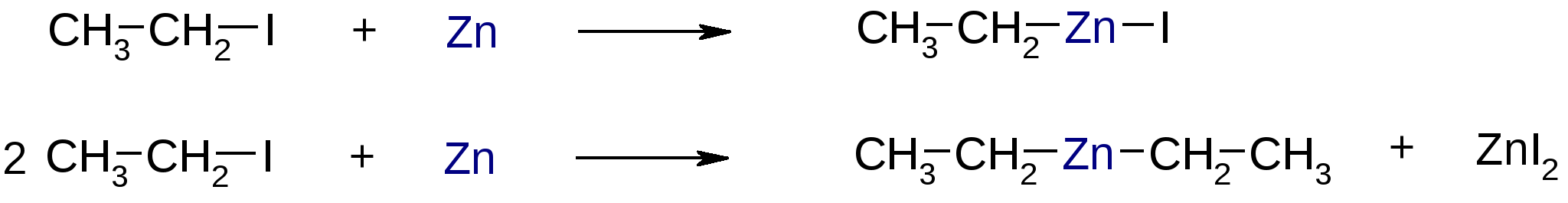 Zn-Органические соединения используются или образуются в реакциях Бутлерова, Зайцева, Вагнера и Реформатского. Бόльшее значение имеют Mg-органические соединения – реактивы Гриньяра (В. Гриньяр – лауреат Нобелевской премии 1912 г.). Они образуются при выдерживании металлического магния в эфирном растворе, содержащем алкилгалогенид: этилбромид этилмагнийбромид Реактивы Гриньяра в отличие от цинкорганических соединений не воспламеняются на воздухе и являются очень удобными для органического синтеза. Используя реактивы Гриньяра, можно получить самые разнообразные производные: алканы, спирты, карбоновые кислоты, меркаптаны, металлоорганические соединения: 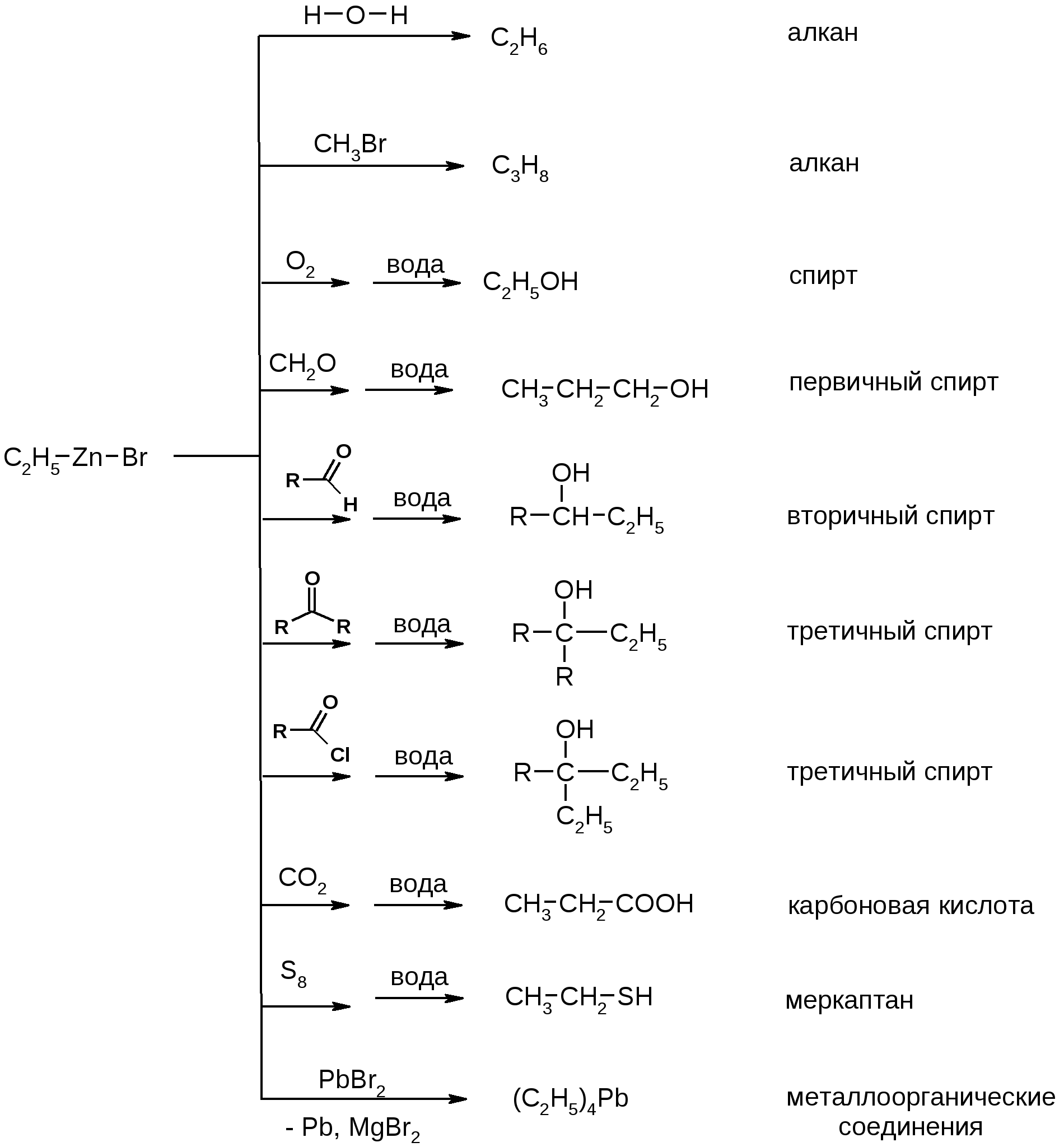 5.4. Реакции окисления Галогенопроизводные горят, образуя углекислый газ, воду и галогеноводороды, например: При нагревании галогенопроизводного с медью, атомы галогена отщепляются с образованием летучих хлоридов меди, окрашивающих пламя в красивый зелёный или сине-зелёный цвет, – эта качественная реакция на галогенопроизводные называется пробой Бейльштейна. Галогенопроизводные, содержащие большое количество атомов галогена, практически не горят. Например, фторопласт (тефлон) является материалом чрезвычайно устойчивым к действию кислот, щелочей, окислителей и воздуха, поэтому он применяется в производстве изделий электротехнической, радиотехнической и химической промышленности. Фторопласт получают полимеризацией перфторэтилена:  В холодильных установках для отнятия теплоты от охлаждаемого объекта используются особые вещества – хладагенты. В основном для этой цели используются аммиак, элегаз (SF6), некоторые углеводороды (изобутан) и фреоны – фторсодержащие галогенопроизводные метана и этана. Известно около 40 различных фреонов. Примерами фреонов являются: фреон-11 CCl3F, фреон-12 CCl2F2, фреон-13 CClF3, В отличие от аммиака, фреоны очень инертны в химическом отношении и не ядовиты, а в отличие от изобутана – пожаро- и взрывобезопасны. Кроме того, они устойчивы к действию кислот и щелочей. Поэтому благодаря такой инертности и безопасности фреоны и используются не только как хладагенты в холодильниках, но и как выталкивающая основа в баллончиках и для тушения пожаров. Однако, у фреонов есть один крупный недостаток: так как они очень инертны, они плохо разрушаются. В верхних слоях атмосферы, поглощая УФ-свет, они гомолитически диссоциируют, образуя атомы хлора (или брома), которые катализируют разрушение озона, защищающего Землю от действия жёсткого УФ-излучения Солнца, губительного для живых организмов и вызывающего мутации и рак кожи. В 1987 году был разработан так называемый Монреальский протокол – международный договор, предусматривающий для каждой группы фреонов определённый срок, в течение которого их производство должно быть остановлено. К декабрю 2009 года Монреальский протокол был подписан 196 странами. Бывший генеральный секретарь ООН Кофи Аннан однажды заявил, что «возможно, единственным очень успешным международным соглашением можно считать Монреальский протокол» [ru.wikipedia.org/wiki/Монреальский_протокол]. 6. Получение галогенопроизводных 6.1. Галогенирование углеводородов Реакция алканов с хлором и бромом происходит на свету или при нагревании. Реакция с йодом практически не идёт, а фтор реагирует слишком активно, поэтому для фторирования алканов используется не сам фтор, а фторид кобальта (III). Реакции идут по механизму радикального замещения SR (механизм реакции см. в Лекции 3). метан хлор хлорметан хлороводород Галогенирование ароматических углеводородов проводят галогенами в присутствии катализаторов – кислот Льюиса, например галогенидов алюминия или железа (см. Лекцию 7). Образующийся при хлорировании бензола хлорбензол используется для производства фенола (см. Лекцию 10), который является очень важным промышленным продуктом – из него получают фенолформальдегидную смолу, многие красители и лекарственные препараты. 6.2. Гидрогалогенирование – присоединение галогеноводородов к ненасыщенным углеводородам. Реакция, как правило, идет по механизму электрофильного присоединения (AE).  пропен 2-хлорпропан Присоединение HCl к ацетилену используется в промышленности для получения винилхлорида (хлорэтилена):  Винилхлорид Винилхлорид является исходным веществом в производстве ПВХ – поливинилхлорида, который используется для получения пластмасс, пластизолей и поливинилхлоридного волокна. Винилацетилен (бутенин) присоединяет HCl, образуя при этом хлоропрен, из которого далее получают хлоропреновый каучук (неопрен, подробнее см. свойства диенов в Лекции 5): Хлоропрен 6.3. Замещение гидроксигруппы спиртов на галоген Реакции замещения гидроксигруппы на атом галогена идут по механизму SN. Этот обмен может быть осуществлён действием галогеноводородных кислот в присутствии катализаторов: В случае HBr реакция может идти и без катализатора. Для получения из спиртов алкилхлоридов в качестве катализатора можно использовать хлорид цинка, а в качестве источника нуклеофила – концентрированную соляную кислоту. Раствор хлорида цинка в концентрированной соляной кислоте называется реактивом Лукаса – он используется для определения первичных, вторичных и третичных спиртов (см. Лекцию 9). Другой часто используемый метод – это действие на спирты галогенидами фосфора и серы: 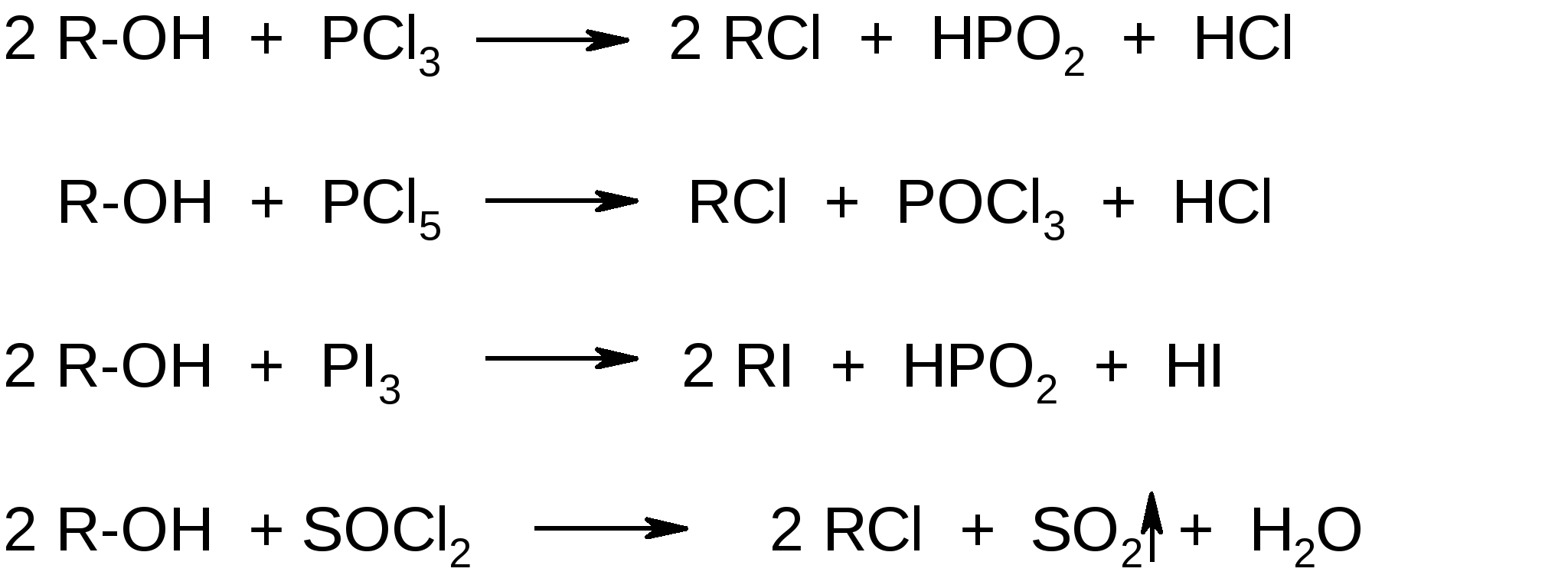 В последнем случае образуется летучий побочный продукт – сернистый газ, что значительно облегчает последующее выделение алкилгалогенида. 6.4. Реакция Бородина-Хунсдиккера Реакция Бородина-Хунсдиккера была открыта русским химиком и композитором А. П. Бородиным и подробно изучена немецким химиком Х. Хунсдиккером. Бородин Александр Порфирьевич (1833 – 1887), русский композитор и химик. Написал оперу «Князь Игорь», 3 симфонии и другие произведения. Разработал методы получения бромзамещенных (1861) и фторангидридов (1862) органических кислот. В 1861 г. открыл реакцию Бородина-Хунсдиккера и в 1872 году (одновременно с Ш. А. Вюрцем) обнаружил альдольную конденсацию. Реакция Бородина-Хунсдиккера представляет собой окислительное декарбоксилирование серебряных солей карбоновых кислот под действием галогенов (Br2, Cl2, I2). бутаноат серебра 1-бромпропан Существуют разновидности этой реакции, например реакция Кочи: окислительное декарбоксилирование карбоновых кислот в присутствии хлорида лития, приводящее к алкилхлоридам. В качестве окислителя используется ацетат свинца (IV): 6.5. Галоформная реакция Галоформы – это тригалогенметаны, то есть соединения, имеющие общую формулу CHHal3. Галоформы легко образуются при добавлении к соединениям, содержащим группу CH3-C(O)-, растворов гипогалогенитов (которые легко получить, добавив галоген к раствору щёлочи), например:  соль кислоты йодоформ Впервые галоформная реакция была осуществлена с хлорной известью и спиртом (который хлорной известью окисляется до ацетальдегида) в 1831 году немецким химиком Ю. Либихом и французским химиком Э. Субейраном: таким образом впервые был получен хлороформ – вещество, которое в дальнейшем широко использовалось в медицине как ингаляционный анестетик. Кроме того, хлороформ является прекрасным растворителем, а также применяется в составах для растираний, используемых при мышечных и невралгических болях. Йодоформ широко используется как антисептик в медицине и ветеринарии. В заключении отметим, что химия галогенопроизводных очень разнообразна и включает в себя несколько важных практических и теоретических аспектов:
Нижник Я.П. http://norgchem.professorjournal.ru Страница |
