Химия нефти и газа л. 13 Термические превращения углеводородов нефти
 Скачать 115.5 Kb. Скачать 115.5 Kb.
|
|
ХИМИЯ НЕФТИ И ГАЗА Л. 13 Термические превращения углеводородов нефти. Термическая стабильность углеводородов. Термические превращения углеводородов в газовой и жидкой фазе. Пиролиз. Образование нефтяного кокса. Промышленные процессы термической переработки нефти. К нефтепереработке относят небольшой набор технологий, который позволяет получить либо целевые готовые продукты (топлива, масла, смазки, битум) либо сырье для дальнейших нефтехимического синтеза и технологий переработки, облагораживания нефтепродуктов. 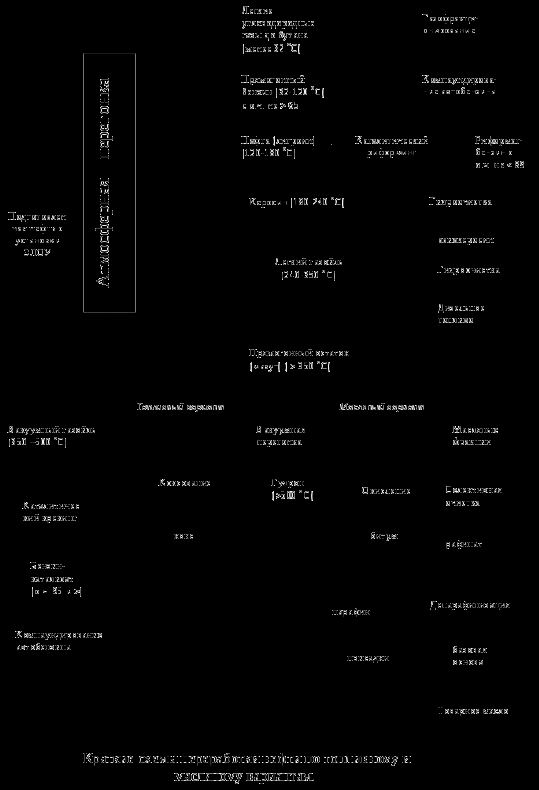 Технологии нефтепереработки можно разделить на 2 основные группы: Первичная переработка: Перегонка (атмосферная и вакуумная «глубокая») Вторичная переработка: Термическая переработка (крекинг, висбрекинг, пиролиз и коксование), Термокаталитическая переработка (каталитические крекинг, риформинг, гидроочистка, гидрокрекинг, и др.), Технологии очистки, рафинирования, компаундирования, облагораживания, дополнительного разделения, и др. Термические превращения углеводородов нефти Химики говорят «все химические реакции протекают всегда», но одни протекают быстро и заметно, другие медленно. Чтобы они протекали быстро и с большим выходом продукции нужно создать подходящие условия. Нефть - это набор веществ, которые находятся в подвижном термодинамическом равновесии. От крупных молекул смол могут отрываться мелкие фрагменты, а легкие, подвижные молекулы могут конденсироваться и осмоляться, переходя в смолы. Все эти реакции можно ускорить, если добавить энергию в нефтяную систему. При добавлении энергии молекулы становятся менее стабильным, с ними начинают происходить различные реакции. Причем скорость реакций увеличивается неравномерно. Так, при повышении температуры больше всего ускоряются реакции распада и разрушения крупных молекул. Мелкие молекулы более устойчивы к распаду. При добавлении давления некоторые реакции распада можно затормозить и ускорить полимеризацию, конденсацию молекул. На этом принципе основаны химические процессы термической переработки нефти. Если нефть – это в первую очередь топливо, то наша задача увеличить выход топливных фракций из нефти. Как лучше всего это сделать? Нужно выделить из нефти топливные фракции, а из нефтяного остатка попытаться получить дополнительное количество топлив. То есть если нефтяные смолы это тоже углеводороды, но высокомолекулярные и конденсированные, нужно провести разрушение молекул смол до легких бензиновых углеводородов. Для реализации термических процессов надо изучать как сами процессы, чтобы правильно подобрать условия их проведения, так и свойства и устойчивость отдельных компонентов нефти. Исследования показывают: Повышение температуры выше 350-400°С начинает вызывать температурный распад С-Н и С-С связей С повышением температуры устойчивость алканов и циклоалканов падает быстро, а у аренов и алкенов – медленно. Следовательно при нагревании нефтяных остатков образующийся дополнительно бензин и ДТ будут высоко ароматическими При нагреве реакции неустойчивых алканов могут сдвинуться в сторону глубокого разрушения до элементов, то есть может увеличиться продукция коксования и газообразования – метана, алкенов С2-4, водорода. Если целью процесса является получение алканов или алкенов, то реакцию нужно остановить в момент их наибольшей концентрации и вывести их из зоны реакции. Именно такой подход и положен в технологии переработки нефти. Практически все процессы глубокой переработки нефти – это высоко термические процессы, так как нам необходимо тяжелые нефтяные остатки переработать в легкое углеводородное топливо или легкие углеводороды, которые пойдут на производство полимеров, смол, реагентов для химического синтеза. Кинетика и механизм термического превращения углеводородов Термические реакции углеводородов протекают в основном по радикально-цепному механизму. Цепной механизм это по кинетике очень быстрый, взрывной процесс, для которого характерны несколько стадий: инициирование цепи, продолжение цепи, обрыв цепи. Инициирование цепи – распад молекул по наиболее слабой связи. Энергия С-Н связей выше, чем С-С (410 и 360 КДж/моль), поэтому распад происходит преимущественно углеродной цепи. В алканах с длинной цепью энергия связей перераспределяется: СН3 – СН2 – СН2 – СН2 – СН2 – СН2 – СН2 – СН3 Энергия связей кДж/моль: С – С 335 322 314 310 314 322 335 С – Н 394 373 364 360 360 364 373 394 Понятно, что с повышением температуры разрыв связей будет происходить посередине. У циклоалканов С-С связи менее прочные: в циклогексане на 8 кДж/моль, а в циклопентане на 25 кДж/моль. В алкенах связи С=С намного прочнее, чем С-С, а в β-положении к двойной связи сильно ослаблены: H H 373| |321 R – CH2 – CH2 ------ C -------C---------CH=CH2. 334 | 259 | 371 H H В ароматических ядрах связи С-С очень прочные, но ослабляются связи в заместителях. В молекуле 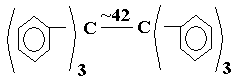 энергия диссоциации связи С-С очень мала. При разрушении самых ослабленных связей возникают свободные радикалы СН3 •/• СН3 2CH3• , которые очень активны по своей природе. Это химически ненасыщенные частицы, стабильность их зависит от их строения. Чем менее стабильна частица, тем более реакционно способна. То есть начинается образование радикальной цепи. Продолжение радикальной цепи. Радикалы стремятся восстановить свою электронную структуру и мступают в реакции: Замещения R• + R`H RH + R`• ± Q Распада с образованием новых радикалов СН3 – СН• – СН2 – СН3 СН3 – СН• – СН2 •|• СН3 [СН3 – СН• – СН2 •] + СН3• СН3 – СН = СН2 + СН3• Присоединения по кратной связи R• + R`СH=СН2 RCH2C•HR` Изомеризации, когда неспаренный электрон перемещается в более устойчивое положение СН3 – СН2 – СН2 – СН2 – СН2 – СН2• СН3 – СН2 – СН• – СН2 – СН2 – СН3 Обрыв цепи Обрыв происходит также по нескольким направлениям: Рекомбинация радикалов 2С2Н5` С4Н10 (бутан) Диспропорционирование радикалов 2С2Н5` С2Н6 (этан) + C2Н4(этилен) Превращения циклоалканов и аренов по радикально-цепному механизму тоже происходят, но не так интенсивно, потому что цикл – более устойчивое молекулярное образование, чем цепь.
При распаде цикланов (циклоалканов) образуются преимущественно алкены: | СН2=СНСН2СН2СН2СН3 У аренов кольцо в основном сохраняется, но значительны реакции конденсации и отрыва заместителей: 2С6Н6 С6Н5—С6Н5 + Н2 С6Н5— СН2—СН2СН3 С6Н5— СН2∙ + ∙СН2СН3 В настоящее время схемы реакций и получаемых продуктах при различных температурах и давлениях процесса известны для большинства молекул нефтяных топлив. Для молекул нефтяных остатков эти процессы изучаются и пытаются найти лучшие условия для выработки дополнительных порций топливных фракций. Почти все известные реакции – это процессы протекающие в газовой фазе, когда прямая перегонка продукции из нефти закончена, а нагрев нефтяного остатка продолжают, то есть это температуры выше 5000С. И такой процесс называется КРЕКИНГОМ, если протекает при температуре 470-540°С или ПИРОЛИЗ – температуры 700-1000°С Иногда эти процессы проводят в жидкостной фазе. Концентрация молекул в жидкости на 2 порядка выше и эффект получается такой же как если бы мы проводили реакция в газе, но под давлением 10 МПа (100 атм). Образующиеся в жидкости радикалы обычно не разлетаются, а быстро находят себе пару и молекулы удлиняются. В результате при одних и тех же температурах в жидкой фазе имеется больший выход продуктов конденсации и меньший – продуктов распада. Эти механизмы настолько хорошо изучены, что мы можем целенаправленно превращать не только нефть, но топливные фракции (бензин) в нужный набор молекул – это уже будет нефтехимический синтез: - если целевым назначением термического процесса является получение алкенов, то реакцию необходимо проводить при высокой температуре с дополнительным удалением водорода и образованием непредельных углеводородов, но не выше 900°С, чтобы не начались реакции распада до элементов; - для газообразных алкенов нужно реакцию проводить при пониженном давлении или с добавкой инертного газа (для понижения концентрации углеводородов); - есть процессы специально разработанные для производства нефтяного углерода – кокса. Нефтяной кокс обычно образуется в жидкофазных термических процессах. Это твердое вещество плотностью 1,4-1,5 г/см3 с содержанием С:Н около 1,1:4 (почти как в метане). Обычно в жидкофазном термическом процессе коксованию подвергаются арены, и частично алканы и циклоалканы, но после их ароматизации: Арены Смолы Асфальтены Кокс Графит По пространственному строению кокс близок плоскоупорядоченной структуре асфальтенов. Наличие водорода не дает нефтяному коксу перейти в слоисто-столбчатую структуру графита. Такой продукт очень ценен для производства мягкого графита (при температуре 1200-1500°С) для атомных реакторов, или для автомобильных покрышек… Сырьем для получения кокса служат тяжелые нефтяные остатки. Температура процесса коксования 400-500°С. Высокомолекулярные парафины, которые есть в нефтяном остатке, крекируются до жидких и газообразных продуктов и мы получаем дополнительный бензин и газы пиролиза. Часть смол также крекируется до бензиновых и газообразных веществ, а ароматические, часть смол и асфальтены разлагаются с образованием бензина пиролиза, газов пиролиза и кокса. Промышленные процессы термической переработки нефти и нефтяных фракций Термический крекинг. (500-6000С) С 1912 г. Первоначально с его помощью получали автомобильный бензин. Получаемый бензин высокооктановый и высокоароматический. И из-за возросших требований к бензолу сейчас он заменен на каталитический крекинг. Сейчас термический крекинг используют для переработки нефтяных остатков в вакуумный газойль и маловязкое котельное топливо – мазут крекинга. То есть глубокий крекинг не проводят, а только с его помощью немного расщепляют молекулы смол, чтобы снизить вязкость остатков. Этот процесс называется «висбрекинг» или легкий крекинг (450-480°С и 2-5 МПа) – перспективный процесс глубокой переработки нефти, позволяющие увеличить выход ДТ, вакуумного газойля и котельного топлива без применения разбавителей. 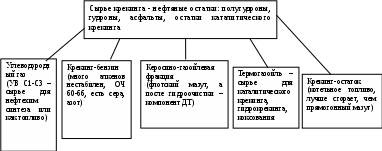 П 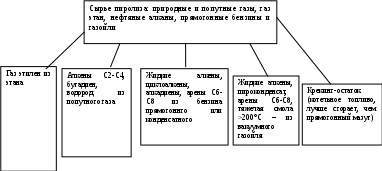 иролиз. (800-900°С, атм. давление или чуть выше, для снижения концентрации УВ иногда в реактор добавляют водяной пар) Основное назначение процесса – получение низших алкенов. иролиз. (800-900°С, атм. давление или чуть выше, для снижения концентрации УВ иногда в реактор добавляют водяной пар) Основное назначение процесса – получение низших алкенов. Коксование. (490-505°С, 0,2-0,3 МПа) Назначение процесса – получение нефтяного кокса и широкого фракционного дистиллята. Сырье – отбензиненные нефти, остатки первичной переработки: мазуты, полугудроны, остатки вторичной переработки: крекинг-остатки, смолы пиролиза, природные остатки, экстракты и др. Продукты – газ, бензин. Средние и тяжелые коксовые дистилляты, кокс. Вид и выход продуктов зависит от исходного сырья и условий коксования (периодическое, полунепрерывное, замедленное в необогреваемых колоннах, в псевдоожиженном коксовом слое и т.п. Выход кокса из остатков первичной переработки нефти – 15-25 %, из вторичных продуктов – 30-35%. Все побочные продукты ценные, так как имеют характеристику продуктов термического крекинга. |
