Лабораторная. Исследование электролитической диссоциации и реакций в растворах электролитов
 Скачать 172.02 Kb. Скачать 172.02 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «НАЦИОНАЛЬНЫЙ МИНЕРАЛЬНО-СЫРЬЕВОЙ УНИВЕРСИТЕТ «ГОРНЫЙ» Кафедра физической химии Лабораторная работа №2 По дисциплине: ХИМИЯ Тема: Исследование электролитической диссоциации и реакций в растворах электролитов Автор: студент группы ТПР-14 ___________/ (подпись) (Ф.И.О.) ОЦЕНКА: ____________ Дата: ________________ Проверил: доцент кафедры ФХ ___________/ Жадовский И.Т/ (подпись) (Ф.И.О.) Цель работы: ознакомиться с практическими выводами теории электролитической диссоциации, с реакциями в растворах электролитов и научиться составлять их уравнения. Общие сведения. Электролитической диссоциацией называется процесс распада молекул электролитов на ионы под действием полярных молекул растворителя.Количественно способность электролита распадаться на ионы характеризуется степенью диссоциации 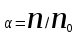 , ,где n – число продиссоциированных молей, n 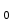 - исходное число молей электролита. - исходное число молей электролита.Процесс диссоциации обратимый, он приводит к равновесию между недиссоциированными молекулами и ионами и, следовательно, должен подчиняться закону действующих масс. Вещество АВ при растворении в воде диссоциирует по уравнению АВ 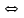 А А + В + В При постоянной температуре произведение концентраций конечных и исходных веществ постоянно и называется константой диссоциации К 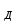 = = 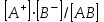 , ,где множители – концентрации ионов и молекул электролита в растворе, моль/л или моль/кг. По степени и величине константы диссоциации все электролиты принято условно делить на сильные и слабые. Сильные электролиты в растворе диссоциируютпрактически полностью, слабые – частично. Закон действующих масс справедлив лишь для слабых электролитов. К сильным относятся: Кислоты: азотную HNO 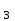 , серную H , серную H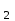 SO SO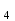 ,солянуюHCL, бромисто - и йодистоводородную HBr и HJ,хлорную HCLO ,солянуюHCL, бромисто - и йодистоводородную HBr и HJ,хлорную HCLO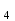 . .Гидроксиды щелочных металлов, стронция и бария. Растворимые соли. Остальные электролиты являются слабыми. Малодиссоциированными соединениями являются также комплексные ионы в растворе. Константы их диссоциации даны в справочниках. Правила написания молекулярно-ионных уравнений реакций в растворах электролитов: 1. Сильные и хорошо растворимые электролиты записывают в диссоциированной форме, виде отдельных составляющих ионов. Слабые электролиты, сложные ионы, в том числе и комплексные, а также малорастворимые соединения и газы записывают в молекулярной, недиссоциированной форме. Одинаковые ионы в левой и правой частях уравнения сокращают, подобно алгебраическим уравнениям. Отсюда вытекают условия протекания реакций в растворах электролитов: Образование или растворение малорастворимого соединения, выпадающего в осадок. Растворимость соединений определяют по таблицам. Образование или разрушение малодисоциированного соединения, иона или комплекса. Выделение или растворения газа. Пример написания уравнения реакции: а. CaCl 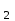 + 2AgNO + 2AgNO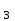 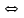 2AgCl + Ca(NO 2AgCl + Ca(NO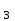 ) )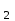 Порядок выполнения работы: Опыт 1. Образование малорастворимых оснований.  FeCl FeCl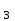 + 2KOH = Fe(OH)3 + 2KOH = Fe(OH)3 + KCl + KClбурый осадок Fe3+ + 3OH- = Fe(OH)3   CuSO4 + 2KOH = Cu(OH)2 CuSO4 + 2KOH = Cu(OH)2 + K2SO4 + K2SO4сине-голубой осадок Cu2+ + 2OH- = Cu(OH)2   NiSO4 + 2KOH= Ni(OH)2 NiSO4 + 2KOH= Ni(OH)2 + K2SO4 + K2SO4 светло-зелёый осадок Ni2+ + 2OH- = Ni(OH)2  Вывод: реакция получилась, т.к. образовались малорастворимые основания и слабые электролиты. Опыт 2.Растворение малорастворимых оснований.  Fe(OH)3 Fe(OH)3 + 3HCl = FeCl + 3HCl = FeCl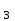 + 3H2O + 3H2Oжелтоватый раствор Fe(OH)3  + 3H+ = Fe3+ + 3H2O + 3H+ = Fe3+ + 3H2O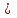 Cu(OH)2 Cu(OH)2 + 2HCl = CuCl2 + 2 H2O + 2HCl = CuCl2 + 2 H2Oсветло-голубой раствор Cu(OH)2  + 2H+ = Сu2+ + 2 H2O + 2H+ = Сu2+ + 2 H2O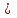 Ni(OH)2 Ni(OH)2 + 2HCl = NiCl2 + 2H2O + 2HCl = NiCl2 + 2H2Oпрозрачный раствор Ni(OH)2  + 2H+ = Ni2+ + 2H2O + 2H+ = Ni2+ + 2H2OВывод:растворились в кислоте потому, что образовался ещё более слабый электролит. Опыт 3.Oбразование малорастворимых солей. 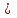 Pb(NO3)2 + 2KJ = PbJ2 Pb(NO3)2 + 2KJ = PbJ2  + 2KNO3 + 2KNO3жёлтый осадок Pb2+ + 2J-= PbJ2  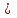 3Pb(NO3)2 + 2FeCl 3Pb(NO3)2 + 2FeCl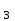 = 3PbCl2 = 3PbCl2 + 2Fe(NO3)3 + 2Fe(NO3)3белый осадок Pb2+ + 2Cl- = 3PbCl2  Вывод:реакции идут, т.к. образуются малорастворимые в воде вещества. Опыт 4.Изучение свойств амфотерных гидроксидов. Cr2(SO4)3 + NaOH = 2Cr(OH)3  +3Na2SO4 +3Na2SO4Добавляем по каплям до образования осадка. Cr3+ + 3OH-= Cr(OH)3  Cr(OH)3  +3HCl = CrCl3 +3H2O +3HCl = CrCl3 +3H2Oсветло-синий раствор Cr(OH)3  +3H+ = Cr3+ 3H2O +3H+ = Cr3+ 3H2Oб) Cr(OH)3  + NaOH(избыток) = Na+[Cr3+(OH)4-] + NaOH(избыток) = Na+[Cr3+(OH)4-] зелёный раствор Вывод:в кислой среде реагирует как основание, а в щелочной как кислота.Опыт 5.Образование малодиссоциированных соединений. NH4Cl + NaOH = NH4OH + NaCl Бесцветный раствор с запахом аммиака NH4+ + OH- = NH4OH 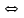 NH3+ H2O NH3+ H2OВывод:реакция идёт, т.к. образуется вода и выделяется газ- аммиак в результате разложения гидроксида аммония. Опыт 6.Образование комплексов. CuSO4 + NH3 = [Cu(NH3)]SO4 ярко-синий раствор [Cu(NH3)4] + SO42- 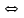 [ Cu(NH3)4]SO4 [ Cu(NH3)4]SO4Опыт 7.Образование газов. Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 Бесцветный раствор, активное выделение газа CO32-+2H+ = CO2 + H2O Na2S + H2SO4 =H2S + Na2SO4 Выпал белый осадок, появился неприятный запах S2+ + 2H- = H2S Вывод:неустойчиво, т.к. образуется слабый электролит. Вывод: В ходе лабораторной работы ознакомились с практическими выводами теории электролитической диссоциации, с реакциями в растворах малорастворимых оснований, изучили свойства амфотерных гидроксидов, образование малодиссоциированных соединений, комплексных соединений и газов. Санкт-Петербург 2014 |
