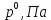Контрольная работа 3 По дисциплине Физическая химия Студента группы 21хт зуева Ивана Шифр зачетки 2111480103007 Номер
 Скачать 4.08 Mb. Скачать 4.08 Mb.
|
|
Внеаудиторная контрольная работа №3 По дисциплине Физическая химия Студента группы 21-ХТ Зуева Ивана Шифр зачетки 2111480103007 Номер варианта 7 Задание №1 При температуре Т, К давление пара раствора с массовой долей 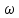 =18 % неизвестного нелетучего вещества в жидком растворителе равно р=60000 Па, плотность этого раствора (d) см. в таблице 5. Зависимость давления насыщенного пара от температуры над жидким и твердым чистым растворителем приведена в таблице 4 (см. предыдущее условие задачи 4): =18 % неизвестного нелетучего вещества в жидком растворителе равно р=60000 Па, плотность этого раствора (d) см. в таблице 5. Зависимость давления насыщенного пара от температуры над жидким и твердым чистым растворителем приведена в таблице 4 (см. предыдущее условие задачи 4):1) Вычислить молярную массу растворенного вещества М; 2) Определить молярную и моляльную концентрации раствора; 3) Вычислить осмотическое давление раствора; 4) Построить кривую р=f(Т) для данного раствора и растворителя; 5) Определить графически температуру, при которой давление пара над чистым растворителем будет равно р, Па; 6) Определить графически повышение температуры кипения при давлении Р раствора данной концентрации С; 7) Вычислить эбулиоскопическую постоянную всеми возможными спосо- бами и сравнить эти величины между собой при нормальной темпера- туре кипения; 8) Определить понижение температуры замерзания раствора; 9) Вычислить криоскопическую постоянную. Расчетные данные: 1) Из ВКР №2 2) Из ВКР №3    Решение 1) Вычислить молярную массу растворенного вещества М. Согласно закону Рауля для нелетучего вещества  , где , где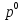 – давление пара над чистым растворителем; р – давление пара над раствором данной концентрации; – давление пара над чистым растворителем; р – давление пара над раствором данной концентрации;  – число моль растворителя и растворенного вещества соответственно. – число моль растворителя и растворенного вещества соответственно.Так как согласно условию массовая доля растворенного вещества 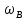 =18 %, следовательно в 100 г раствора содержится 18 г ( =18 %, следовательно в 100 г раствора содержится 18 г (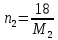 ) растворенного вещества и 82 г ( ) растворенного вещества и 82 г (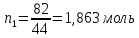 ) растворителя. Численное значение для давления пара над чистым растворителем ( ) растворителя. Численное значение для давления пара над чистым растворителем (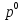 ) возьмем из условия задания внеаудиторной контрольной работы №2: При ) возьмем из условия задания внеаудиторной контрольной работы №2: При  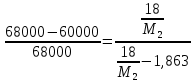  2) Определение молярной и моляльной концентраций раствора. А) Молярная концентрация. 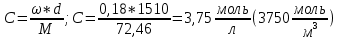 Б) Моляльная концентрация. 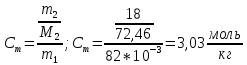 3) Вычисление осмотического давления раствора. 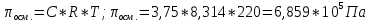 4) Строим кривую р=f(Т) для данного раствора и растворителя. 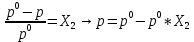 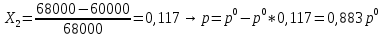 Исходя из полученной зависимости строим таблицу данных для построения графика.
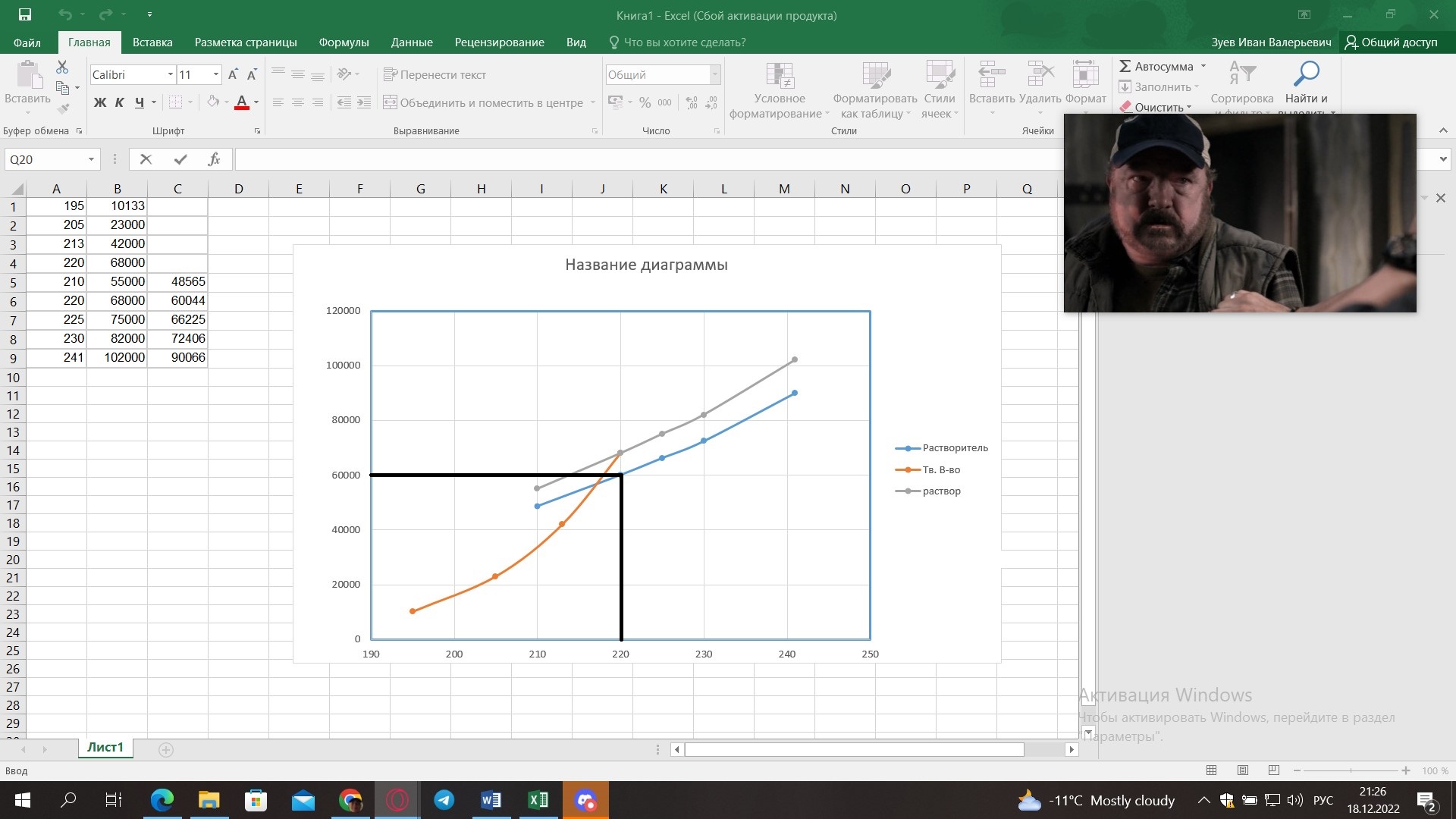 5) Определить графически температуру, при которой давление пара над чистым растворителем будет равно р, Па. По полученным данным мы получаем, что при p=60000, T=220K 6) Определяем графически повышение температуры кипения при давлении р= 60000 Па раствора данной концентрации = 0,18 из графика: Тк = 7 К. 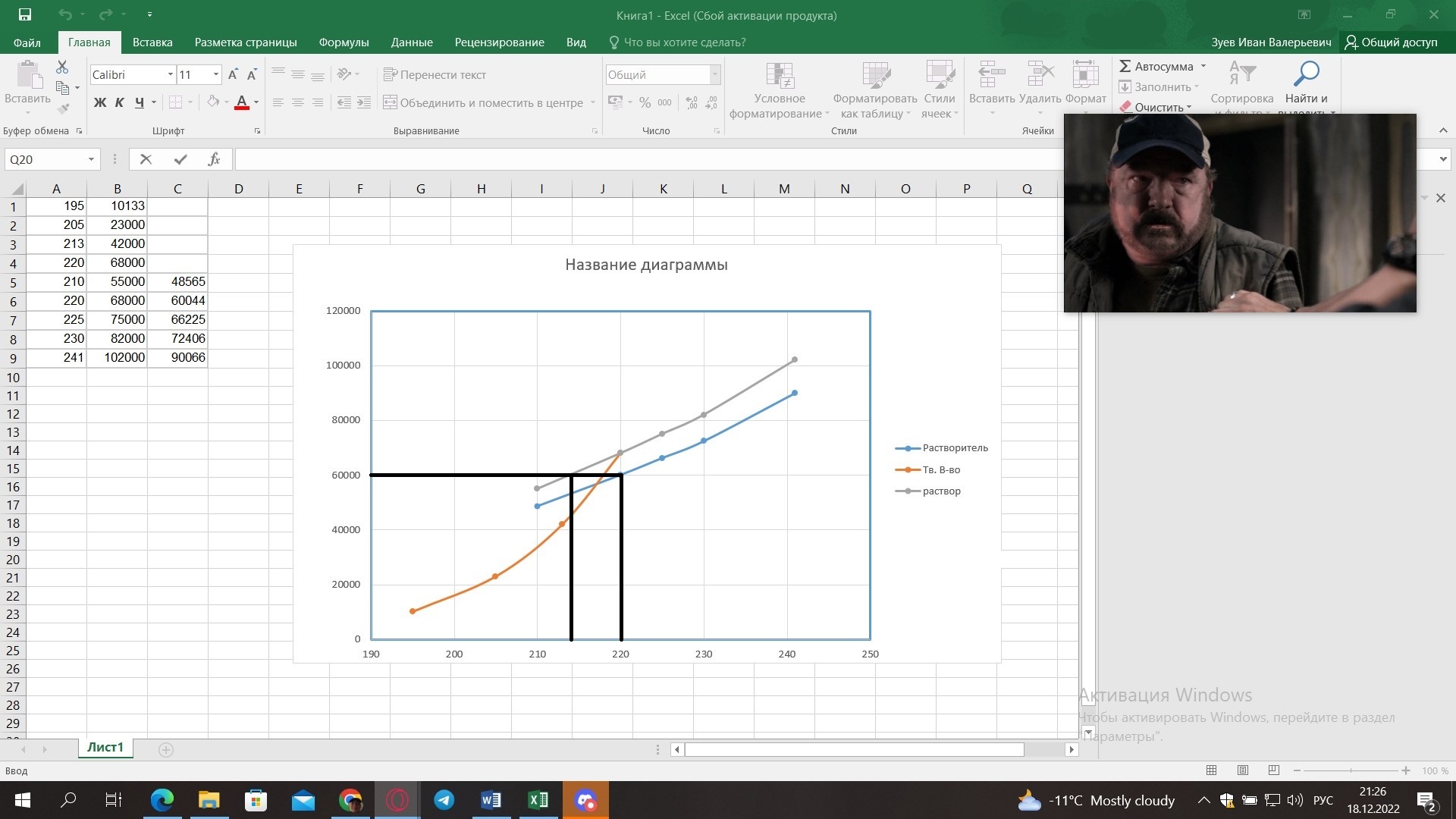 7) Вычисляем эбуллиоскопическую постоянную всеми возможными способами при нормальной температуре кипения. 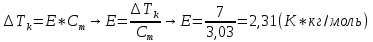  8) Определяем графически понижение температуры замерзания раствора из графика: T3 = 3 К.   9) Вычисляем криоскопическую постоянную всеми возможными способами при нормальной температуре кипения: 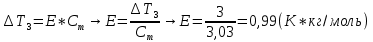  Задание №2 Дана зависимость состава (%, мольные) пара жидкой (х) и газообраз- ной (у) фаз от температуры (Т) для бинарной жидкой системы при посто- янном давлении Р. 1) Построить график зависимости состава пара от состава жидкости при Р = const; 2) Построить график зависимости температура кипения – состав; 3) Определить температуру кипения системы, содержащей а % (масс.) компонента А; каков состав первого пузырька пара; при какой темпера- туре исчезнет последняя капля жидкости и каков ее состав; 4) Определить состав пара, находящегося в равновесии с жидкой системой, кипящей при Т1; 5) Какой компонент и в каком количестве может быть выделен из системы, состоящей из б кг вещества А и в кг вещества В? 6) Какое количество и какого компонента надо добавить к смеси, указан- ной в п. 5, чтобы получилась азеотропная смесь? 7) Какое количество вещества А (кг) будет в парах и в жидкой фазе, если 2 кг смеси, содержащей а % вещества А, нагреть до температуры Т1? 8) Определить вариантность системы в азеотропной точке. 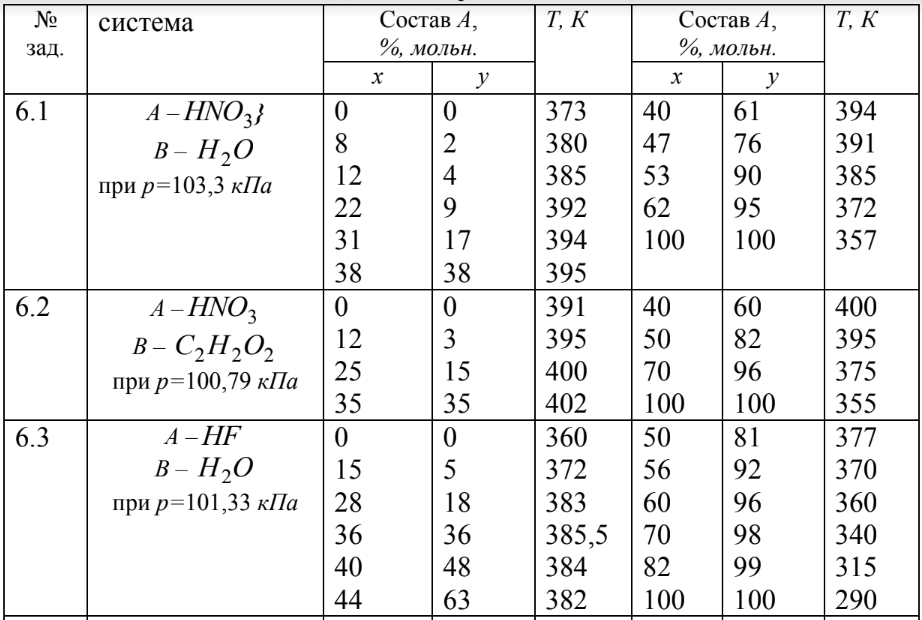 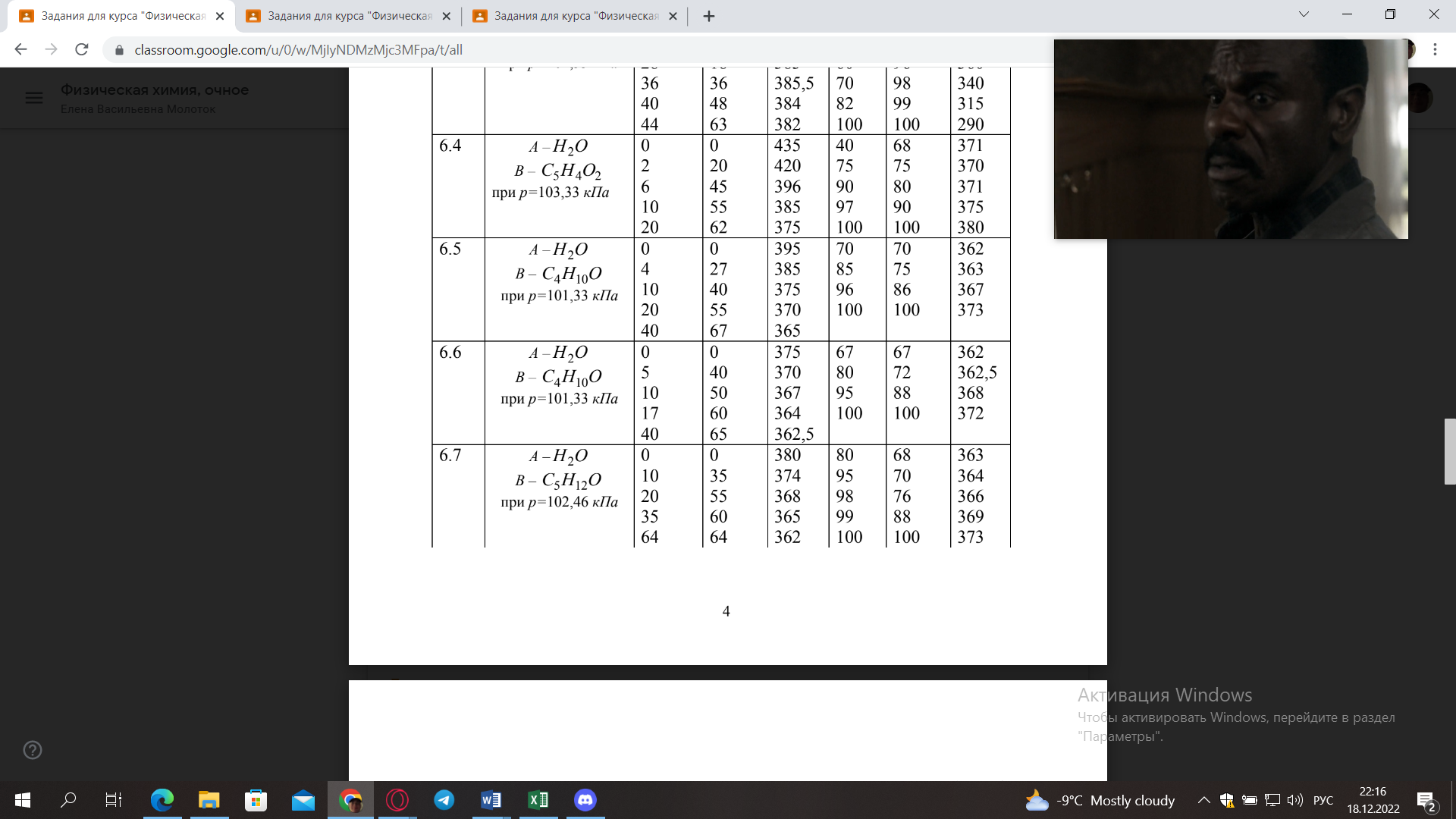 Решение: 1) Строим график зависимости состава пара от состава жидкости при Р = const системы H2𝑂 – C5 H12𝑂 Координаты точки пересечения кривой с диагональю являются координатами азеотропной точки для данной системы.   P=const 2) Строим график зависимости температура кипения – состав системы H2𝑂 – C5 H12𝑂. 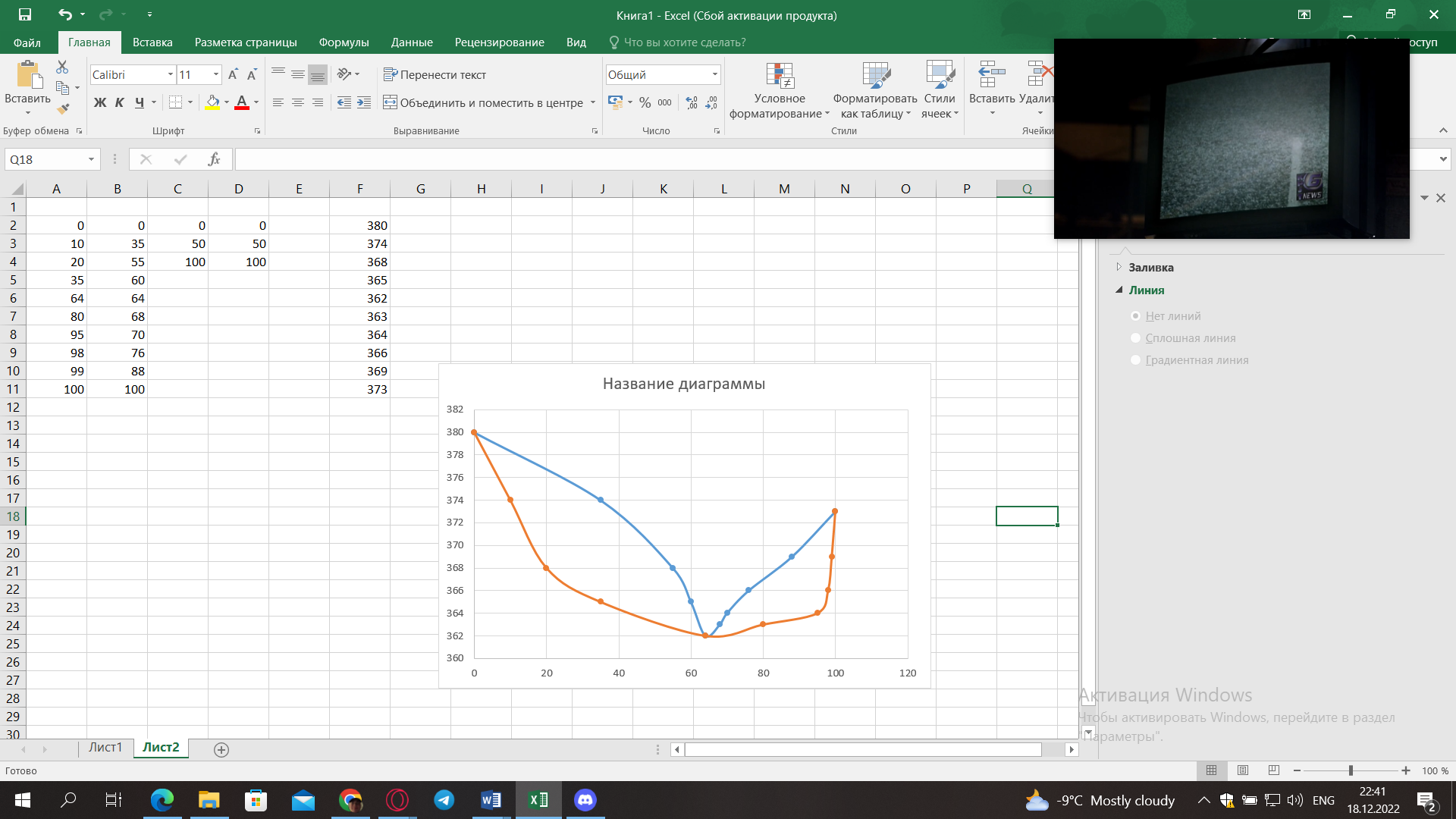 3) Определим: • температуру кипения системы, содержащей 40 % (масс.) компонента H2𝑂: для графического определения интервала температуры кипения данной системы необходимо, чтобы состав системы был выражен в мольных долях, поэтому предварительно переведем массовые доли компонента H2𝑂, приведенные в условии задачи, в мольные доли, используя следующую формулу.   Согласно графику, система, содержащая 76,5% 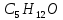 , кипит в интервале температур Tк=361,9…365,9 К. , кипит в интервале температур Tк=361,9…365,9 К.      состав первого пузырька пара рассчитанный состав системы состав последней капли жидкости  А) Определим графически состав первого пузырька пара: при температуре 361,9 К: 66% 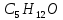 . . Б) Определим графически, при какой температуре исчезнет последняя капля жидкости и ее состав: при температуре 365,5 К: 98% 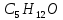 . .4) Определим состав пара, находящегося в равновесии с жидкой системой, кипящей при 368 К: Как следует из графика, в равновесии с жидкой системой, кипящей при температуре 368 К, находятся два состава пара: 1) 20 % 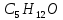 и 2) 97 % и 2) 97 %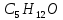 . . 5) Определим, какой компонент, и в каком количестве может быть выделен из системы, содержащей 6,4 кг вещества H2𝑂 и 93,6 кг вещества C5 H12𝑂. Для того чтобы определить, какой компонент может быть выделен из системы соответствующего состава, необходимо знать мольный состав системы. Расчет мольного состава смеси можно сделать по формуле:  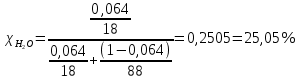 В данном случае имеем азеотроп с минимумом температуры кипения. Состав азеотропа: 36% 𝐻𝐹и 64 %H2O. Имеющийся состав системы, содержащей 2505%  , находится справа от азеотропной точки, поэтому фракционированная перегонка или ректификация раствора данного состава приведет к концентрированию в остатке компонента , находится справа от азеотропной точки, поэтому фракционированная перегонка или ректификация раствора данного состава приведет к концентрированию в остатке компонента , а в конденсате будет азеотропный раствор. , а в конденсате будет азеотропный раствор.Способы определения количества выделенного компонента: а) так как данную систему можно разделить на чистый компонент  и азеотроп, то все количество и азеотроп, то все количество 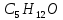 перейдет в азеотроп, в котором его мольное содержание составляет %, а остальные % в азеотропе приходятся на nаз кмоль компонента перейдет в азеотроп, в котором его мольное содержание составляет %, а остальные % в азеотропе приходятся на nаз кмоль компонента  , т.е. можно записать: , т.е. можно записать: | ||||||||||||||||||||||||||||||||||||||||