ХИМИЯ РЕФЕРАТ. Контрольная работа по дисциплине химия Вопросы 2, 6, 11, 22,26, 29, 33, 36, 37, 42
 Скачать 328.97 Kb. Скачать 328.97 Kb.
|
|
Министерство науки и высшего образования РФ Федеральное бюджетное образовательное учреждение высшего образования «Омский государственный технический университет» Кафедра «Химия» КОНТРОЛЬНАЯ РАБОТА по дисциплине: «ХИМИЯ» Вопросы № 2, 6, 11, 22,26, 29, 33, 36, 37, 42 Выполнил: студентка 1 курса, гр. ЗЭ-184 Рук А.В. Проверил: Омск 2019 СОДЕРЖАНИЕ 2. Строение атома……………………………………………………………………..3 6. Виды химических связей…………………………………………………………..4 11. Основные классы неорганических соединений; кислоты, основание и соли….8 22. Энергия Гиббса…………………………………………………………………..10 26. Обратимые химические реакции. Химическое равновесие…………………..12 29. Водные растворы. Способы выражения состава растворов…………………..13 33. Гидролиз солей……………………………………………………………..……15 36. Перегонка жидких смесей. Ректификация……………………………………..16 37. Электродные потенциалы. Электродвижущие силы………………………….18 42. Электролиз……………………………………………………………………….19 2. Строение атома. Атом представляет собой электронейтральную частицу, состоящую из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов. Каждый атом имеет свой заряд ядра. Совокупность одинаковых атомов, имеющих один и тот же заряд ядра, называют химическим элементом. Каждый химический элемент имеет свой символ и порядковый номер, соответствующий заряду его ядра. Каждый химический элемент занимает своё место в Периодической системе химических элементов Д.И. Менделеева. В свободном состоянии химические элементы находятся в виде простых веществ. До конца 19 века атом считался неделимым. Затем по мере накопления опытных данных пришлось отказаться от таких взглядов и признать, что атомы имеют сложное строение. Для объяснения опытных данных по рассеянию  - частиц Э. Резерфорд предложил ядерную модель атома. Согласно этой модели атом состоит из массивного положительно заряженного ядра, при этом очень малого по размерам. В ядре сосредоточена почти вся масса атома. Вокруг ядра на значительном расстоянии от него вращаются электроны, образующие электронную оболочку атома. - частиц Э. Резерфорд предложил ядерную модель атома. Согласно этой модели атом состоит из массивного положительно заряженного ядра, при этом очень малого по размерам. В ядре сосредоточена почти вся масса атома. Вокруг ядра на значительном расстоянии от него вращаются электроны, образующие электронную оболочку атома. Размер всего атома составляет около 10-8 см, ядра – порядка 10-13 см. По размеру ядро примерно в 100000 раз меньше атома. Поскольку атом в целом электронейтрален, то суммарный заряд электронов должен быть равен заряду ядра. Дальнейшие исследования показали, что положительный заряд ядра атома численно равен порядковому номеру элемента в периодической системе Д.И. Менделеева. Таким образом, число положительных зарядов ядра каждого атома, а также число вращающихся в поле ядра электронов равны порядковому номеру элемента. Порядковый номер атома титана равен 22. Значит, его положительный заряд равен 22 и в поле ядра вращаются 22 электрона. При химических реакциях ядро атома не претерпевает изменений. Изменению подвергаются электронные оболочки атомов, строением которых объясняются многие свойства химических элементов. Поэтому состояние электронов в атоме определяет многие свойства. Электрон – это очень маленькая частица, для которой законы классической механики не выполняются. Такая частица не имеет траектории, обладает волновыми свойствами. Для её характеристики требуется привлечение других понятий. Состояние электронов в атоме описывается квантовой механикой. 6. Виды химических связей. В химии различают следующие типы связей: ковалентная, ионная, металлическая, водородная связь, связь Ван-дер-Ваальса, донорно-акцепторная связь, дативная связь. Ковалентная связь При образовании ковалентной связи атомы делятся друг с другом электронами. Примером ковалентной связи является химическая связь в молекуле Cl2. Впервые Льюис (1916 г.) предположил, что в такой связи каждый из двух атомов хлора делится одним из своих внешних электронов с другим атомом хлора. Для перекрывания атомных орбиталей два атома должны подойти друг к другу как можно ближе. Общая пара электронов образует ковалентную связь. Эти электроны занимают одну и туже орбиталь, а их спины направлены в противоположные стороны. Таким образом, ковалентная связь осуществляется обобществлением электронов от разных атомов в результате спаривания электронов с противоположными спинами. Ковалентная связь является широко распространенным типом связи. Она может возникать не только в молекулах, но и кристаллах. Она возникает между одинаковыми атомами (в молекулах Н2, Cl2, алмазе) и между разными атомами (в молекулах Н2О, NH3). Ковалентную связь изображают по-разному: С помощью электронов в виде точек. В этом случае образование молекулы водорода показывают схемой: Н∙ + Н∙ → Н : Н С помощью квадратных ячеек (орбиталей), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке  Изображают чертой. Например, Н – Н. эта черта символизирует пару электронов. Если между атомами возникла одна ковалентная связь, то она называется одинарной, если больше, то кратной двойной, тройной. Одинарная связь изображается одной чертой, двойная – двумя, тройная – тремя. Черточка между атомами показывает, что у них пара электронов обобщена. В зависимости от направления перекрывания электронных облаков различают σ-, π-, δ-связи. σ-связь возникает при перекрывании электронных облаков вдоль оси, соединяющей ядра взаимодействующих атомов. Пример образования σ-связи при перекрывании s-s-облаков наблюдается в молекуле водорода. π-связь осуществляется при перекрывании электронных облаков по обе стороны от оси, соединяющий ядра атомов. δ-связь менее прочная, чем π-связь, а π-связь менее прочная чем σ-связь. Свойства ковалентной связи: а) Полярность. Различают две разновидности: неполярную и полярную. б) Насыщаемость. в) Направленность и гибридизация ковалентной связи. Ионная связь Ионная связь представляет собой электростатическую силу притяжения между ионами с зарядами противоположного знака + и −. Представление об ионной связи сформировалось на основе идей В. Косселя. Он предположил (1916 г.), что при взаимодействии двух атомов один из них отдает, а другой принимает электроны. Таким образом, ионная связь образуется в результате переноса одного или нескольких электронов от одного атома к другому. Наиболее типичные ионные соединения состоят из катионов металлов, принадлежащих к I и II группам периодической системы, и анионов неметаллических элементов, принадлежащих к VI и VII группам. Легкость образования ионного соединения зависит от легкости образования входящих в него катионов и анионов. Легкость образования тем выше, чем меньшую энергию ионизации имеет атом, отдающий электроны (донор электронов), а атом, присоединяющий электроны (акцептор электронов), обладает большим сродством к электрону. Сродство к электрону – это мера способности атома присоединять электрон. Энергия ионизации и сродство к электрону, относятся к газообразным веществам и являются характеристиками атомов и ионов в газообразном состоянии. Но следует иметь в виду, что большинство ионных соединений наиболее устойчивы в твердом состоянии. Данное обстоятельство объясняется существованием у них в твердом состоянии кристаллической решетки. Так как электрическое поле иона имеет сферическую симметрию (рисунок 1), то ионная связь в отличие от ковалентной не обладает направленностью. Взаимодействие двух противоположно заряженных ионов компенсируется силами отталкивания только в направлении, соединяющим центры ядер ионов, в других направлениях компенсация электрических полей ионов не происходит. Поэтому они способны взаимодействовать и с другими ионами. Ионная связь не обладает насыщаемостью. 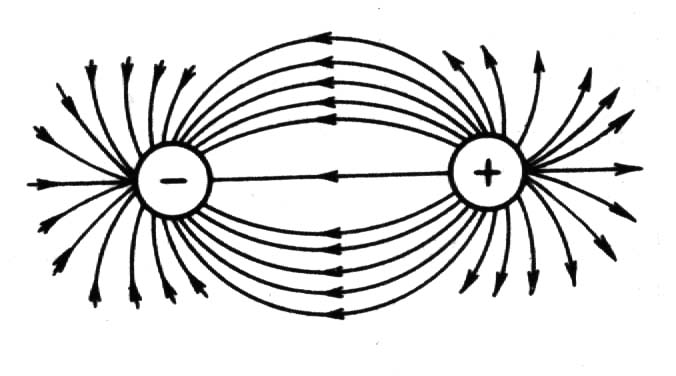 Рисунок 1. Сферическая симметрия электростатического поля разноименнозаряженных зарядов. Вследствие ненаправленности и ненасыщаемости ионной связи энергетически наиболее выгодно, когда каждый ион окружен максимальным числом ионов противоположного знака. Благодаря этому наиболее предпочтительная форма существования ионного соединения – кристалл. Ионную связь можно представить как предельную полярную связь, для которой эффективный заряд атома близок к единице. Для чисто ковалентной неполярной связи эффективный заряд атомов равен нулю. В реальных веществах чисто ионных и чисто ковалентных связей встречается мало. Металлическая связь В атомах металлов внешние валентные электроны удерживаются значительно слабее, чем в атомах неметаллов. Это обуславливает потерю связи электронов с отдельными атомами на достаточно большой промежуток времени и их обобществление. Образуется обобществленный ансамбль из внешних электронов. Существование подобной электронной системы приводит к возникновению сил, которые удерживают положительные ионы металла в сближенном состоянии, несмотря на их одноименную заряженность. Такая связь называется металлической. Подобная связь характерна только для металла и существует в твердом и жидком состоянии вещества. Металлическая связь является одним из видов химической связи. Она основана на обобществлении внешних электронов, которые теряют связь с атомом и поэтому называются свободными электронами (рисунок 2).  Рисунок 2. Металлическая связь. Подтверждением существования металлической связи являются следующие факты. Все металлы имеют высокую теплопроводность и высокую электропроводность, которая обеспечивается за счет наличия свободных электронов. Стабильность кристаллической решетки металлов невозможно объяснить такими видами связи как ионная и ковалентная. Металлические структуры характеризуются тем, что они имеют довольно редкое расположение атомов и большое число ближайших соседей у каждого атома в кристаллической решетке (рисунок 3).  Рисунок 3. Различные типы кристаллической упаковки: а-гексагональная плотная упаковка; б- гранецентрированная кубическая упаковка; в-объёмноцентрированная кубическая упаковка Между металлической и ковалентной связью имеется сходство. Оно заключается в том, что оба типа связи основаны на обобществлении валентных электронов. Однако ковалентная связь соединяет только два соседних атома, и общие электроны находятся в непосредственной близости от соединенных атомов. В металлической связи несколько атомов участвуют в обобществлении валентных электронов. Таким образом, понятие металлической связи неразрывно связано с представлением о металлах как совокупности положительно заряженных ионных остовов с большими промежутками между ионами, заполненными электронным газом, при этом на макроскопическом уровне система остается электрически нейтральной. 11.Основные классы неорганических соединений; кислоты, основание и соли. Неорганические соединения различают по составу: бинарные, многоэлементные и функциональным признакам. К бинарным соединениям относят соединения элементов с кислородом (оксиды), галогенами (галогениды – фториды, хлориды, бромиды, иодиды), халькогенами (халькогениды – сульфиды, селениды, теллуриды), азотом (нитриды), фосфором (фосфиды), углеродом (карбиды), кремнием (силициды), а также соединения металлов друг с другом (интерметаллиды) и водородом (гидриды). Среди многоэлементных соединений выделяют гидроксиды (ОН), производные гидроксидов – соли, а также комплексные соединения, гидраты и кристаллогидраты. В основу систематических .е. нование любого вещества должно однозначно указывать на его состав, поэтому в основу системаи соединений, нные соотношения названий неорганических веществ положены названия элементов, входящих в их состав. Название бинарного соединения образуется из латинского корня наименования более электроотрицательного элемента с окончанием –ид и русского наименования менее электроотрицательного элемента в родительном падеже. При написании формулы вещества менее электроотрицательный элемент стоит левее. Например, AgI – иодид серебра, OF2 – фторид кислорода. Для некоторых элементов корни их русских названий совпадают с корнями латинских, за исключением определенных химических элементов. Для обозначения количественного состава используют греческие числительные в качестве приставки, например, Hg2Cl2 – дихлорид диртути, СО – монооксид углерода. Название многоэлементного соединения отражает его функциональные признаки, такие как принадлежность к гидроксидам или кислотам. Гидрооксиды – это соединения оксидов с водой. Их подразделяют на: основные – проявляющие в химических реакциях свойства оснований; кислотные – проявляющие свойства кислот; амфотерные – способные проявлять как кислотные, так и основные свойства. К классу оснований, согласно теории электролитической диссоциации, относят вещества, способные в водном растворе диссоциировать с образованием гидроксид-ионов ОН: Наименование основного гидроксида (или основания) образовано из слова «гидроксид» и названия элемента в родительном падеже, после которого при необходимости указывают степень окисления элемента. Например, NaOH – гидроксид натрия. Общую формулу основания можно записать как М(ОН)m , где М – металл, m- число гидроксильных групп, или кислотность основания. Вещества, способные диссоциировать в растворе с образованием ионов водорода Н+, в соответствии с теорией электролитической диссоциацией относят к классу кислот. Кислоты в зависимости от наличия в их составе кислорода подразделяются на кислородсодержащие и на безкислородные. В общем случае формулу кислоты можно записать как НnА, где А – кислотный остаток, n – число атомов водорода в молекуле, или основность кислоты. Систематическое название кислоты включает в себя наименование двух частей: электроположительной (атомы водорода) и электроотрицательной (кислотный остаток, анион). В названии аниона вначале указывают атомы кислорода (-оксо-), затем кислотообразующего элемента с добавлением суффикса -ат, далее в скобках абсолютную величину степени окисления этого элемента. Например, H2CO3 – триоксокарбонат (IY) водорода, Н2SO4 – тетраоксосульфат (VI) водорода. При наличии в анионе других атомов название аниона составляют из латинских корней названий соответствующих элементов и соединительной гласной -о- в порядке их размещения в формуле справа налево. Например, H2SO3 (O2) – пероксотриоксосульфат (VI) водорода, Н2SO3S – тиотриоксосульфат (VI) водорода. Традиционное название состоит из двух слов – прилагательного, производного от корня названия кислотообразующего элемента, и слова «кислота», например, Н2SO4 – серная кислота, НNO3 – азотная кислота. Амфотерные гидрооксиды способны диссоциировать в водных растворах как по типу оснований, так и по типу кислот, например,  При взаимодействии с кислотами они проявляют свойства оснований, а при взаимодействии с основаниями – свойства кислот. Соли представляют собой продукты замещения ионов водорода кислоты на металл или гидроксильных групп основания на кислотный остаток. В зависимости от полноты замещения атомов водорода или гидроксильных групп соли подразделяют на средние (или нормальные), например К2SO4, кислые (или гидросоли) например NaHCO3, и основные (или гидроксосоли) например FeOHCl. Различают также двойные соли, образованные двумя металлами и одним кислотным остатком (КАl(SO4)2), и смешанные соли, образованные одним металлом и двумя кислотными остатками (СаСlОСl). Названия солей обусловлены систематическими названиями соответствующих кислот, например, К2SO4 – тетраоксосульфат (VI) калия, NaHCO3 – триоксокарбонат (IY) водорода-натрия, FeOHCl или, точнее, FeClOH – гидрокси-хлорид железа (II). При наличии числовых приставок (1, 2, .) в названии вещества для верного понимания формулы применяют умножение приставки (например, КАl3(SO4)2(OH)6 – гексагидроксид-бис (сульфат) триалюминия-калия). Оксиды в зависимости от характерных функций, выполняемых в химических реакциях, подразделяют на солеобразующи и несолеобразующие. Основные оксиды образуют соли при взаимодействии с кислотами или кислотными оксидами. Им соответствуют основания, так как они их образуют при взаимодействии с водой, например СаО – Са(ОН)2. Кислотные оксиды образуют соли при взаимодействии с основаниями или основными оксидами. Они могут быть получены путем отделения воды от соответствующей кислоты. Поэтому их называют также ангидридами кислот, например SO3 – ангидрид Н2SO4. Гидраты и кристаллогидраты – соединения, содержащие в своем составе воду, например, NH3 ∙ Н2О ∙ Fe2O3, nH2O, СuSO4 ∙ 5Н2О. Как систематические, так и традиционные названия таких соединений начинаются со слова «гидрат» с соответствующей приставкой: NH3 ∙ Н2О – гидрат аммиака, Fe2O3 ∙ nH2O – полигидрат оксида железа (III), СuSO4 ∙ 5Н2О – пентагидрад тетраоксосульфата меди (II), или пентагидрад сульфата меди (II). 22. Энергия Гиббса Обычно в практической химии процессы протекают при постоянном объёме и температуре, либо при постоянном давлении и температуре. Для таких процессов использовать ∆S в качестве критерия равновесия и направления протекания процесса нельзя, так как при их протекании происходит не только увеличение энтропии, но и изменение внутренней энергии. В термодинамике вводятся такие функции, которые отражают влияние на процесс этих двух факторов энергетического и энтропийного. При этом данные функции обладают тем свойством, что знак изменения функции при той или иной реакции является критерием возможности самопроизвольного протекания реакции. Для изотермических реакций, протекающих при постоянном давлении, такой функцией является свободная энергия Гиббса: G = H – T ∙ S. При постоянном давления и температуре (P = const, T = const) изменение свободной энергии Гиббса в ходе реакции будет определяться выражением: ∆G = ∆H – T ∙∆ S При постоянном объёме и температуре характеристической функцией является свободная энергия Гельмгольца, которая определяется как: F = U – T ∙ S а её изменение в ходе процесса выражением: ∆F = ∆U – T ∙∆ S Иногда свободную энергию Гиббса или изобарно – изотермический потенциал обозначают через GР,Т, а свободную энергию Гельмгольца или изохорно-изотермический потенциал через FV,T. F и G являются функциями состояния, так как определяются только через них. Эти функции являются критерием равновесия и направления протекания процесса в системе. Самопроизвольность протекания процесса возможна, если dG ≤ 0; dF ≤ 0 Из этих выражений следует, что энергия Гиббса и энергия Гельмгольца остается постоянной для обратимых процессов и уменьшается для необратимых. Равновесие в системе описывается выражением: dGP,T = 0 то есть в состоянии равновесия при постоянном давлении и температуре функция G имеет минимум. Аналогично для равновесия в системе при постоянных V и Т: dFV,T = 0 то есть в состоянии равновесия при постоянном объёме и температуре функция F имеет минимум. 26. Обратимые и необратимые реакции. Химическое равновесие. Все химические реакции разделяют на две группы: обратимые и необратимые. Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакция считается необратимой. Она протекает до конца. К необратимым относят реакции между веществами, в результате которых образуются осадки, газы, и малодиссоциирующие вещества. Обратимые реакции протекают не до конца. В них ни одно из реагирующих веществ не расходуется полностью. Необратимая реакция может протекать только в одном направлении. Обратимая реакция может протекать как в прямом, так и в обратном направлении. Примером необратимой реакции является взаимодействие цинка с концентрированной азотной кислотой: Zn + 4HNO3 → Zn(NO3)2 + 2NO2↑ + 2H2O Данная реакция не может протекать в обратном направлении. Примером обратимой реакции является синтез аммиака: N2+3H2 ↔ 2NH3 Реакция может протекать как в прямом так и в обратном направлении. Реакцию, протекающую слева направо, называют прямой, а протекающей справа налево – обратной. Если в системе скорость прямой реакции  пр равна скорости обратной реакции пр равна скорости обратной реакции  обр, то такое состояние называется химическим равновесием. На рис. 4 показано изменение скоростей прямой ( обр, то такое состояние называется химическим равновесием. На рис. 4 показано изменение скоростей прямой ( пр) и обратной ( пр) и обратной ( обр) реакции. В случае реакции (2) химическое равновесие устанавливается между азотом, водородом и аммиаком. Химическое равновесие – это динамическое равновесие. обр) реакции. В случае реакции (2) химическое равновесие устанавливается между азотом, водородом и аммиаком. Химическое равновесие – это динамическое равновесие. Рисунок 4. Химическое равновесие: равенство скоростей прямой и обратной реакций. Таким образом, кинетическим условием химического равновесия является равенство скоростей прямой и обратной реакции:  пр= пр=  обр обр Количественной характеристикой химического равновесия является константа химического равновесия. Величина, равная отношению произведения равновесных концентраций продуктов реакций к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия химической реакции (обозначается через Кс). 29. Водные растворы. Способы выражения концентрации растворов Многие химические реакции протекают в растворах. Растворы – это гомогенные многокомпонентные смеси переменного состава. Растворы могут быть газообразными, жидкими и твердыми. Среди соединений, образующих раствор, условно выделяют растворенные вещества и растворитель. Растворителем принято считать компонент, который в чистом виде существует в том же агрегатном состоянии, что и образовавшийся раствор, или компонент, содержание которого в растворе выше содержания остальных компонентов, называемых растворенными веществами. Наибольшее практическое значение имеют жидкие растворы, в частности водные, в которых растворителем является вода. Для выражения состава раствора и содержания растворенного вещества применяют различные способы. 1. Массовая доля компонента ωi – отношение массы i-го компонента mi к массе раствора 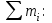  где ωi – безразмерная величина, принимающая значения от 0 до 1 или от 0 до 100 % (в последнем случае говорят о процентной концентрации). 2. Молярная (мольная) доля компонента Xi – отношение числа молей i-го компонента ni к сумме молей 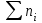 всех компонентов, образующих раствор, безразмерная величина всех компонентов, образующих раствор, безразмерная величина 3. Моляльная концентрация, или моляльность, Сm – число молей n растворенного вещества, приходящихся на 1 кг растворителя, моль/кг: 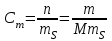 где m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль; mS –масса растворителя, кг. 4. Молярная концентрация, или молярность, С – число молей n растворенного вещества в 1 л раствора, моль/л, или сокращенно М:  где V – объем раствора, л; m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль. 5. Молярная концентрация химического эквивалента, или нормальная концентрация, или нормальность, Сэкв – число молей химического эквивалента nэкв растворенного вещества в 1 л раствора, моль экв/л, или сокращенно н.:  где Мэкв – молярная масса химического эквивалента растворенного вещества, г/моль экв; zэкв – число эквивалентности растворенного вещества; V – объем раствора, л; m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль. 6. Массовая концентрация, Смасс – масса растворенного вещества m в 1 л раствора, г/л:  где V – объем раствора, л. Можно применять и другие способы выражения состава раствора. Например, в справочниках растворимость данного вещества, т.е. состав насыщенного раствора, выражают как отношение массы растворенного вещества к массе растворителя. При проведении химических реакций часто требуется использовать растворы определенной концентрации. Для приготовления раствора заданной концентрации взвешивают необходимую массу (отмеряют необходимый объем) чистых компонентов раствора. Также можно использовать более концентрированные растворы известной концентрации, в частности, фиксаналы – растворы, помещенные в герметичные ампулы заводского производства, содержащие строго определенное (обычно 0,1 моль) количество химического соединения. При расчете массы (объема) компонентов раствора учитывают соотношения между различными способами выражения его состава. 33. Гидролиз солей. Гидролиз соли – это обменное взаимодействие ионов соли с молекулами воды, приводящее к увеличению кислотности или щелочности раствора и образованию слабодиссоциируемых соединений. Различают четыре случая взаимодействия соли и воды. 1. Соли, образуемые сильной кислотой и слабым основанием. Соли этого типа при растворении в воде образуют кислый раствор. Примером может служить хлорид аммония NH4Cl. Уравнение реакции гидролиза данной соли имеет вид NH4Cl + H2O  NH4OH + HCl . NH4OH + HCl .В ионной форме уравнение реакции гидролиза имеет вид NH4+ + H2O  NH4OH + H+. NH4OH + H+.Вследствие связывания ионов ОН- ионами аммония в слабодиссоциирующие молекулы NH4OH, в растворе появляется избыток водородных ионов и раствор становится кислым. 2. Соль образована слабой кислотой и сильным основанием. Соли этого типа при растворении в воде образуют щелочной раствор. При гидролизе соли, образованной слабой кислотой и сильным основанием, образуется слабая кислота и избыток ионов гидроксила ОН-. Примером может служить гидролиз цианида калия, уравнение реакции имеет вид: KCN + H2O  HCN + KOH HCN + KOHили в ионной форме: CN- + H2O  HCN + OH-. HCN + OH-.3. Соли, образуемые слабыми кислотами и слабыми основаниями. Данные соли почти полностью гидролизуются. Реакция гидролиза таких солей практически необратима. В качестве примера возьмем ацетат аммония CH3COONH4. Уравнение реакции гидролиза данной соли имеет вид: CH3COONH4 + H2O  CH3COOH + NH4OH CH3COOH + NH4OHили в ионной форме: CH3COO- + HN4+ + H2O  CH3COOH + NH4OH. CH3COOH + NH4OH.При растворении в воде ион аммония реагирует как кислота, а ацетат-ион как основание. Поэтому водный раствор данной соли может быть слабокислым, слабощелочным или нейтральным в зависимости от концентрации ионов Н+, ОН-, образуемых в результате реакции катионов и анионов соли с водой. Это зависит от соотношения между константами диссоциации катиона и аниона. 4. Соль образована сильным основанием и сильной кислотой. К этой группе относятся такие соли как KCl, NaCl, NaNO3. Подобные соли гидролизу не подвергаются и растворы их остаются нейтральными. Например, NaCl + H2O  NaOH + HCl. NaOH + HCl.Таким образом, можно утверждать, что в рассмотренных случаях гидролизу подвергаются не всё количество, находящейся в растворе соли, а только часть её. При гидролизе устанавливается равновесием между солью и образующими её кислотой и основанием. Доля вещества, подвергающаяся гидролизу, называется степенью гидролиза. Степень гидролиза зависит от константы равновесия, температуры и концентрации соли. 36. Перегонка жидких смесей. Ретификация Перегонка жидкостей - процесс, в котором разделяемая жидкая смесь нагревается до кипения, а образующийся пар отбирается и конденсируется. В результате получают жидкость-конденсат, состав которой отличается от состава начальной смеси. Повторяя много раз процессы испарения конденсата и конденсации, можно практически полностью разделить исходную смесь на чистые составные части. Процесс перегонки основан на том, что жидкости, составляющие смесь, обладают различным давлением пара при одной и той же температуре. Поэтому состав пара, а следовательно, и состав жидкости, получающейся при конденсации пара, будут несколько отличаться от состава начальной смеси: легколетучего (или низкокипящего - НК) компонента в паре будет содержаться больше, чем в перегоняемой жидкости. Очевидно, что в неиспарившейся жидкости концентрация труднолетучего (или высококипящего - ВК) компонента при этом должна увеличиться. В простейшем случае перегонка почти не отличается от выпарки. При выпарке подвергаются растворы, состоящие из летучего растворителя и практически нелетучего растворенного вещества, а при перегонке в пар переходят и растворитель и растворенное вещество. Перегонка является одним из важнейших технологических процессов разделения и очистки жидкостей и сжиженных газов в химической, нефтехимической, фармацевтической, пищевой и других отраслях промышленности. Перегонку подразделяют на два основных вида: простую перегонку (или дистилляцию) и ректификацию. К простой перегонке относят также перегонку с водяным паром и молекулярную дистилляцию. Под простой перегонкой понимают процесс однократного частичного испарения исходной жидкой смеси и конденсации образующихся при этом паров. Ее применяют для разделения смесей, представляющих собой легколетучее вещество с некоторым содержанием весьма труднолетучих веществ. Ректификация Ректификация - массообменный процесс, применяемый для разделения жидких и паро- или газообразных смесей, компоненты которых различаются по температурам кипения. Ректификация - наиболее полное разделение смесей жидкостей, целиком или частично растворимых друг в друге. Процесс заключается в многократном взаимодействии паров с жидкостью - флегмой, полученной при частичной конденсации паров. Процесс ректификации осуществляется при контактировании потоков пара или газа и жидкости, которые имеют разные составы и температуры: пар (газ) имеет более высокую температуру, чем вступающая с ним в контакт жидкость. Движущими силами процесса ректификации являются разности составов и температур контактирующих потоков пара или газа и жидкости. При достаточной продолжительности контакта пар и жидкость могут достичь состояния равновесия, при котором температуры потоков станут одинаковыми; при этом их составы будут связаны уравнениями равновесия. Составы встречных (но не вступивших в контакт) потоков пара и жидкости связаны уравнениями рабочих линий. Такой схеме контактирования потоков пара и жидкости соответствует понятие «теоретической тарелки», или «теоретической ступени контакта». Процесс ректификации осуществляется в ректификационных тарельчатых или насадочных аппаратах колонного типа. Основными рабочими параметрами процесса ректификации являются давление и температура в системе, соотношение потоков жидкости и пара (флегмовое число), число контактных ступеней. При соответствующем выборе параметров обеспечивается разделение исходной смеси на компоненты (фракции), удовлетворяющие определенным требованиям. Электродные потенциалы и электродвижущие силы Если при проведении окислительно-восстановительной реакции процессы окисления и восстановления разделить в пространстве, а переход электронов от восстановителя к окислителю проводить по внешней цепи, то полученное устройство называется гальваническим элементом (Г.Э.). Обычно Г.Э.составляется из двух разнородных металлов, погруженных в растворы одноименных с этими металлами солей. Растворы сообщаются друг с другом через пористые перегородки. Генерация постоянного электрического тока осуществляется за счет различия природы металлов, из которых составлен Г.Э. Система «металл-раствор соли» называется – электродом. Электрод, на котором идет процесс восстановления, называется – катодом, на котором идет процесс окисления, называется – анодом. Существуют Г.Э., в которых генерация постоянного электрического тока осуществляется за счет различия в концентрациях растворов соли металла. В этом случае электроды состоят из одного и того же металла, погруженного в растворы соли металла различной концентрации. Такие Г.Э. называют концентрационными. Если внешняя цепь в Г.Э. разомкнута, то электрический ток не вырабатывается, а на каждом электроде устанавливается динамическое равновесие, формируется двойной электрический слой между поверхностью металла и раствором соли. Таким образом, на поверхности каждой из пластинок создается определенная электрическая напряженность. Абсолютная величина этого скачка остается неизвестной, поэтому пользуются относительными значениями электродных потенциалов. Стандартным электродным потенциалом металла называют электродный потенциал этого металла, возникающий при его погружении в раствор одноименной с ним соли с молярной концентрацией соли См(Men+)= 1 моль/л, измеренный по отношению к стандартному водородному электроду, потенциал которого при 25ºС принят равным нулю Еº(2Н+|Н2)= 0 В. Если все металлы расположить в ряд по мере возрастания их стандартных электродных потенциалов (Еº), то получится «ряд напряжений». Положение того или иного металла в ряду активности характеризует его активность. Чем меньше значение Еº(Меn+|Me), тем больше его активность (восстановительная способность). Если пластинка металла погружена в раствор соли металла с концентрацией раствора отличной от 1 моль/л, то величина скачка потенциала на границе металл-раствор, рассчитывается по формуле Нернста: где Еº– стандартный электродный потенциала металла;n– число электронов, принимающих участие в процессе ;См(Меn+)–молярная концентрация катионов металла в растворе соли. Если обе металлические пластинки соединить проводником через гальванометр или через потребителя, то по внешней цепи будет осуществляться ток электронов от более активного металла к менее активному. Таким образом, более активный металл является анодом, отдавая электроны менее активному металлу – катоду. Электродвижущая сила (ЭДС) Г.Э. – максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента. Реальное напряжение всегда меньше ЭДС, т.к. работа обратима, только если процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. 42. Электролиз При пропускании постоянного электрического тока через электролит на электродах протекают химические реакции, которые сопровождаются разложением вещества. Такой процесс называется электролизом. Термин электролиз означает разложение вещества с помощью электричества. Под электролитом понимается жидкость – расплав соли (например, бромид свинца (II) - PbBr2), либо водный раствор какой-либо кислоты, основания или соли. Электрический ток подводится с помощью электродов. Отрицательно заряженный электрод – катод, положительно заряженный - это анод. Различают инертные электроды и неинертные. Инертные электроды не вступают в химические реакции, находясь в контакте с электролитами и при пропускании электрического тока. Примерами таких электродов являются графит, платина, уголь. Неинертные электроды вступают в химическую реакцию при пропускании электрического тока, например, алюминий, медь. Таким образом, электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита. |
