КР Вирусология. Контрольная работа по дисциплине Вирусология
 Скачать 151.46 Kb. Скачать 151.46 Kb.
|
|
Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования Новосибирский государственный аграрный университет Томский сельскохозяйственный институт – филиал Кафедра ветеринарии Направление подготовки: 06.03.01 Биология Контрольная работа по дисциплине «Вирусология» Вариант № 7 «Принципы лабораторной диагностики вирусных болезней животных и птиц»
Томск 2022 ОГЛАВЛЕНИЕВведение 3 1. Клинико-эпизоотологическая диагностика 4 2. Лабораторная диагностика 6 3. Использование лабораторных животных 12 Заключение 16 Список использованных источников и литературы 17 Приложения 18 ВведениеСистема мероприятий, направленных на борьбу с инфекционными болезнями, обычно включает профилактику, диагностику и лечение. В системе же мероприятий по борьбе с вирусными инфекциями в настоящее время отсутствует лечение, так как специфических противовирусных препаратов практически еще не разработано, несмотря на огромные усилия, прилагаемые для этого. Поэтому удельный вес диагностики в борьбе с вирусными болезнями значительно выше, чем с инфекционными болезнями невирусной этиологии. Быстро и правильно поставленный диагноз позволяет принять целенаправленные меры по ликвидации возникшей вспышки вирусной болезни, а также может послужить основой для оценки эпизоотологической ситуации. Ошибочный же диагноз или задержка с его постановкой могут повлечь за собою распространение вспыхнувшей болезни, усложнение мероприятий по ее ликвидации и, как следствие, значительные экономические потери. Это особенно касается вспышек быстро распространяющихся (ящур) или тяжело протекающих (чума свиней) инфекций. Поэтому диагноз на вирусное заболевание должен быть поставлен как можно быстрее и как можно точнее. К сожалению, эти два требования нередко являются взаимоисключающими, так как чем быстрее поставлен диагноз, тем он менее точный и наоборот. Целью данной работы является изучение принципов лабораторной диагностики вирусных болезней животных и птиц. Для достижения поставленной цели необходимо решить следующие задачи: – изучить клинико-эпизоотологическую диагностику; – раскрыть лабораторную диагностику; – рассмотреть использование лабораторных животных. 1. Клинико-эпизоотологическая диагностикаНет двух вирусов с абсолютно одинаковыми свойствами, нет и двух одинаковых вирусных болезней. Поэтому для диагностики почти каждой вирусной болезни требуется свой комплекс диагностических методов и препаратов. Тем не менее, в подавляющем большинстве случаев вирусные болезни животных удается диагностировать, используя типовые (стандартные) принципы и методы диагностики. На этом основании можно сформулировать некоторые общие принципы диагностики вирусных болезней животных. Как правило, постановка диагноза на вирусные болезни состоит из двух этапов [5, с. 24]: – клинико-эпизоотологическая диагностика, проводимая непосредственно в хозяйстве и большей частью позволяющая поставить лишь предварительный диагноз; – лабораторная диагностика, проводимая обычно в специализированной лаборатории и позволяющая поставить окончательный диагноз. Долабораторная (клинико-эпизоотологическая) диагностика – это распознавание болезни на основе сбора, сопоставления и анализа сведений о больных животных. Такие сведения можно получить непосредственно в хозяйстве, где содержат животных (рис. 1):  Рисунок 1 – Анализ сведений о больных животных Клиническими симптомами болезни называют ее признаки, обнаруживаемые при клиническом обследовании больного. Они включают изменения (по сравнению с нормой) температуры тела, частоты и формы дыхания, пульса, аппетита, поведения, состояния кожи и слизистых оболочек, состояния и функционирования органов пищеварения, выделений и т. д. Патолого-анатомические изменения обычно устанавливают при вскрытии павших или вынужденно убитых животных. К ним относят макроскопически наблюдаемые изменения (по сравнению с нормой) формы, размеров, цвета, консистенции, положения органов животного, а также появление узелков, кровоизлияний, везикул и других образований, не встречающихся в норме. Сюда же относят и микроскопические изменения в клетках и тканях, обнаруживаемые гистологическими методами [3, с. 18]. Эпизоотологические данные включают сведения о скорости распространения болезни среди данного поголовья животных и на прилегающей территории, видах заболевших животных; динамике выявления больных и т. д. Полученных данных обычно бывает достаточно, чтобы решить вопрос, инфекционное или неинфекционное заболевание. Если оно инфекционного характера, то внимательный анализ и сопоставление собранных сведений позволяют предположить, какое именно. Следует также учитывать, что каждое заболевание (вирусной и невирусной этиологии) сопровождается определенным комплексом характерных клинических симптомов, эпизоотологическими особенностями и патолого-анатомическими изменениями. Такой клинико-эпизоотологический диагноз в редких случаях носит полностью уверенный характер. Чаще всего он является лишь предварительным, ориентировочным. Особенно это относится к инфекционным болезням вирусной этиологии, когда сходные эпизоотологические данные, клинические симптомы и патологоанатомические изменения обычно наблюдают при нескольких заболеваниях, и это обстоятельство не позволяет с абсолютной уверенностью распознать болезнь. Положение еще больше осложняется, если болезнь вызвана не одним, а двумя и более этиологическими агентами, что встречается часто. Все же бывают редкие случаи, когда по клиническим, эпизоотологическим и патолого-анатомическим данным можно поставить уверенный диагноз. Таким образом, несмотря на сугубо ориентировочный характер предварительного диагноза, он играет весьма важную роль, так как может быть поставлен в короткий срок и сразу же ориентирует ветеринарных специалистов только на несколько видов болезней из многих возможных. 2. Лабораторная диагностикаДля постановки окончательного диагноза в большинстве случаев необходимо в дополнение к предварительному клинико-эпизоотологическому диагнозу установить, какие патогенные вирусы находятся в организме больного животного, и попытаться найти доказательства их этиологической роли. Обнаружение и идентификацию вирусов в организме больного животного осуществляют лабораторными методами, их часто называют лабораторной диагностикой, которая включает основные виды работ, представленные на рисунке 2.  Рисунок 2 – Основные виды работ лабораторной диагностики Получение биологического материала. Обнаружение вируса в организме больного животного начинают с взятия биологического материала. Это различные ткани, жидкости, экскреты, полученные из организма больного животного с целью обнаружения в них и последующей идентификации возбудителей болезни, что составляет основу для постановки диагноза. Если возбудителем болезни является вирус, то после обнаружения его выделяют из биологического материала, устанавливают вид и доказывают его этиологическую роль в заболевании животного [1, с. 11]. Максимальное содержание вирусов в биоматериале бывает в период появления первых симптомов болезни. Поэтому, чем раньше взяты пробы материала, тем больше шансов на обнаружение в них и выделение вирусов. Это относится и к трупному материалу, выделить вирус, из которого редко удается, если смерть наступила через 7–9 дней или позже после появления клинических симптомов болезни. Исследование биологического материала методами быстрой диагностики (экспресс-диагностика). Наиболее быстро удается обнаружить в биологическом материале вирусные антигены (белки вирусов), вирусные тельца-включения, вирионы и вирусные гемагглютинины. Методы их обнаружения объединяют в группу экспресс-методов, а постановка диагноза с их помощью может быть названа экспресс-диагностикой. Названные методы отличаются двумя особенностями [1, с. 24]: – они не нуждаются в дополнительной идентификации, так как основаны на поисках присутствия не вообще вирусов, а определенного вида; – их выполняют в короткие сроки (от нескольких часов до нескольких дней), поэтому образуется группа быстрых методов, весьма ценных при постановке диагноза. Основная ценность экспресс-методов: – возможность быстрого обнаружения присутствия определенных вирусов в биологическом материале, поскольку сроки исследования колеблются от 2–3 ч до 2–3 дней (в зависимости от используемого метода); – методы направлены на поиск в биологическом материале определенного вируса, чем снимается необходимость последующей идентификации обнаруженного вируса. Основные недостатки экспресс-методов [2, с. 18]: – позволяют обнаруживать в исследуемом материале не активные формы вирусов, а только отдельные их элементы (антигены, нуклеиновые кислоты, гемагглютинины и др.) и считать, что они свидетельствуют о репродукции в клетках исследуемого материала того вируса, элементы которого обнаружены; – относительно невысокая степень достоверности результатов, заложенная в самой технике обнаружения определенных элементов вирусов. Так, МФА страдает субъективностью оценки результатов, может давать перекрестное и неспецифическое свечение. Сходные недостатки свойственны также ИФА и РДП. Методы молекулярных зондов и электронной микроскопии технически сложны и допускают неоднозначность интерпретации результатов. Что же касается телец-включений и гемагглютининов, то их обнаруживают только в небольшом проценте случаев и при инфекциях, вызываемых только некоторыми вирусами. Несмотря на отмеченные недостатки, использование для диагностики вирусных инфекций лабораторных экспресс-методов является обязательным, так как они позволяют быстро установить, какой именно патогенный вирус содержится в биологическом материале, а значит и в организме больного животного. В совокупности с данными клиники, патанатомии и эпизоотологии эти сведения дают возможность поставить относительно уверенный диагноз уже в первые дни болезни. Исследование биологического материала длительными методами (ретроспективная диагностика). Биологической пробой называют экспериментальное заражение вируссодержащим материалом (суспензией вируса, полученной из патматериала) чувствительных к предполагаемому вирусу живых систем. Это наиболее старый и наиболее чувствительный метод индикации вирусов. Можно уверенно утверждать, что о существовании всех известных нам вирусов мы знаем по их действию на определенные живые системы. Выбор подходящей живой системы – важнейший элемент постановки биопробы. В качестве живых систем в лабораториях используют культуры клеток, куриные эмбрионы, лабораторных и естественно восприимчивых животных. При выборе объекта для биопробы учитывают предварительный (клинико-эпизоотологический) диагноз, который позволяет сузить поиск до минимального количества вирусов, что, в свою очередь, дает возможность взять те живые объекты, которые заведомо чувствительны к предполагаемым в материале вирусам. Учитывают также вид больных животных, от которых получен материал на исследование. Если биоматериал получен от млекопитающих животных, наиболее подходящей живой системой для индикации в нем вирусов чаще всего оказывается культура клеток, полученная из тканей того же вида животного, от которого получен биоматериал, поскольку вирусы, содержащиеся в биоматериале, уже адаптированы к клеткам этого вида. Из этого общего правила бывают исключения. Так, вирус бешенства не вызывает ЦПД (цитопатического действия) ни в какой культуре клеток и для его индикации более подходит биопроба на лабораторных животных. Вирус классической чумы свиней также не проявляет своего действия ни на культуры клеток, ни на лабораторных животных, и для его индикации приходится использовать естественно восприимчивое животное (поросенка). Иногда вирус способен репродуцироваться в гетерологичной культуре клеток (так, вирус гриппа свиней дает ЦПД в культуре фибробластов крупного эмбриона) [5, с. 37]. Если биоматериал получен от кур, целесообразно биопробу ставить на куриных эмбрионах, которые проще получить и они дешевле, чем культуры клеток. При получении биоматериала от других видов птиц для индикации в нем вирусов используют эмбрионы этих же видов птиц, хотя нередко удается индикация вирусов и на куриных эмбрионах. Следует отметить, что в I пассаже вирус редко проявляет свое действие на культуру клеток или куриный эмбрион, так как для этого необходимо достижение вирусом минимальной инфекционной дозы и адаптации к лабораторной системе. Поэтому при отсутствии показателей действия вируса из биоматериала на лабораторные объекты этот I пассаж считают «слепым», собирают из зараженного объекта вируссодержащий материал и приводят II, а иногда III и даже IV пассажи (пока не обнаружат вирус). В таблице 1 отображены живые биологические системы для культивирования вируса Таблица 1 Живые биологические системы для культивирования вируса
Обнаружение вируса в биологическом материале от больных животных еще недостаточно для суждения о причине заболевания, так как данные биопробы в большинстве случаев еще не указывают, какой именно вирус обнаружен. Его надо еще идентифицировать, то есть установить вид, для чего необходимо предварительно накопить массу обнаруженного вируса. С этой целью от объектов, положительно прореагировавших на экспериментальное заражение, собирают вируссодержащий материал [5, с. 24]. Исследование парных сывороток в серологических реакциях (серологическая диагностика) Вирусы обладают антигенными свойствами, так как белки, входящие в состав вирионов и неструктурные, являются антигенами, поскольку они содержат чужеродную для организма генетическую информацию. На проникновение вирусов организм высших позвоночных животных реагирует выработкой специфических белков, относящихся к классу гаммаглобулинов, и называемых антителами. Антитела накапливаются в основном в сыворотке крови, меньше в других жидкостях организма. Антитела обладают свойством вступать во взаимодействие только с тем антигеном, на который они образовались (специфичность антител). Такое взаимодействие возможно и в организме, и в пробирке. В результате взаимодействия антител с гомологичным антигеном образуется комплекс антиген + антитело, чем нейтрализуется действие антигена на организм. Поэтому антитела являются фактором защиты организма от различных инфекционных агентов, включая и вирусы. Антитела в сыворотке крови животных обнаруживают с помощью серологических реакций, используя заведомо известные антигены. В зависимости от используемой реакции различают антитела: вируснейтрализующие, антигемагглютинирующие, комплементсвязывающие, преципитирующие. Концентрацию или титр антител в сыворотке выражают тем наивысшим разведением сыворотки, в котором еще проявляется взаимодействие антител с гомологичным антигеном [3, с. 46]. Противовирусные антитела образуются в организме в ответ на проникновение вируса парентеральным путем. Начинается антителообразование не сразу после заражения, а только через несколько дней. Титр антител в сыворотке крови вначале бывает низкий, а затем постепенно возрастает, достигая максимума к периоду реконвалесценции (выздоровления). В дальнейшем их титр чаще всего снижается, но обычно это происходит очень медленно, так что антитела в сыворотке переболевшего животного удается обнаруживать месяцы, а иногда и годы. Бывают и исключения. Так, на заражение свиней вирусом африканской чумы животные не вырабатывают вирус нейтрализующих антител. Обнаружение антител к вирусам в сыворотке крови животного еще не говорит о его болезни, поскольку многие антитела сохраняются в крови и после выздоровления. Оно лишь свидетельствует о том, что организм животного контактировал с данным вирусом. Обычно в период активной вирусной инфекции в сыворотке крови повышается титр антител к вирусу, вызвавшему болезнь. Поэтому для постановки диагноза методом иследования сыворотки у больного животного кровь берут дважды: в начале болезни и в период выздоровления (чаще всего через 2–3 недели). В полученных из двух проб крови парных сыворотках определяют титры антител к вирусам, предположительно вызвавшим заболевание. Считается, что повышение титр антител во второй сыворотке по сравнению с первой в четыре и более раз свидетельствует об активной инфекции в период взятия крови, вызванной тем вирусом, титр антител к которому возрос. Этот диагноз, поставленный на основании серологических исследований, является высоко достоверным, но имеет ретроспективное значение. 3. Использование лабораторных животныхВ настоящее время лабораторные животные широко применяются в вирусологии для решения самых разнообразных теоретических и практических вопросов. Большинство вирусов могут быть дифференцированы друг от друга на основании патогенности для различных видов животных. Некоторые вирусы не представляется возможным культивировать ни в куриных эмбрионах, ни в культуре клеток, а только в организме восприимчивых животных. Наличие у лабораторных животных характерной клинической картины после заражения патологическим вируссодержащим материалом, результаты вирусологических и гистологических исследований их органов и тканей в ряде случаев являются основным методом диагностики вирусных болезней человека. Заражают белых мышей, кроликов, морских свинок, крыс и т.д [5, с. 21]. Методы заражения: оральное, подкожное, внутримышечное, внутрикожное, внутривенное заражение, в брюшную полость, интракардиальное заражение, заражение через нос, заражение в мозг. Оральное заражение (per os). Для заражения вируссодержащий материал добавляют к пище или воде. Реже через носоглоточный зонд. Заражение в мозг. Интрацеребральную инъекцию у большинства лабораторных животных производят сбоку от средней линии, в середине между верхним краем глазной впадины и наружным слуховым проходом. Животных заражают путем прокола кости черепа иглой. Материал вводят в количестве 0,2-0,3 мл, медленно. Использование куриных эмбрионов В вирусологической практике куриные эмбрионы нашли широкое применение для выделения вируса из патологического материала. Существенное преимущество этого метода – высокая бактериологическая чистота получаемых вирусных суспензий, так как замкнутая полость яйца служит надёжной защитой от различной микрофлоры. Куриные эмбрионы пригодны для культивирования многих вирусов, патогенных для человека и животных. Они дёшевы, удобны и доступны для работы большинства практических лабораторий [2, с. 63]. К недостаткам этого метода относятся высокое содержание в экстраэмбриональных вирусосодержащих жидкостях неспецифического белка, а также возможность спонтанного инфицирования куриных эмбрионов вирусами. Для вирусологических исследований используют яйца, полученные из хозяйств, благополучных по инфекционным болезням птиц. Для инкубации яйца помещают в специальные инкубаторы с температурой 37,5-38 С и относительной влажностью воздуха 40-70%. Продолжительность инкубирования куриных эмбрионов определяется избранным методом введения вируссодержащего материала. Чаще всего в работе используются 7-12-дневные куриные эмбрионы. Строение куриного эмбриона. Развитие оплодотворенного яйца начинается с образования трёх зародышевых листков: эктодермы, мезодермы и энтодермы. Из экто- и мезодермы возникает амниотическая полость. Амниотическая полость заполнена жидкостью (1мл). Из экто- и мезодермы кроме амниона образуется хорион, который к 10-му дню обволакивает все содержимое яйца, образуя периферическую поверхность хориоаллантоисной оболочки. Внутренняя поверхность аллантоисной оболочки образуется из энтодермы на 3-й день развития эмбриона. Пространство между хориоаллантоисной и аллантоисной оболочкой, покрывающей амнион, заполнено аллантаисной жидкостью. Основной резервуар питательных веществ для зародыша – желточный мешок [4, с. 30]. Методы заражения куриных эмбрионов. Выбор методов заражения куриных эмбрионов зависит от биологических свойств исследуемого вируса. В вирусологической практике широкое применение нашло заражение на хорионаллантоисную оболочку, в аллантоисную полость и в желточный мешок. Заражение на хорионаллантоисную оболочку. Используют 10-12 – дневные куриные эмбрионы, инкубированные в горизонтальном положении. Поверхность яйца дезинфицируют спиртом, 2% раствором йода, прожигают. На скорлупе выпиливают треугольник (5-6мм). Иглой надрывают подскорлупную оболочку. На обнажённую хорионаллантоисную оболочку пастеровской пипеткой наносят 0,1 мл вируссодержащего материала. Отверстия на скорлупе закрывают парафином. Заражение в аллантоисную полость. Используют 9-11 – дневные эмбрионы, когда аллантоисной жидкости содержится больше всего. Скорлупу дезинфицируют спиртом, 2% раствором йода, прожигают. Яйцо помещают вертикально тупым концом вверх. Над центром воздушного мешка делают прокол скорлупы и через него вводят иглу диаметром 0,5 мм и длиной 5 см на глубину 3-5 см. Инокулируют исследуемый материал в количестве 0,1 мл. Место инъекции закрывают парафином. Яйца инкубируют в вертикальном положении при 35 С 24-72 ч. Заражение в амниотическую полость. Используют 10-11-дневные эмбрионы, которые близко расположены к воздушному пространству. Заражение производят в затемненном помещении под овоскопом. Тупой конец яйца дезинфицируют, в скорлупе делают отверстие над воздушной камерой. Для заражения используют иглу диаметром 0,6мм. Материал вводят в количестве 0,1 мл. Отверстие закрывают парафином. Зараженные яйца инкубируют при 37С 24-72ч. Заражение в желточный мешок. Используют 5-6-дневные эмбрионы, т.к. в этот период желточный мешок имеет самый большой объем. Скорлупу дезинфицируют, делают в ней отверстие. Для заражения используют иглу длиной 5см, которую вводят вертикально до упора. Игла прокалывает хорионаллантоисную оболочку, проходит через аллантоисную полость и через стенку желточного мешка в желток. Место инъекции закрывают парафином. Яйца инкубируют при 37С 72 ч. В лаборатории часть материала берут для исследования, оставшуюся часть хранят в холодильнике на случай дополнительных исследований. Затем составляют план исследования присланного материала, который включает следующие задачи: обнаружение (индикация) вируса в материале; выделение (изоляция) вируса из материала; идентификация выделенного вируса ЗаключениеМы рассмотрели общие принципы обнаружения и идентификации вирусов в материале от больных животных. Однако каждый вирус имеет свои индивидуальные особенности, которые необходимо учитывать, чтобы выбрать кратчайший путь исследования материала. Обычно исследуют биоматериал от одного и того же животного одновременно двумя-тремя путями, чаще всего сочетая культивирование вирусов на живых объектах с экспресс-исследованиями. Этим достигается быстрота получения результата (экспресс-методы) и его высокая достоверность вследствие подтверждения результата экспресс-исследования выделением и идентификацией вируса с помощью живых объектов. Высокодостоверный результат исследования биоматериала на вирусы служит надежной основой для постановки уверенного диагноза. Список использованных источников и литературыБиология. Разнообразие живой природы. Вирусы, бактерии, грибы, растения, животные. В 3 частях. Часть. - Москва: РГГУ, 2020. – 904 c. Госманов, Р. Г. Ветеринарная вирусология / Р.Г. Госманов. - М.: Лань, 2022. – 183 c. Жилинская, И.Н. Вопросы общей вирусологии / И.Н. Жилинская. - М.: СПбГМА, 2022. – 373 c. Коломиец, В.М. Антропозоонозы. Диагностика и профилактика значимых инфекционных болезней животных и человека / В.М. Коломиец. - М.: КолосС, 2019. – 727 c. Солодова, Е. А. Биология. Разнообразие живой природы. Вирусы, бактерии, грибы, растения, животные. В 3 частях. Часть 2 / Е.А. Солодова, Т.Л. Богданова. - Москва: СИНТЕГ, 2021. – 240 c. Щербаков, Г.Г. Внутренние болезни животных. Гриф МО РФ / Г.Г. Щербаков. – М.: Академия (Academia), 2020. – 765 c. ПриложенияПриложение 1 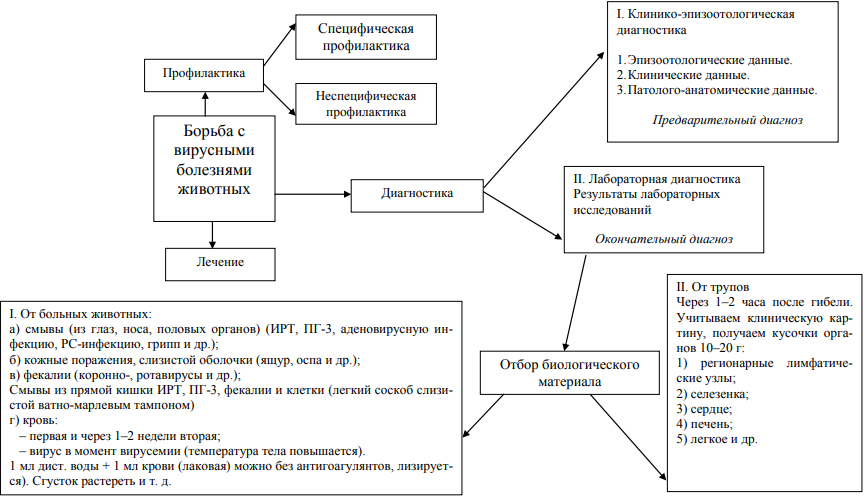 |
