|
|
отчётлаб7ЛЭТИ хим 1сем. Коррозия и защита металлов
МИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра физической химии
отчет
по лабораторной работе №7
по дисциплине «Химия»
Тема: Коррозия и защита металлов
Студент гр. 1584
|
|
Усков А.Д.
|
Преподаватель
|
|
Васильев Б.В.
|
Санкт-Петербург
2021
Цель работы: изучение влияния некоторых факторов на протекание процессов химической и электрохимической коррозии и методов защиты металлов от коррозии.
Основные теоретические положения
Коррозия – это процесс самопроизвольного разрушения металлов или металлических сплавов вследствие их химического или электрохимического взаимодействия с агрессивной окружающей средой.
Химическая коррозия – разновидность коррозии, при которой металлы разрушаются вследствие протекания гетерогенных химических реакций: это или взаимодействие с агрессивными газами при высоких температурах, исключающих конденсацию влаги на поверхности металла, или растворение металла в органических средах, не проводящих ток.
Электрохимическая коррозия - разновидность коррозии, протекающая в проводящих ток средах.
Металл (или участок металла) с более отрицательным электродным потенциалом выступает в качестве анода. На аноде протекает процесс окисления металла, который можно записать: Me0 – nē Men+
Менее активный металл (участок металла) является катодом. На катоде протекает процесс восстановления. Катодные процессы протекают с участием молекул и ионов среды, и отличаются в зависимости от среды, в которой протекает коррозия в различных средах:
в кислой среде: 2H+ + 2e- → H2
в кислой среде с участием растворенного кислорода: O2 + 4e- + 4H+ → 2H2O
в нейтральной и щелочной среде: 2H2O + 2e- → H2 + 2OH
в нейтральной и щелочной среде с участием растворенного кислорода:
O2 + 4e- + 2H2O → 4OH-
Основные методы защиты от коррозии: повышение коррозийной стойкости металлов и сплавов легированием (ввести в состав хром, никель, медь или алюминий), снижение агрессивности коррозийной среды (ввести в среду замедлители (ингибиторы) коррозии или уменьшить содержания в ней деполяризатора), защита электрическим током (подвергнуть металл внешней поляризации), нанесение защитных покрытий (покрыть металл лаком, краской или эмалью).
  Обработкарезультатов Обработкарезультатов
Опыт 14.2.Коррозиядвухконтактирующихметаллов
14.2.1 Записать уравнения возможных реакций, полуреакции окисления и восстановления. Объяснить, почему реакция цинка с кислотой протекает, а с медью – нет.
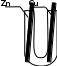
|
Наблюдение: на цинковой пластине образуются пузыри водорода.
Протекает реакция: Zn + H2SO4→ ZnSO4 + H2↑
Окисление: Zn – 2e → Zn2+
Восстановление: 2H+ + 2e → H2↑
Объяснение:
Цинк обладает более отрицательным потенциалом, нежели медь и, поэтому в кислой среде поддаётся коррозии.
Не протекает реакция:Cu + H2SO4→ CuSO4 + H2↑
Объяснение:
Медь обладает более положительным потенциалом и является малоактивным металлом, реакция не пройдёт.
|
14.2.2
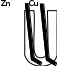
|
Наблюдение:на медной пластине образуются пузыри водорода.
Протекает реакция:
А(Zn): Zn – 2e → Zn2+
К(Cu):2H+ + 2e → H2↑
Объяснение:
В данной реакции, из-за соприкосновения цинковой и медной пластины, образуется короткозамкнутый гальванический элемент, в котором катодом является медь, а анодом — цинк.
Процесс выделения водорода интенсифицируется, так как увеличивается площадь поверхности, участвующая в реакции.
|
Опыт 14.3.Влияниемеханическихнапряженийвметалленаегокоррозию.
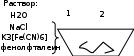
|
Наблюдения:
1 – на изогнутых участках – раствор окрашивается в синий
2 – на прямых участках – раствор окрашивается в розовый
Процессы коррозии:
А(1): Fe – 2e → Fe2+
К(2): 2H2O + 2e → H2↑ + 2OH-
Качественные реакции:
Fe2+ + K2[Fe(CN)6] → KFe[Fe(CN)6]↓
OH- + фенолфталеин → розовый окрас
Объяснение:
При сгибании проволоки меняется структура её поверхностного слоя, что может вызвать
изменение потенциала на отдельных участках, разрушение защитных пленок, и как следствие этого — увеличение скорости коррозии.
|
Опыт 14.4.Влияниенеравномернойаэрациинапроцесскоррозии
|
Наблюдения:
1 – на погруженном участке раствор окрашивается в синий
2 – у поверхностираствор окрашивается в розовый
Процессы коррозии:
А(1): Fe – 2e → Fe2+
К(2): O2 + 2H2O + 4e → 4OH-
Качественные реакции:
Fe2+ + K2[Fe(CN)6] → KFe[Fe(CN)6]↓
OH- + фенолфталеин → розовый окрас
Объяснение:
На поверхности находится кислород, который, как катод, восстанавливается с образованием OH- ионов, уже реагирующих с погруженным в раствор железом, являющимся анодом.
|
Опыт 14.5.Действиестимуляторакоррозии
Раствор:
CuSO4
|
Раствор:
CuCl2

|
Наблюдения: реакция 1 протекает медленнее, чем реакция 2.
Реакции (в молекулярном, полном и сокращенном ионно-молекулярном виде):
1. В растворе CuSO4
2Al + 3CuSO4→ Al2(SO4)3 + 3Cu
2Al0 + 3Cu2+ + 3SO42-→ 2Al 3++ 3SO42- +3Cu0
2Al0 + 3Cu2+→ 2Al3++ 3Cu0
Окисление: 2Al0 - 6e → 2Al3+
Восстановление: 3Cu2+ + 6e → 3Cu0
2.В раствореCuCl2
2Al + 3CuCl2→ 2AlCl3 + 3Cu
2Al0 + 3Cu2+ +6Cl-→ 2Al3+ + 6Cl- + 3Cu0
2Al0 + 3Cu2+→ 2Al3+ + 3Cu0
Окисление: 2Al0 - 6e → 2Al3+
Восстановление: 3Cu2+ + 6e → 3Cu0
В (водном) раствореCuCl2идет побочная реакция алюминия с водой с выделением водорода:
2Al + 6H2O → 2Al(OH)3 + 3H2↑
Окисление: 2Al0 - 6e → 2Al3+
Восстановление: 6H2O + 6e → 3H2 + 6OH-
Объяснение:
При окислении алюминия образуются ионы Cl-, являющиеся катализаторами коррозии.
|
Опыт 14.6.Защитноедействиеоксиднойпленки
1 . .
|
1. Образование жидкого сплава ртути и алюминия – амальгамы алюминия:
Наблюдения: образование рыхлого слоя на алюминиевой пластине.
Реакция: Al + Hg(NO3)2→ AlHg + Al(NO3)2
2.
Наблюдения: образование пузырьков водорода.
Реакция: 2Al + 6H2O → 2Al(OH)3 + 3H2↑
Окисление: 2Al0 - 6e → 2Al3+
Восстановление: 6H2O + 6e → 3H2 + 6OH-
Объяснение:
При образовании жидкого сплава Al и Hg, разрушается прочная оксидная плёнка Al, из-за чего он и подвергается коррозии в воде.
|
2.
|
Опыт 14.8.Анодноеикатодноепокрытия
1.
оценкованное железо
Fe/Zn
|
2.
луженое железо
Fe/Sn
|
Наблюдения:
Появление синей окраски наблюдается на 1пластине.
Процессы коррозии:
Оцинкованное железо:
1. А(Zn): Zn – 2e → Zn2+
К(Fe): 2H2O + 2e → H2↑ + 2OH-
Луженое железо:
2.
А(Fe): Fe – 2e → Fe2+
К(Sn): 2H2O + 2e → H2↑ + 2OH-
Качественная реакция:
Fe2+ + K2[Fe(CN)6] → KFe[Fe(CN)6]↓
Объяснение:
Анодным покрытием является цинк,
а катодным — олово. Покрытие из цинка
п родолжает защищать железо от коррозии, так
к Ак последнее остаётся катодом в
данном короткозамкнутом гальваническом элементе.
|
|
|
|
Опыт 14.9.Протекторнаязащита
1.
|
2.
|
Наблюдения:
1. Образование осадка не происходит.
2. Образуется жёлтый осадок.
Реакции и процессы коррозии:
1. Pb + CH3COOH → Pb(CH3COO)2 + H2↑
Окисление: Pb – 2e → Pb2+
Восстановление: 2H+ + 2e → H2↑
Качественная реакция: Pb2+ + 2I-→ PbI2↓
2. Zn + CH3COOH → Zn(CH3COO)2 + H2↑
А(Zn): Zn – 2e → Zn2+
К(Pb): 2H+ + 2e → H2↑Объяснение: Протекторная защита состоит в том, что на поверхность металла наносят более активный (более электроотрицательный), который становится анодом и реагирует с агрессивной средой вместо защищаемого металла, делая его катодом.
|
|
|
|
Опыт 14.10.Влияниеингибиторанакоррозию металла
1.
|
2.
|
Наблюдения: в 1 реакция быстрая, появляется синий окрас, в 2 реакция замедлена.
Реакция: Fe + H2SO4→ FeSO4 + H2↑
Окисление: Fe – 2e → Fe2+
Восстановление: 2H+ + 2e → H2↑
Качественная реакция:
Fe2+ + K2[Fe(CN)6] → KFe[Fe(CN)6]↓
Объяснение:
Уротропин имеет свойство избирательно адсорбироваться на поверхности металла, образуя плёнку, которая тормозит коррозию металла.
|
Выводы: Экспериментально установлено, что на коррозию металлов влияют образование макро-/микрогальванических пар, механическое напряжение, неравномерная аэрация, действие стимулятора коррозии(катализатора) и действие ингибиторов, в данном случае уротропина. Металл можно защитить, используя протекторную защиту, покрыв его оксидной плёнкой, анодным или катодным покрытием. |
|
|
 Скачать 0.74 Mb.
Скачать 0.74 Mb.
 Обработкарезультатов
Обработкарезультатов
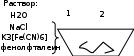
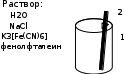

 .
.