определение жесткости воды. Курсовая работа по теме Определение жесткости воды по дисциплине Неорганическая химия
 Скачать 30.55 Kb. Скачать 30.55 Kb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ» Химический факультет Кафедра общей и неорганической химии Курсовая работа по теме: «Определение жесткости воды» по дисциплине «Неорганическая химия» Направление подготовки: 04.03.01 Химия Зав. кафедрой________________д.х.н., проф. Семенов В.Н. Обучающийся ________________________ Алымова А.А. Руководитель_________________ к.х.н., доц. Сушкова Т.П. Воронеж-2021 ОглавлениеВведение 3 §1. Обзор литературы 5 1.1. Вода и ее свойства 5 1.2. Жесткость воды 5 1.3. Методы определения жесткости воды 7 Комплексонометрический метод 8 § 2. Методика эксперимента 10 § 3. Результаты эксперимента 12 Выводы 15 Список литературы 16 ВведениеВ настоящее время проблема загрязнения окружающей нас среды наиболее остро стоит перед человечеством. Вода — основной источник жизни на планете Земля. Люди на 80% состоят из воды, поэтому чтобы поддерживать водный баланс, человек должен пить чистую воду. Ежедневно человечество расходует до 7 млрд. тонн воды, это соизмеримо по массе с общим количеством полезных ископаемых, добываемых за один год [1]. Вода — химическое соединение кислорода с водородом, отвечающее в парообразном состоянии формуле Н2О. Природная вода, как правило, содержит те или иные примеси. Наиболее чистой природной водой считается дождевая. Вода, очищенная от нелетучих растворенных веществ перегонкой, называется дистиллированной [1]. С каждым днем все большую актуальность приобретает проблема очистки, а если быть точнее, подготовки воды. И следует отметить, что не только воды для питья, но и для использования в быту. Существует общая проблема как для загородных домов, также и для городских квартир. Это проблема жесткости воды, и если на качество питьевой воды жёсткость хоть и влияет, но не столь сильно, то для современной бытовой техники, автономных систем горячего водоснабжения и отопления, новейших образцов сантехники необходимость борьбы с жесткостью крайне актуальна. Степень жесткость зависит от присутствия в воде катионов Ca+2 и Mg+2 и некоторых других металлов. Их источником являются природные залежи известняков, гипса и доломитов. Ионы Ca2+и Mg 2+ поступают в воду в результате взаимодействия растворённого диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий. В маломинерализованных водах больше всего ионов кальция. С увеличением степени минерализации содержание ионов кальция быстро падает и редко превышает 1 г/л. Содержание же ионов Mg2+в минерализованных водах может достигать нескольких граммов, а в солёных водах нескольких десятков граммов [1]. Целью данной работы является проведение анализа разных типов воды на жесткость. §1. Обзор литературы1.1. Вода и ее свойстваВода – оксид водорода — бинарное соединение неорганической природы. Формула — H2O. Молярная масса — 18 г/моль. Может существовать в трех агрегатных состояниях — жидком (вода), твердом (лед) и газообразном (водяной пар). Вода — наиболее распространенный растворитель. В растворе воды существует равновесие, поэтому воду называют амфолитом: H2O ↔ H+ + OH— ↔ H3O+ + OH— Химически чистая вода в природе почти не встречается, ее можно получить лабораторным путем. Например, сжигание водорода в воздухе, получаем в воздухе пары воды. Такая вода не имеет цвета и запаха, но имеет неприятный вкус, но природная вода является хорошим растворителем [2]. Химический состав воды постоянно изменяется по мере прохождения через атмосферу и литосферу. Из атмосферы в воду попадают азот и кислород, частицы солей, окиси азота и другие вещества. Вода, что выпала на поверхность Земли в виде атмосферных осадков, растворяет вещества, которые тут находятся, и насыщается солями, органическими веществами, газами. Еще больше изменяется химический состав воды при проникновении ее в землю и горные породы. Большую роль в изменении химического состава играет сельскохозяйственная деятельность человека [2]. 1.2. Жесткость водыМагний и кальций — два необходимых элемента для организма человека. А питьевая вода является одним из ценных источников, поскольку обусловливающие жесткость воды соли кальция и магния в значительной мере поступают в наш организм вместе с водой. Так, с питьем в организм поступает до 10-15% суточной нормы кальция — он, как известно, залог крепких костей и зубов. А магний — ключевой участник более чем 250 химических реакций в теле человека; он входит в состав всех тканей и клеток. При этом организм не может самостоятельно вырабатывать магний — для этого нужна магниесодержащая вода и пища [3]. Жесткость воды в широком смысле — это совокупность химических и физико-химических свойств воды, обусловленных растворенными в ней неорганическими (или, как говорят, минеральными) солями ряда металлов. Жесткость - один из технологических показателей, принятых для характеристики состава и качества природных вод. Жесткой называют воду с повышенным содержанием ионов Сa2+ и Mg2+. Сумма концентраций ионов Сa2+ и Mg2+ является количественной мерой жесткости воды [4]. Таблица 1. Общая жесткость воды
В связи с тем, что в воздухе достаточно велико содержание СО2, в природной воде есть растворенный диоксид углерода. Протекает взаимодействие СО2 с Н2O: CO2 + H2O= H2CO3 Результатом которого является образование гидрокарбонат-иона. Концентрация ионов Сa+2 и Mg+2 в воде, эквивалентная содержанию иона НСО3-, определяет карбонатную жесткость воды, а концентрация ионов Сa+2 и Mg+2, эквивалентная всем прочим анионам (SO42-, Cl- и т.д.), — некарбонатную. Сумма карбонатной и некарбонатной жесткости составляет общую жесткость воды [4]. Следовательно, временная жесткость воды вызывается присутствием гидрокарбонатов, таких как Ca(HCO3)2 и Mg(HCO3)2, постоянная жесткость вызвана присутствием в воде сульфатов и хлоридов Сa2+ и Mg2+. 1.3. Методы определения жесткости водыДля определения жесткости могут быть использованы: а) визуально-колориметрический метод, пригодный для анализа воды с очень малой жесткостью порядка десятых долей микрограмм — эквивалента в литре; б) объемный олеатный метод, применяемый относительно редко, обычно в тех случаях, когда трилонатный метод оказывается неэффективным. в) кислотно-основное титрование. Колориметрический метод Этот метод основан на различной интенсивности окраски хром темно — синего в зависимости от концентрации ионов Са2+ и Mg2+ в анализируемой воде и может быть использован для быстрого определения малых жесткостей воды (от 10 мкг — экв/л). Олеатный метод Этот метод основан на малой растворимости олеатов кальция и магния. Поэтому добавление раствора олеата калия к анализируемой пробе воды и ее взбалтывание вызывает сначала осаждение всех содержащихся в воде ионов кальция и магния в виде олеата, и лишь затем избыток олеата калия приводит к образованию устойчивой пены, что и служит признаком окончания титрования. Метод кислотно-основного титрования В основе кислотно-основного титрования в водных растворах лежат реакции взаимодействия между кислотами и основаниями: Н+ + ОН– = Н2О С помощью этого метода прямым титрованием можно определить концентрацию кислоты или основания, или содержание элементов, образующих кислоты или растворимые основания (например, фосфора – в виде фосфорной кислоты, мышьяка — в виде мышьяковой кислоты и т.п.) [5]. Комплексонометрический методНаиболее ценным свойством комплексонов, широко используемым в анализе, является их способность давать внутрикомплексные соли с ионами щелочноземельных металлов: магнием, кальцием и барием, которые, как известно, трудно или невозможно перевести в комплексные соединения другими средствами [5]. Комплексы, образуемые комплексонами с большинством катионов металлов, весьма устойчивы, что вполне обеспечивает практически полное связывание определяемого металла в комплекс. При контроле качества воды определяют ее жесткость. Для определения общей жесткости используют метод комплексонометрии. В основе этого метода лежит титрование воды в присутствии аммиачного буферного раствора (рН=9,0) и индикатора раствором комплексона III до перехода розовой окраски в голубую. При анализе применяют один из индикаторов: кислотный хром синий К или Эрихом черный Т. В присутствии ионов жесткости Сa2+ и Mg2+ эти индикаторы окрашиваются в розовый цвет, в отсутствии - в голубой. Комплексон III — двузамещенная натриевая соль этелендиаминтетрауксусной кислоты [5,7]. При титровании жесткой воды раствором комплексона III образуется внутрикомплексное соединение, т.е. связываются ионы Сa2+ и Mg2+. Поэтому в конце титрования индикатор изменяет окраску, раствор становится голубым [5]. В основе метода кислотно-основного титрования лежит титрование воды в присутствии индикатора метилового оранжевого раствором соляной кислоты до перехода желтой окраски индикатора в оранжевую [5]. Анализ воды на жесткость предполагает обычно: а) определение общей жесткости, H б) определение карбонатной жесткости, HC в) вычисление некарбонатной жесткости. Таблица 2. Классификация воды по общей жесткости
§ 2. Методика экспериментаБюретку на 50 мл заполнили раствором 0,1 моль/л «трилона Б». Мерной пипеткой отобрали в две чистые колбы для титрования по 100 мл водопроводной воды и добавили в них по 5 мл аммиачного буферного раствора для поддержания щелочной среды с pH = 10, а также сухого индикатора на кончике шпателя — эриохрома черного. Растворы тщательно перемешали. Одну из колб использовали далее в качестве контрольного образца для сравнения окрасок растворов. Раствор во второй колбе титровали «трилоном Б» при тщательном перемешивании до изменения окраски. Выждали 1 — 2 мин, продолжая перемешивать раствор. Окраска снова приобрела красноватый оттенок, довели ее до синего цвета, добавив несколько капель титрующего раствора. Далее изменение окраски со временем больше не происходило, считали это состояние точкой эквивалентности. Опыт повторяли дважды. Для определения временной жесткости воды в колбу отмерили пипеткой 50 мл исследуемой воды. Ввели 1-2 капли раствора метилоранжа. Титровали пробу из бюретки 0,1 н раствором HCl до перехода окраски из жёлтой в оранжевую. Опыт повторили. Расчёт временной жёсткости воды производится по формуле: 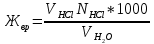 где Жвр — временная жёсткость воды, ммоль/л. VHCl — объём стандартного раствора HCl, израсходованный на титрование, мл. NHCl — нормальность стандартного раствора HCl (титранта). VH2O — объём пробы исследуемой воды, мл. § 3. Результаты экспериментаДля вычисления карбонатной и общей жесткости воды необходимо обратиться к закону эквивалентов: 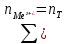 где nT - количество (моль) титрующего вещества, т.е. HCl и Na2H2ЭДТА. Поскольку ni = CiVi , где Ci — молярная объемная концентрация, а Vi — объем соответствующего (i-го) раствора, имеем: 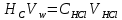 и и 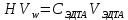 В нашей работе для эксперимента были взяты следующие образцы воды: питьевая вода «Пилигрим Ледники Северного Кавказа» (№1), родниковая вода (№2), водопроводная вода (№3), колодезная вода из дачного поселка фильтрованная (№4) и нефильтрованная (№5). Образец воды №4 был профильтрован при помощи специального фильтра марки «Аквафор». Титрование проводилось при помощи комплексона — трилон — Б, а также с различными индикаторами (метиловый оранжевый, эрихром черный Т) Таблица 3. Результаты эксперимента
Таблица 4. Показатели жесткости различных образцов воды
Как видно из таблицы 3, самый низкий общий уровень жесткости воды присущ питьевой бутилированной воде и составляет 3,1 ммоль/л. Также из данных таблицы видно, что наиболее высокий показатель жесткости имеет вода из-под крана. Ссылаясь на таблицу 2, можно сделать вывод, что вода из-под крана является очень жесткой, а фильтрованную воду из колодца и родниковую воду можно отнести к водам средней жесткости. В данном эксперименте мы можем вычислить некарбонатную жесткость для всех использованных нами образцов воды. Таблица 5. Показатели некарбонатной жесткости воды
ВыводыПри выполнении работы был проведен анализ общей и карбонатной жесткости методом комплексонометрии. Для анализа были использованы разные типы воды, а также было выявлено, какие из них являются мягкими, а какие жесткими типами воды. Чтобы эти показатели снизились, необходимо применять определенные методы, которые обуславливают устранение жесткости, например, можно использовать фильтр для воды, а также существуют различные методы по устранению жесткости. Высокая концентрация кальция и магния в питьевой воде пагубно влияет на ее качество, она становится не пригодная для использования. Список литературыАлексеев, В. Н. Количественный анализ / В. Н. Алексеев ; под ред. П. К. Агасяна. — 4-е изд., перераб. и доп. — М. : Химия, 1972. — 504 с. Завражнов А. Ю. Практикум по неорганической химии. Химия s- и sp-элементов : учеб. пособие для вузов / А. Ю. Завражнов, А. В. Наумов, А. В. Косяков ; Воронежский государственный университет. — 2-е изд., испр. и доп. — Воронеж : Издательский дом ВГУ, 2016. — 236 с. Жёсткость воды и её определение: Методические указания по химии для студентов 1 курса дневной и заочной форм обучения / Каз.гос.арх.– строит. Академия / Сост. Н. С. Громаков, Казань, 2003. — 7с. Определение жёсткости воды и умягчение воды реагентным методом: Методические указания / Сост. Чуриков Ф. И., Казань ; КИСИ, 1986. Основы объёмного (титриметрического) анализа. Титрование : Методические указания / Сост. Громаков Н. С., Казань ; КГАСА, 1997. Васильев В. П. Аналитическая химия. Кн. 1: Титриметрические и гравиметрические методы анализа / В. П. Васильев. — Москва : Дрофа, 2005. Лурье Ю. Ю. Аналитическая химия промышленных сточных вод / Ю. Ю. Лурье. — Москва : Химия, 1984. — 448 с. Крешков А. П. Курс аналитической химии. Количественный анализ / А. П. Крешков, А. А. Ярославцева. – Москва : Химия, 1982. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
