ФЭК. Л.Р. 1-Концентрацион. колориметрич.й анализ. Лабораторная работа мбф1 Определение концентрации вещества и скорости изменения оптической плотности вещества с помощью колориметра
 Скачать 267.5 Kb. Скачать 267.5 Kb.
|
Концентрационный колориметрический анализЛАБОРАТОРНАЯ РАБОТА № МБФ-1 Определение концентрации вещества и скорости изменения оптической плотности вещества с помощью колориметра Приборы и принадлежности: фотоэлектрический колориметр, исследуемые жидкости. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Свойство атомов и молекул поглощать свет определенных длин волн, характерных для данного вещества, широко используется в медицине и фармации для качественных и количественных исследований. Прохождение света в любом веществе сопровождается уменьшением интенсивности светового потока. Причиной этого является расходование энергии световых волн на возбуждение атомов и молекул вещества, приводящее к излучению вторичных световых волн, или на переход в другие виды внутренней энергии (например, тепловой эффект). Данный процесс называют поглощением света. Таким образом, поглощение света – это ослабление интенсивности света при прохождении его через вещество вследствие превращения световой энергии в другие виды энергии.
Рис. 1. Прохождение света через однородный объект. Для количественной оценки явления направим на объект из однородного вещества толщиной d параллельный поток монохроматического света (рис. 1). При прохождении света через образец происходит ослабление интенсивности света от 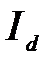 . Выделим в объекте элементарный (тонкий) слой толщиной dx. Изменение интенсивности света dI для этого слоя зависит от интенсивности I падающего светового потока (количество квантов, падающих слева на поверхность слоя dx в единицу времени), оптических свойств k среды (количество столкновений квантов с молекулами вещества, пропорциональное числу молекул на пути светового потока), и толщины dx слоя: . Выделим в объекте элементарный (тонкий) слой толщиной dx. Изменение интенсивности света dI для этого слоя зависит от интенсивности I падающего светового потока (количество квантов, падающих слева на поверхность слоя dx в единицу времени), оптических свойств k среды (количество столкновений квантов с молекулами вещества, пропорциональное числу молекул на пути светового потока), и толщины dx слоя: . (1) . (1)Знак «минус» показывает, что световой поток уменьшается. Уравнение (1) представляет собой линейное дифференциальное уравнение первого порядка. Решив это дифференциальное уравнение (1), определим закон поглощения света. Для этого используем метод разделения переменных, при этом интегрируем слева от I0до Id , а справа от 0 до d. В окончательном виде получим закон Бугера 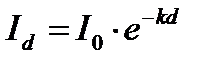 (2) (2)Закон Бугера можно записать через показательную функцию с основанием 10:  , где k¢» 0,43k . (3) , где k¢» 0,43k . (3)Однако в медицине преимущественное значение имеет измерение поглощения света не в твердых однородных образцах, а в окрашенных жидкостях. В этом случае коэффициент поглощения k зависит не только от природы растворенного вещества и длины световой волны λ, но и от концентрации C этого вещества в растворе, что определяется законом Бэра:  , (4) , (4)где Kλ- показатель поглощения света на единицу концентрации С вещества (зависит от природы растворенного вещества и от длины волны падающего света). Поэтому поглощение света окрашенными растворами описывает уравнение, известное как закон Ламберта - Бэра: интенсивность светового потока, проходящего через вещество, экспоненциально уменьшается в зависимости от длины оптического пути и концентрации вещества в образце. Математическая запись этого закона имеет вид: 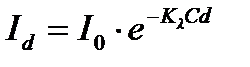 , ,где Id – интенсивность света, прошедшего через раствор; I0 – интенсивность света, падающего на раствор; e – основание натурального логарифма; C – концентрация раствора; d – толщина слоя раствора, или 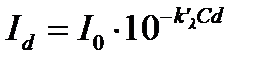 , где k¢l» 0,43Kl . , где k¢l» 0,43Kl .График изменения интенсивности света Id в зависимости от толщины слоя среды d, через которую проходит свет, показан на рис. 2 (экспоненциальная кривая).  Рис. 2. Зависимость интенсивности светового потока Id, прошедшего через раствор, от толщины d слоя среды. Для характеристики поглощения света в образце применяют физические величины: · Коэффициент пропусканияτ, равный отношению интенсивности Id потока, прошедшего через объект, к интенсивности I0 светового потока, падающего на него: 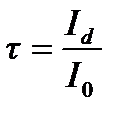 . (5) . (5)Значения · Оптическая плотность(экстинкция) D, равная десятичному логарифму отношения интенсивности I0 света, падающего на объект, к интенсивности Id света, прошедшего через него: 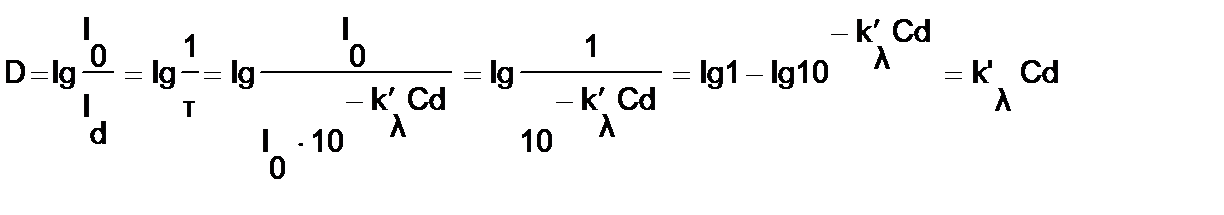 . (6) . (6)Как видно из формулы (6), когда коэффициент пропускания В этом случае закон Ламберта-Бера можно сформулировать следующим образом: оптическая плотность образца прямо пропорциональна концентрации вещества в образце и длине светового пути. В уравнении (6) величина k¢l называется молярным коэффициентом поглощения. Если  и и 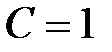 , то , то  , т. е. это оптическая плотность образца толщиной в одну единицу (1 см) при концентрации вещества 1 моль/л. , т. е. это оптическая плотность образца толщиной в одну единицу (1 см) при концентрации вещества 1 моль/л.Оптическая плотность показывает поглощательную способность вещества. Поглощение тем больше, чем больше отношение 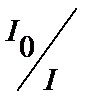 , т. е. чем больше оптическая плотность. , т. е. чем больше оптическая плотность.Вещество неодинаково поглощает свет различных длин волн. Кривая зависимости оптической плотности вещества от длины волны поглощаемого света называется спектром поглощения. Обычно спектры поглощения молекул имеют непрерывный характер, но обнаруживают максимумы на той длине волны света, где имеется максимальное поглощение квантов света. На рис. 3 приведены спектры поглощения некоторых биологически важных соединений, поглощающих свет в видимой и ультрафиолетовой областях солнечного спектра. Белки имеют максимум поглощения на длине волны 280 нм, нуклеиновые кислоты—в районе 260 нм, родопсин— 500 нм, хлорофилл имеет два максимума поглощения: 430 и 680 нм. 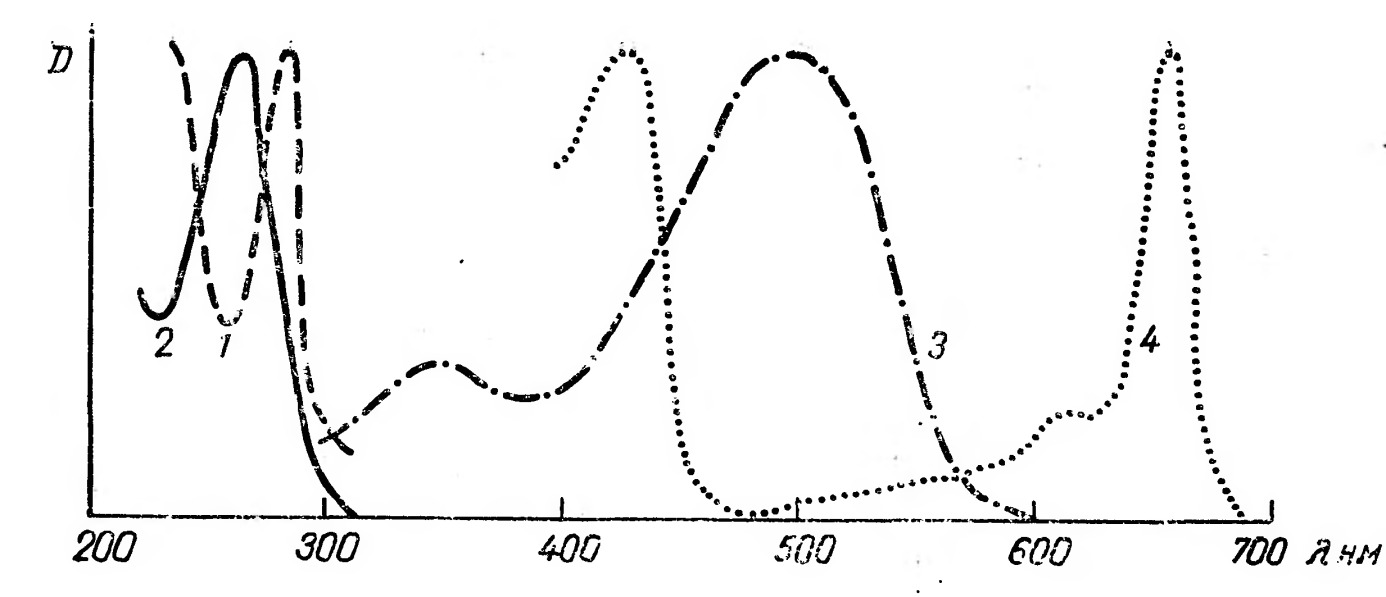 Рис. 3. Спектры поглощения некоторых биологически важных соединений (1 — белок; 2 — ДНК; 3 — родопсин; 4 — хлорофилл). Как видно из рисунка 3, спектры поглощения имеют иногда довольно сложный вид, характерный для данного вещества и зависящий от структуры и свойств молекул данного вещества. Изучение спектров поглощения какого-либо фотобиологического процесса позволяет выяснить, какое вещество ответственно в данном процессе за поглощение света. Это достигается в результате сравнения спектров исследуемого процесса и спектров известных веществ. Кроме этого, по положению максимумов на шкале длин волн можно определить длину волны света, преимущественно поглощаемого этим веществом. Знание длины волны поглощаемого света позволяет определить энергию поглощаемых квантов. А по величине энергии поглощаемых квантов можно рассчитывать расположение электронных и колебательных энергетических уровней молекулы, а также переходы молекул из одного энергетического состояния в другое. Кроме всей этой информации, величина оптической плотности дает сведения о концентрации вещества в исследуемой пробе. По величине максимумов поглощения на основании уравнения (6) можно делать заключения о концентрации вещества в исследуемом объекте. Спектры поглощения можно измерять различными приборами. В видимом диапазоне (380-760 нм) спектр поглощения определяет цвет вещества, поэтому прибор для измерения спектров называется колориметром (от лат. color - цвет). Современные колориметры позволяют производить измерения в более широком спектральном диапазоне – от ультрафиолета до ближнего инфракрасного (315-980 нм). Фотоколориметрический анализ широко используется в медико-биологических исследованиях. С его помощью определяют концентрации в крови: · эритроцитов (клеток, обеспечивающих транспорт в организме кислорода и углекислого газа), · гемоглобина (белка, заполняющего эритроциты и играющего основную роль в транспорте газов), · оксигемоглобина (характеризующего уровень насыщения крови кислородом). Кроме того, с помощью биохимических реакций, вызывающих избирательное окрашивание веществ, определяют в биологических материалах концентрацию белков, липидов, углеводов, гормонов и других веществ. А также определяют водородный показатель (рН) среды по цвету добавленных в раствор рН-индикаторов, активность ферментов по интенсивности окрашивания раствора после добавления соответствующих химических реагентов, дающих окрашенные реакции с продуктами ферментативной реакции (например, оценивают активность АТФ по скорости образования неорганического фосфата), скорость роста микроорганизмов по увеличению оптической плотности культуральной жидкости вследствие рассеяния света на микроорганизмах. Концентрационный колориметрический анализ Пусть интенсивность падающего светового потока I0, длина световой волны λ, природа вещества и толщина слоя раствора d будут в эксперименте постоянными, а изменяются только концентрации растворов. Тогда, согласно закону Бугера-Ламберта-Бэра, между интенсивностью Id света, прошедшего через раствор, и концентрацией С раствора будет иметь место функциональная зависимость: Id = f(C), при этом каждому значению концентрации вещества в растворе будет соответствовать определенная интенсивность прошедшего через раствор светового потока. Этот эффект и является основой концентрационного колориметрического анализа – определения концентрации окрашенных растворов по поглощению света этими растворами. Для изучения оптических характеристик (коэффициента пропускания, оптической плотности) окрашенных растворов используют фотоэлектроколориметр (ФЭК). Термин «фотоэлектроколориметр» означает, что это прибор для измерения цвета (колориметр), в котором оптическое излучение (фото) преобразуется в электрический сигнал (электро). Фотоколориметр применяется в лабораториях лечебных учреждений для определения в крови и в моче сахара, билирубина, глюкозы, холестерина, креатина; в лабораторно-производственном контроле качества воды перед поступлением её в сеть по химическим показателям, наличию железа, серебра и т.д. Фотоэлектроколориметр состоит из следующих основных блоков (рис. 4): источника света (И), светофильтров (СФ), двух кювет: К1 - кюветы сравнения, заполненной растворителем, и К2 - кюветы для исследуемого раствора, полупрозрачного зеркала (3), расщепляющего прошедший пучок света на два фотоэлемента (Ф1) и (Ф2). Рис. 4. Принципиальная оптическая схема фотоэлектроколориметра Источник света создает излучение в широком диапазоне длин волн, светофильтр выделяет из него нужный участок спектра. Этот свет далее проходит либо через кювету (К2), в которую помещают исследуемый раствор, либо через кювету сравнения (К1), в которой находится растворитель. Пучок света, прошедший через кювету, расщепляется полупрозрачным зеркалом на два пучка, интенсивности которых регистрируются фотоприемниками Ф1 и Ф2. Два фотоприемника используются для измерений в разных участках спектра. Оптическая схема фотоэлектроколориметра типа КФК-2МП, используемого в работе, естественно, существенно сложнее. Кроме того, в этом приборе применяется микропроцессорная система для получения и обработки данных. Фотоэлектроколориметр (рис. 5) конструктивно состоит из колориметрического блока (1) и вычислительного блока (2), в котором размещена микропроцессорная система (МПС). В колориметрическом блоке (1) размещен источник света и 11 стеклянных светофильтров, вмонтированных в диск. Нужный светофильтр вводится в световой пучок поворотом диска (ручка (3)). Рабочее положение каждого светофильтра фиксируется. Рис. 5. Блок-схема колориметра КФК-2МП Длина волны, которую пропускает данный фильтр, отсчитывается на ручке (3) против белой риски, нанесенной на корпус прибора. В кюветном отделении (4) в кюветодержателе, устанавливаемом на подвижный столик, располагают кюветы. Кюветодержатель устанавливают так, чтобы две маленькие пружины находились со стороны источника света. Ввод в световой пучок той или иной кюветы осуществляют перемещением ручки (5) влево или вправо до упора (положение «1» или «2»). В положении «1» в световой пучок вводится кювета с растворителем, в положении «2» - с исследуемым раствором. Кюветное отделение закрывается крышкой (6). При открытой крышке специальная шторка перекрывает световой пучок, чтобы не засвечивать фотоприемники. Дело в том, что фотоприемники даже в отсутствии освещения дают на выходе «темновой» сигнал, свойства которого меняются после изменения освещенности и искажают результаты измерений. Поэтому при открытом кюветном отделении световой пучок перекрывают, а после закрытия крышки необходимо подождать некоторое время, прежде чем производить измерения. Переключение фотоприемников для регистрации в фиолетовой или красной областях спектра осуществляют с помощью ручки (7). В вычислительный блок 2 (рис. 5) входит микропроцессорная система (МПС). На передней панели МПС расположены клавиатура, цифровое табло и два сигнальных светодиода. Клавиатура состоит из 24 клавиш. Клавиша «пуск» предназначена для запуска микропроцессорной системы. Клавиши «b» и «с» предназначены для вызова на цифровое табло из памяти МПС значений соответствующих коэффициентов для их контроля или ввода новых значений. Клавиша «Сбр» (сброс) предназначена для стирания значения вызванного коэффициента (в случае необходимости задания нового значения). Клавиши «О», «1-9», «–» «,» предназначены для набора на цифровом табло МПС нового значения коэффициента «b» или «с». Клавиша «УТВ» (утверждение) предназначена для записи в память МПС нового значения коэффициента, набранного на цифровом табло. Клавиши «К(1)», «т(2)», «D(5)», «C(4)» предназначены для выполнения калибровки прибора, т.е. установки 100%-го пропускания, измерений коэффициента пропускания, оптической плотности исследуемого вещества, концентрации вещества в растворе. Клавишей «А(3)» производится измерение активности. Клавиша «Ц/Р» предназначена для перевода МПС в один из двух режимов выполнения измерений: режим одиночных (разовых «Р») измерений или режим циклических (Ц) измерений. В режиме одиночных измерений измерения выполняются один раз при нажатии соответствующей клавиши, в режиме циклических измерений первое измерение производится при нажатии соответствующей клавиши, затем они повторяются циклически с периодом 5 секунд до тех пор, пока МПС не будет переведена в режим выполнения одиночных измерений. Перевод МПС из режима циклических измерений в режим одиночных измерений и обратно происходит при нажатии клавиши «Ц/Р». Сигнальный светодиод «Ц» и сигнальный светодиод «Р» служат для указания режима измерения. В режиме одиночных измерений горит светодиод «Р», в циклическом - горит светодиод «Ц». Цифровое табло состоит из 6 индикаторов. Первый индикатор служит для отображения одного из символов «1», «2», «3», «4», «5», «0», появляющегося при нажатии одной из клавиш «К (1)», «т(2)», «А (3)», «С (4)», «D (5)» соответственно и при проверочном измерении «нулевого отсчета» «Ш (0)», т.е. темнового отсчета при перекрытом световом потоке. Индикаторы 2–6 служат для вывода результатов измерений и значений параметров «с» и «b». Принцип действия колориметра основан на поочередном измерении светового потока F0, прошедшего через растворитель, по отношению к которому производится измерение и потока F, прошедшего через исследуемую среду. Световые потоки F0, F фотоприемниками преобразуются в электрические сигналы U0 и U, которые обрабатываются микроЭВМ колориметра. Результаты представляются на цифровом табло в виде коэффициента пропускания, оптической плотности, концентрации, активности. С помощью микроЭВМ рассчитывается коэффициент пропускания исследуемого раствора по формуле 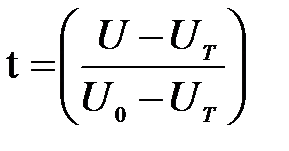 ,где ,где  - величина темнового сигнала при перекрытом световом потоке. - величина темнового сигнала при перекрытом световом потоке.Оптическая плотность исследуемого раствора рассчитывается по формуле  . .Измерение концентрации исследуемого раствора на колориметре возможно при соблюдении основного закона светопоглощения, закона Бугера-Ламберта-Бера, т.е. при линейной зависимости оптической плотности  исследуемого раствора от концентрации исследуемого раствора от концентрации Концентрация исследуемого раствора рассчитывается ЭВМ по формуле 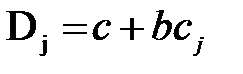 ,где с, b - коэффициенты, определяемые по градуировочной характеристике. ,где с, b - коэффициенты, определяемые по градуировочной характеристике.Выполнение работы Внимание! Микропроцессорная система (МПС), как и любая ЭВМ, работает строго по программе. При выполнении команд описания типа «открыть крышку» или «закрыть крышку» срабатывают специальные микропереключатели, которые включают нужные разделы программы, поэтому обращайте внимание на точное выполнение подобных команд. Микропроцессорная система (МПС) представляет собой универсальное устройство, с этим связано использование двойных обозначений для каждого параметра: буквенного и цифрового. 1. Подсоедините колориметр к сети 220 В, 50/60 Гц, откройте крышку кюветного отделения и включите тумблер «сеть», при этом должна загореться сигнальная лампа. Нажмите клавишу «пуск» - на цифровом табло появится мигающая запятая и включится индикатор «Р». Если запятая не появилась - повторно нажмите «пуск». Выдержите колориметр во включенном состоянии в течение 5 мин. при открытой крышке кюветного отделения. В процессе прогрева прибора измерьте диапазон длин волн, видимых глазом человека. Вращая рукоятку выбора светофильтра, установите светофильтр 340 нм. Поместите в кюветное отделение около выхода светового пучка после светофильтра лист белой бумаги. Переключая рукоятку выбора светофильтра в сторону увеличения длин волн, зафиксируйте момент, когда появится цветное пятно на бумаге, запишите соответствующее значение длины волны. Затем увеличивайте далее длину волны, отмечая длины волн, соответствующие голубому, зеленому, оранжевому и красному излучению. При дальнейшем вращении зафиксируйте момент, когда изображение пятна пропадет - это граница инфракрасного излучения. Составьте таблицу длин волн, соответствующих границам восприятия глаза человека, а также указанным выше цветам. 2. Крышку кюветного отделения закройте и откройте. По истечении 5 секунд нажмите клавишу «Ш (0)». На цифровом табло справа от мигающей запятой высветится значение нулевого отсчета n0, а слева - символ «0». Значение n0 должно быть не менее 0,001 и не более 1,000. Задание 1. В режиме одиночных измерений - горящий индикатор «Р» - произведите определение длины волны максимума поглощения исследуемого вещества. 1) заполните первую кювету растворителем (до метки), вторую кювету (до метки) раствором с известной наименьшей концентрацией, откройте крышку кюветного отделения, поместите кюветы в кюветодержатель: растворитель в дальнее от оператора гнездо держателя (положение 1), раствор - в ближнее (положение 2). Внимание! Кюветы следует удерживать руками за верхние (выше метки) нерабочие поверхности. Кюветы следует заполнять жидкостью до метки. Рабочие поверхности кювет перед каждым опытом следует тщательно протирать сухой чистой тканью или тканью, смоченной спирто-эфирной смесью. После смены светофильтра, после длительного (более 5 мин.) состояния колориметра с открытой крышкой кюветного отделения (при этом шторка перекрывает световой поток от источника к фотоприемнику) следует перед измерением выдержать фотоприемник 5 мин. при закрытой крышке. 2) Ручкой 3 установите светофильтр 315 нм. Ручкой 7 установите соответствующий фотоприемник «315-540». 3) Крышку кюветного отделения закройте и откройте. По истечении 5 с нажатием клавиши «Ш (0)» произведите проверку «нулевого отсчета». 4) Ручку 5 переведите в положение «1». Закройте крышку кюветного отделения. Через 1 мин. нажмите клавишу «К (1)». На цифровом табло слева от мигающей запятой загорится символ «1». 5) Ручку 5 переведите в положение «2». Нажмите клавишу «D (5)». На цифровом табло слева от мигающей запятой появится символ «5», справа отсчет оптической плотности. Последовательно устанавливая ручкой 3 светофильтры 340 нм, 400 нм, 440 нм, 490 нм, 540 нм и т. д., аналогично проведите измерение оптической плотности. Результаты запишите в таблицу:
Внимание! Перед каждым видом измерений (коэффициент пропускания, оптическая плотность, концентрация, активность) и при переключении фотоприемников следует провести проверку «нулевого отсчета» и при необходимости его регулировку. 6) Ручкой 3 установите светофильтр 590 нм. Ручкой 7 установите соответствующий фотоприемник «590-980». Проведите измерение оптической плотности аналогично для светофильтров 670 нм, 750 нм. Результаты запишите в указанную таблицу. 7) Определите длину волны, соответствующую максимуму поглощения (на ее основе выбираем фильтр для выполнения 2 задания). Задание 2. В режиме одиночных измерений - горящий индикатор «Р» - произведите определение концентрации вещества в растворе по градуировочному графику. 1) При открытой крышке кюветного отделения заполните первую кювету растворителем (до метки), вторую кювету (до метки) раствором с известной наименьшей концентрацией. Поместите кюветы в кюветодержатель: растворитель в дальнее от оператора гнездо держателя (положение «1»), раствор в ближнее (положение «2»). Держатель с кюветами установите в кюветное отделение. Ручкой 3 установите светофильтр, соответствующий длине волны максимума поглощения. Ручкой 7 установите соответствующий фотоприемник. 2) Крышку кюветного отделения закройте и откройте. По истечении 5 с нажатием клавиши «III (0)» произведите проверку «нулевого отсчета». 3) Ручку 5 переведите в положение «1». Закройте крышку кюветного отделения. Через 1 мин. нажмите клавишу «К (1)». На цифровом табло слева загорится символ «1». Ручку 5 переведите в положение «2». Нажмите клавишу «D(5)». На цифровом табло слева от мигающей запятой появится символ «5», справа - отсчет оптической плотности. Результаты запишите в таблицу:
Аналогично проведите измерения оптических плотностей всех растворов известной концентрации и исследуемого раствора неизвестной концентрации. Результаты запишите в таблицу. 4) По значениям оптической плотности для растворов известных концентраций (не менее 3 растворов) постройте градуировочный график. По градуировочному графику определите значение концентрации Задание 3. В режиме циклических измерений - горящий индикатор «Ц» - произведите определение оптической плотности D мутного раствора с периодом 5 с в течение 15 минут (примерно 180 точек). 1) При открытой крышке кюветного отделения заполните первую кювету растворителем (до метки), вторую кювету (до метки) мутным раствором. Поместите кюветы в кюветное отделение: растворитель в дальнее от оператора гнездо держателя (положение «1»), раствор в ближнее (положение «2»). Ручкой 3 установите светофильтр, соответствующий длине волны, на которую приходится максимум поглощения вещества. Ручкой 7 установите соответствующий фотоприемник. 2) Откройте крышку кюветного отделения, нажмите клавишу ПУСК, затем «Ц/Р» (чтобы задать режим работы «Ц») и «Ш (0)». На цифровом табло слева от мигающей запятой высвечивается символ «0», справа — значение п0. 3) Закройте крышку кюветного отделения, нажмите клавишу «К (1)», на цифровом табло слева от мигающей запятой высвечивается символ «1». 4) Поворотом ручки 5 из положения «1» в положение «2» введите в световой пучок кювету с исследуемым раствором. 5) Нажмите клавишу «Д (5)». На цифровом табло слева от мигающей запятой появляется символ «5», а справа с интервалом не менее 5 с, высвечиваются значения измеренной величины оптической плотности D. 6) Запишите все значения оптической плотности D в таблицу
7) Постройте на компьютере и распечатайте график зависимости оптической плотности от времени  . .8) Вычислите  . Постройте график зависимости . Постройте график зависимости  . Определите по графику скорость изменения оптической плотности вещества. . Определите по графику скорость изменения оптической плотности вещества.Контрольные вопросы 1. Какое явление называют поглощением света? 2. Дайте определение спектра поглощения вещества. 3. Как связаны интенсивность света, прошедшего через слой вещества, и интенсивность света, падающего на этот слой? 4. Сформулируйте законы Бугера, Бэра и Бугера– Ламберта – Бэра. 5. Что характеризует коэффициент пропускания? По какой формуле его определяют? В каких пределах могут изменяться его численные значения? 6. Дайте определение физической величины «оптическая плотность». 7. Напишите формулу определения оптической плотности. В каком интервале принимает численные значения этот параметр? 8. Укажите связь оптической плотности и коэффициента пропускания. 9. Что называется колориметрическим анализом? 10. На каком физическом явлении основан принцип работы фотоэлектроколориметра? 11. Рассмотрите оптическую схему фотоэлектроколориметра и объясните принцип его работы. Почему в этой схеме используются два фотоприемника? 12. Объясните роль светофильтра в приборе, его необходимость. 13. Рассмотрите ход выполнения измерений с помощью фотоэлектроколориметра. 14. Расскажите о применении фотоколориметрического анализа в медико-биологических исследованиях. Приведите практические примеры. Литература 1. Блохина М.Е., Эссаулова И.А., Мансурова Г.В. Руководство к лабораторным работам по медицинской и биологической физике. – М.: Дрофа, 2001. – 286 с. 2. Васильев В.П., Морозова Л.А., Кочергина Л.А. Практикум по аналитической химии. – М.: Химия, 2000. – 328 с. 3. Губанов Н.И., Утепбергенов А.А. Медицинская биофизика. – М.: «Медицина», 1978. – 336 с.. 4. Добро Л.Ф., Богатов Н.М. Биофизика: лабораторный практикум. – Краснодар: Кубан. гос. ун-т, 2009. – 98 с. 5. Ландсберг Г.С. Оптика. – М.:ФИЗМАТЛИТ. 2003. – 848 с. (стр.513-520). 6. Ливенцев Н.М. Курс физики. – М.: Высшая школа, 1978. –Т.1. – С. 236-241. – Т. 2. – С. 17-20. 7. Ремизов А.Н. Медицинская и биологическая физика. – М.: Высшая школа, 1987. – С. 516 –518, 521- 524; М.: Высшая школа, 1999. – С. 530-534. 8. Ремизов А.Н. Курс физики, электроники и кибернетики для медицинских институтов. – М.: Высшая школа, 1982. – С. 351-354. 9. Эссаулова И.А., Блохина М.Е., Гонцов Л.Д. Руководство к лабораторным работам по медицинской и биологической физике. – М.: Высшая школа, 1987. – С. 236-342. ... |
