Лабораторная Информатика. Лабораторная работа Тепловой эффект химических реакций. Цель работы Определение опытным путем энтальпии растворения вещества
 Скачать 20.87 Kb. Скачать 20.87 Kb.
|
|
Лабораторная работа № 2. Тепловой эффект химических реакций. 1. Цель работы: Определение опытным путем энтальпии растворения вещества. 2. Рабочее задание: Определить экспериментально изменение температуры калориметрической жидкости в зависимости от времени. Рассчитать тепловой эффект реакции. 3. Общие сведения: 3.1. Основным законом термохимии является закон Гесса: «Тепловой эффект химической реакции зависит только от начального и конечного состояний реагирующих веществ и не зависит от промежуточных стадий процесса». Следствием закона Гесса является соотношение: ΔΗ= Σni*ΔΗ2980 − Σni*ΔΗ2980 продуктов исходных веществ 3.2. Вопрос о самопроизвольном протекании реакции решается расчетным путем на основании уравнения: 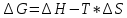 (1) (1)где: ΔG-изменение свободной энергии Гиббса кДж/моль; ΔН-изменение энтальпии, кДж/моль; ΔS-изменение энтропии Дж/моль*К; Т-абсолютная температура, К. О направлении химических реакций позволяет судить знак ΔG: ΔG<0 ( в химическом процессе происходит понижение свободной энергии Гиббса) - процесс может идти самопроизвольно. ΔG>0-процесс невозможен. ΔG=0-в системе устанавливается равновесие. Мерой неупорядоченности в системе является энтропия, вычисляемая по формуле: 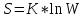 (2) (2)где: К - постоянная Больцмана; W - термодинамическая вероятность. Это число равновероятных микросостояний, которыми может быть реализовано данное макросостояние. Энтропия увеличивается с ростом беспорядка в системе. Термодинамические функции: 1. Энтальпия(ΔH) – это количество энергии, которое доступно для преобразования в теплоту при определенной температуре и давлении. 2.Энтропия(S) – это логарифмическое выражение вероятности существования системы. 3. Энергия Гиббса(ΔG) – величина, которая показывает изменение энтальпии (или тепловой эффект процесса), что зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути перехода 4. Внутренняя энергия(U)- название для той части полной энергии термодинамической системы, которая не зависит от выбора системы отсчета и которая в рамках рассматриваемой проблемы может изменяться. 4. Вывод: В процессе проведения работы мне удалось установить экспериментально изменение температуры калориметрической жидкости в зависимости от времени, а также рассчитать тепловой эффект реакции и определить опытным путем энтальпию растворения вещества. 5. Контрольные вопросы: 1. В чем, по вашему мнению, может быть причина расхождений между результатами ваших измерений и расчетов? По-моему мнению, главной причиной расхождения между результатами моих измерений и расчетами является округление температурных значений. 2. При каких химических реакциях измеренная энтальпия реакции равна энергии этой реакции? Энтальпия реакции равна энергии этой реакции, когда объем продуктов реакции равен объему исходных веществ (изменение объема в химической реакции равно нулю):  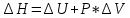 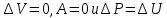 3.Вычислить стандартную энтальпию образования сероуглерода, по реакции сгорания 38г. сероуглерода: CS2+3O2=2SO2+CO2 ΔH= - 1103 кДж? CS2+3O2=2SO2+CO2 ΔH= - 1103 кДж 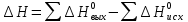 ΔH= (2ΔHoSO2+ΔHoCO2)-(ΔHoCS2+3ΔHoO2) ΔH= (2ΔHoSO2+ΔHoCO2)-(ΔHoCS2+3ΔHoO2)ΔHoO2=0 (табличное значение) ΔHoSO2=-296,9 кДж/моль ΔHoCO2=-393,5 кДж/моль ΔHoCS2=2ΔHoSO2+ΔHoCO2 - ΔH ΔHoCS2=2*(-296,9)+(-393,5) -(-1103)=115,7 кДж Ответ: ΔHoCS2=115,7 кДж. 4.Какие термодинамические функции вы знаете? Я знаю следующие термодинамические функции: 1. Энтальпия(ΔH); 2.Энтропия(S); 3. Энергия Гиббса(ΔG); 4. Внутренняя энергия(U). |
