Лабораторная работа Зависимость скорости реакции от концентрации реагирующих веществ и температуры
 Скачать 43.02 Kb. Скачать 43.02 Kb.
|
|
Лабораторная работа № 3. Зависимость скорости реакции от концентрации реагирующих веществ и температуры. 1.ЦЕЛЬ РАБОТЫ: Установить зависимость скорости реакции от концентрации реагирующих веществ . 2.РАБОЧЕЕ ЗАДАНИЕ: Проделать опыты. Ответить на контрольные вопросы. 3.ОБЩИЕ СВЕДЕНИЯ 3.1. ПОНЯТИЕ О СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ. Скоростью химической реакции (υ) называется изменение концентрации реагирующих веществ в единицу времени. По изменении концентрации одного из веществ, участвующих в реакции можно судить об изменении концентрации всех остальных веществ. Пусть за промежуток времени от   до до 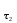 концентрации некоторых веществ изменились с концентрации некоторых веществ изменились с 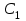 до до 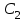 . Тогда средняя скорость реакции в среднем интервале времени равна: . Тогда средняя скорость реакции в среднем интервале времени равна: 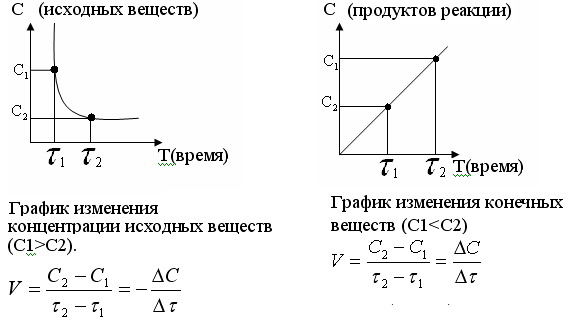 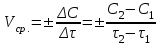 где: 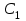 и и 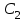 – концентрации веществ, [моль/л]; – концентрации веществ, [моль/л];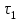 и и 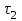 – время, [мин, сек]; – время, [мин, сек];υср – скорость реакции, [моль/л*сек; моль/см3*мин] Различают гомогенные и гетерогенные реакции. Реакции, протекающие в однородной среде, называют гомогенными. Эти реакции идут по всему объёму системы Гетерогенными называют реакции, идущие на поверхности соприкосновения твёрдого вещества и газа, твёрдого вещества и жидкости. 3.2. Факторы, влияющие на скорость химической реакции. 1. Влияние природы реагирующих веществ. Природа реагирующих веществ оказывает очень существенное влияние на скорость хим. реакций. Так, например, щелочные металлы натрий и калий с одним и тем же веществом – водой реагируют с разными скоростями. Атомы калия имеют большой радиус и поэтому свои электроны отдают гораздо энергичнее, чем атомы натрия, поэтому реакция калия идет гораздо быстрее. 2. Влияние концентрации реагирующих веществ. Пусть молекула вещества А реагирует с молекулой вещества В с образованием продукта реакции АВ в газовой смеси. А+В=АВ Для получения АВ из А и В необходимо, чтобы молекулы А и В прореагировали, т.е. столкнулись между собой. Без соударения вещества А В не получится. Скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, возведенных в степень их стехиометрических коэффициентов – это закон действующих масс. Математический закон выражается так: аА+вВ=сС  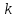 – коэффициент пропорциональности, константа скорости реакции. Коэффициент – коэффициент пропорциональности, константа скорости реакции. Коэффициент 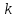 численно равен скорости реакции при концентрации каждого из реагирующих веществ равной 1моль/л, или когда произведение концентраций равно единице. численно равен скорости реакции при концентрации каждого из реагирующих веществ равной 1моль/л, или когда произведение концентраций равно единице.а и в – стехиометрические коэффициенты. В случае гетерогенных реакций в уравнение закона действующих масс входят концентрации только жидких и газообразных веществ. Концентрация твердого вещества величина постоянная, поэтому не входит в константу скорости К. Например, для реакции горения угля: С(тв.)+О2=СО2(газ)  3. Влияние температуры на скорость реакции. Зависимость скорости реакции от температуры выражается правилом Вант - Гоффа: при увеличении температуры на каждые 10°С скорости реакции возрастает в 2-4 раза. Ход работы. Опыт 1. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ. Реакция тиосульфата натрия Na2S2O3 с серной кислотой протекает по уравнению: Na2S2O3+H2SO4=Na2SO4+S↓+H2SO3 Соответствующие объемы воды серной кислоты и тиосульфата натрия отмеряем мерным цилиндром. Растворы сливаем в одну пробирку и смешиваем быстрым движением, взбалтыванием. С этого момента до начала реакции измеряем время по секундомеру. Начало реакции указываем появление в растворе мути. Опытные данные вносим в таблицу 1. Таблица 1
v – скорость хим. реакции v1 = V(Na2S2O3 )/t1=15/84=0,179 v2=V(Na2S2O3 )/t2=10/137=0,073 v3=(Na2S2O3 )/t3=5/240=0,021 Вывод: Я опытным путем установила зависимость скорости реакции от концентрации реагирующих веществ. Контрольные вопросы: 1. Что называется скоростью химической реакции? Скоростью химической реакции (υ) называется изменение концентрации реагирующих веществ в единицу времени. 2. Какова зависимость скорости реакции от концентрации реагирующих веществ? Скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, возведенных в степень их стехиометрических коэффициентов (это закон действующих масс). 3. Как называется величина К? Каков её физический смысл? К-константа скорости. Коэффициент К численно равен скорости реакции при концентрации каждого из реагирующих веществ равной 1моль/л, или когда произведение концентраций равно единице. 4. Зависит ли коэффициент К от изменения температуры? Коэффициент К зависит от изменения температуры, эта зависимость устанавливается уравнением Аррениуса: 5. Как влияет температура на скорость химической реакции? При увеличении температуры на каждые 10°С скорости реакции возрастает в 2-4 раза (правило Вант - Гоффа) 6. Как влияет давление на скорость химической реакции между газообразными веществами? Повышение давления смещает равновесие в сторону реакции, идущей с уменьшением объема и, наоборот, понижение давления - в сторону реакции, идущей с увеличением объема. |
