Лабораторная работа №17. Опытная проверка уравнения состояния и законов идеального газа.. Лабораторная работа 17 Опытная проверка уравнения состояния и законов идеального газа. Цель работы
 Скачать 99.5 Kb. Скачать 99.5 Kb.
|
|
Лабораторная работа №17 Опытная проверка уравнения состояния и законов идеального газа. Цель работы:Изучение физических свойств газов и взаимосвязи параметров, описывающих их состояние, на основе модели идеального газаПроверка уравнения состояния идеального газа. Определение предельного давления откачиваемого воздуха в вакуумной установке и объема рабочей камеры насоса. Приборы и принадлежности: два герметичных сосуда (1 и 2), манометр (3), механический насос (4), краны (5, 6, 7). Схема установки: 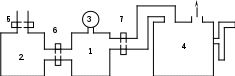 Т  еория: Под идеальным газом понимается совокупность непрерывно и беспорядочно движущихся точечных частиц конечной массы, столкновения между которыми происходят по закону абсолютно упругого удара, причем других способов взаимодействия между частицами нет, то есть силы взаимодействия на конечном расстоянии отсутствует. Давление, оказываемое идеальным газом на стенки сосуда, в котором он находится, определяется силами, возникающими при абсолютно упругих соударениях молекул со стенками. Рассмотрим одну из молекул, отражающихся от стенки сосуда (рис. 1). Величина средней силы еория: Под идеальным газом понимается совокупность непрерывно и беспорядочно движущихся точечных частиц конечной массы, столкновения между которыми происходят по закону абсолютно упругого удара, причем других способов взаимодействия между частицами нет, то есть силы взаимодействия на конечном расстоянии отсутствует. Давление, оказываемое идеальным газом на стенки сосуда, в котором он находится, определяется силами, возникающими при абсолютно упругих соударениях молекул со стенками. Рассмотрим одну из молекул, отражающихся от стенки сосуда (рис. 1). Величина средней силы А величина изменения импульса: где: m0 – масса молекулы υy – проекция скорости Но средняя сила Давление Р равно: Но Отсюда имеем: сомножитель Уравнение (7) называется основным уравнением молекулярно кинетической теории газов. Значит: где: K = 1,38∙10-23 Из уравнения (7) и (8)и получаем состояние идеального газа в виде: Общее число молекул в сосуде равно N = n0Y. Тогда: где: R = 8.31 Уравнение состояния идеального газа, представленного в виде (11) называется уравнением Менделеева – Клайперона. Т.к. R, m, μ не изменяются для взятого газа, то имеем: Из уравнения (14): T = const изотерма PV = const (Закон Бойля - Мариотта) P = const изобара V/T = const (Закон Гей - Люссака) V = const изохора P/T = const (Закон Шарля)
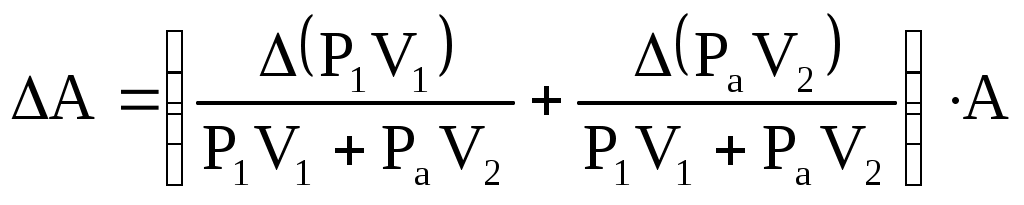 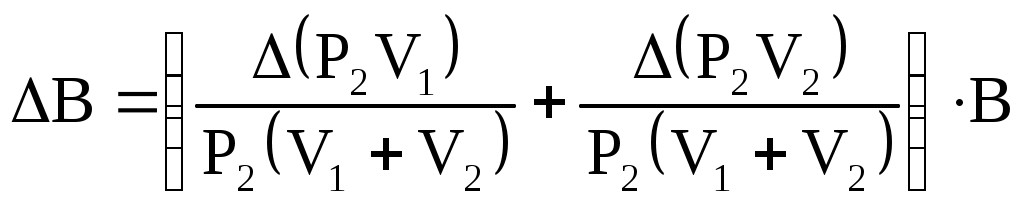 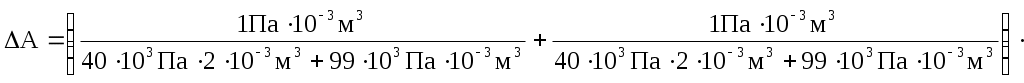
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
