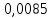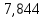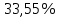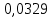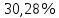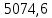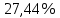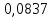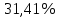Электрохимическое полирование. Лабораторная работа 5 Электрохимическое полирование нержавеющей стали Выполнили Гузаирова В. В. Мальчикова Е. В
 Скачать 32.04 Kb. Скачать 32.04 Kb.
|
|
МИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное учреждение высшего образования "Челябинский государственный университет" (ФГБОУ ВО "ЧелГУ") Химический факультет ЛАБОРАТОРНАЯ РАБОТА №5 Электрохимическое полирование нержавеющей стали
2020 Оборудование и реактивы: Выпрямитель, электролизер (стакан 500-800 мл, крышка с двумя катодами из нержавеющей стали, аноды из нержавеющей стали p=7,9г/см3), электрические провода, кристаллизатор. Электролит (60 масс % ортофосфорной кислоты с плотностью 1,63 г/см3; 20 масс % серной кислоты с плотностью 1,83 г/см3; 20 масс % воды). Процессы, происходящие на катоде: Fe2+ + 2ē → Fe 2H+ + 2ē → H2 На аноде: H2O - 2ē → 2H+ + ½ O2 Fe - 2ē → Fe2+ Fe = 7,9 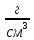 = 7,9106 = 7,9106  Ход работы: Поверхность образцов тщательно очистили от механических загрязнений, жировых и оксидных пленок. Обезжиривание проводили раствором NaOH с концентрацией 15 г/л в течение 20 мин. После обезжиривания электроды промыли водой и просушили в сушильном шкафу. Определили массу электродов на аналитических весах с точностью до 0,0001 г.
Собрали ячейку для электролиза. Установили нужные напряжения, и вели полирование в течение необходимого времени. Определили размеры электродов с точностью до 1 мм. S1 = 1,3*4*2 = 10,410-4 м2 S2 = 1,0*3,3*2 = 6,610-4 м2 S3 = 1,3*3,5*2 = 9,110-4 м2 S4 = 0,9*3,7*2 = 6,710-4 м2 S5 =1 ,1*3,3*2 = 7,310-4 м2 S6 = 1,0*3,5*2 = 7,010-4 м2 S7 = 1,4*3,5*2 = 9,810-4 м2 S8 =1 ,1*3,2*2 = 7,0410-4 м2 Рассчитали плотность тока, используя зафиксированные значения силы тока.
  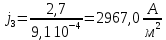   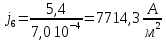 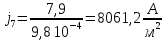 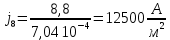 После обработки образцы вынули, промыли водой, высушили, взвесили и визуально определили качество полировки. Рассчитали разницу масс.
∆m1 практ. = 12,0743-12,0322 = 0,0421 г ∆m2 практ. = 9,0963 - 9,0554 = 0,0409 г ∆m3 практ. = 12,5883-12,4460 = 0,1423 г ∆m4 практ. = 9,9601 – 9,8789 = 0,0812 г ∆m5 практ. = 11,3555-11,2106 = 0,1449 г ∆m6 практ. =7,2731 – 7,1810 = 0,0921 г ∆m7 практ. = 6,7320 – 6,5948 = 0,1372 г ∆m8 практ. = 10,4961-10,3342 = 0,1619 г По закону Фарадея рассчитали теоретическую массу.
n = 2, исходя из процессов на аноде. F = 96500   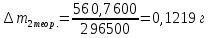 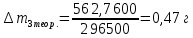 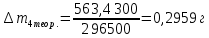 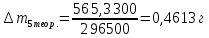  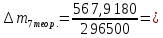 0,4126 г 0,4126 г Рассчитали выход по току.
 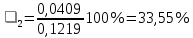   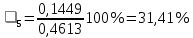 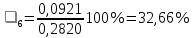  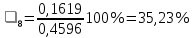 Рассчитали высоту отполированного слоя.
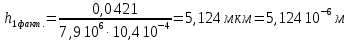   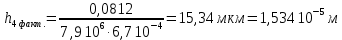  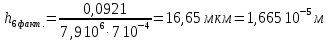   Рассчитали скорость полирования.
     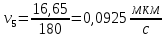   Результаты расчетов и измерений занесли в таблицу.
Построили график зависимости плотности тока от напряжения. 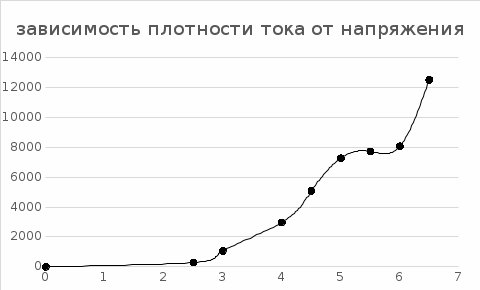 Вывод. Провели полирование образцов при различных напряжениях, определили выход по току. Из графика зависимости видим, что с увеличением напряжения плотность тока также возрастает. Однако на практике ряд других факторов ослабляет положительное действие плотности тока. К таким факторам относятся концентрационная поляризация, повышение напряжения на ванне, интенсивное выделение тепла в электролит. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

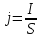
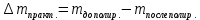
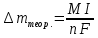
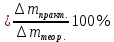
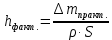

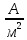
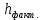 , мкм
, мкм