Изучи
Посмотри
Реши
Посмотри
Выполни
Заполни
Изучи
Посмотри
Изучи
Посмотри
|
Строение. Гомологический ряд этилена. Номенклатура.
Понятие об алкенах. Их состав, строение.
§70
Видео. Алкены. Гомологический ряд.
Видео. Строение, изомерия, номенклатура.
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой
CnH2n.
Исторически сложившееся название - этиленовые углеводороды, потому что первым представителем алкенов является этилен.
Ещё алхимики называли алкены олефинами (от лат. olefiant – «масло», так как при их гидрировании образовывались маслоподобные вещества). Но это название до сих пор широко используется в химической литературе.
Алкены довольно широко распространены в природе. Например, этилен является фитогормоном, который ускоряет созревание плодов. Насекомые выделяют феромоны, которые также являются алкенами. Натуральные экстракты растений содержат алкены в качестве основного компонента. В н Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными.
В небольшом количестве этилен содержится в природном газе и в попутных газах.
Задача. Выведите молекулярную формулу УВ, если известно, что массовая доля углерода в данном веществе составляет 87,5%, массовая доля водорода – 14,3%. Плотность данного вещества по водороду равна 14.
Презентация. История открытия этилена.
Впервые этилен был получен в 1669 г. немецким химиком Иоганном Иоахимом Бехером (1635–1682)… случайно! В одном из опытов он вместо добавления к нагретому купоросному маслу (концентрированной серной кислоте) еще одной его порции, в рассеянности, прилил винный спирт (этанол), который находился рядом в стакане. Бехер увидел сильное вспенивание раствора с выделением неизвестного газа, похожего на метан СН4. В отличие от метана новый газ горел коптящим пламенем и обладал слабочесночным запахом. Бехер установил, что его “воздух” более химически активен, чем метан. Так был открыт этилен С2Н4,
Бехер установил, что его “воздух” более химически активен, чем метан. Так был открыт этилен С2Н4.
Современники не смогли по достоинству оценить открытие учёного. Ведь Бехер не только синтезировал новый углеводород, но и впервые применил химический катализатор в процессе реакции. До этого в научной практике применялись только биологические катализаторы природного происхождения – ферменты. Этилен более 100 лет после его открытия не имел собственного названия.
Задание 1. Выразить строение этилена структурной формулой
Задание 2. Заполни таблицу.
Гибридизация
|
|
Вид связи
|
|
Кратность углерод-углеродной связи
|
|
Валентный угол
|
|
Длина связи
|
|
Насыщенность связи
|
|
Пространственное строение
|
|
Общая формула
|
|
Гомологический ряд алкенов.
Задание 3. Составить молекулярные формулы первых семи представителей ряда этена. Существует ли алкен с одним атомом углерода?
Номенклатура алкенов.
По систематической (международной) номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса - ан на - ен.
Правила составления названий алкенов по международной номенклатуре (ИЮПАК)
1.Найти наиболее длинную (главную) цепь углеродных атомов, которая содержит двойную связь и наибольшее число заместителей (ответвлений).

2. Пронумеровать атомы углерода главной цепи так, чтобы атом «С», у которого начинается двойная связь, имел наименьший номер. Т.е., с того края молекулы, к которому ближе расположена двойная связь.

3. Назвать заместители (алкильные радикалы) в алфавитном порядке и алкен, соответствующий главной цепи. Называть радикалы начинаем с наименьшего.

4. Цифрой указать положение двойной связи после названия главной цепи.

Примеры

Образование названий алкенов по номенклатуре ИЮПАК
Для простейших алкенов применяются также исторически сложившиеся названия:
этилен (этен),
пропилен (пропен),
бутилен (бутен-1),
изобутилен (2-метилпропен) и т.п.
В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкенов:

Запомни!!!
Названия одновалентных радикалов алкенов: - СН=СН2 (винил); –СН2–СН=СН2 (аллил ) Задание 3. Назовите непредельный углеводород.
СН2
||
СН3 – СН2 – СН2 – С– СН2 – СН3
Изомерия.
§ 70, стр. 85 – 87.
Видео. Цис-, Транс- изомерия.
Для алкенов характерна структурная и пространственная изомерия.
Структурная изомерия алкенов
Изомерия углеродного скелета (начиная с С4Н8).
Первые два члена гомологического ряда – этен и пропен – изомеров, относящихся к классу алкенов, не имеют.
Простейший алкен, для которого характерны структурные изомеры, — это бутен:

Изомерия положения двойной связи (начиная с С4Н8):
Межклассовая изомерия, начиная с С3Н6 (алкены изомерны другому классу соединений — циклоалканам):

Пространственная изомерия
Геометрическая или цис-транс изомерия
Цис-транс изомерия обусловлена различным положением заместителей относительно плоскости двойной связи.

Эти два изомера нельзя перевести друг в друга без вращения вокруг двойной связи С=С, а это вращение требует разрыва π-связи и затраты большого количества энергии. Поэтому цис- и транс-изомеры – это разные вещества, которые отличаются друг от друга физическими и химическими свойствами.
Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной связи в цис-изомере, либо по разные стороны в транс-изомере.

Алкены, у которых хотя бы один из атомов углерода при связи С=С имеет два одинаковых заместителя, не имеют цис-транс- изомеров.
Например,бутен-1 СН2=СН–СН2–СН3 не имеет цис— и транс-изомеров, т.к. первый атом С связан с двумя одинаковыми атомами Н.
Иногда цис-транс-изомерию не совсем точно называют геометрической изомерией. Неточность состоит в том, что все пространственные изомеры различаются своей геометрией, а не только цис— и транс— .
Вывод:
для алкенов характерна пространственная (цис-, транс -) изомерия.
цис-транс-изомерия возникает только в том случае, если каждый из атомов углерода, связанных двойной связью, соединён с разными атомами или группами атомов.
Задание 4. Упражнение 3, 4, 8. Стр. 88.
Свойства алкенов.
§70, 71.
Видео. Физические химические свойства.
Физические свойства алкенов.
Похожи на свойства алканов, хотя все они имеют несколько более низкие температуры плавления и кипения, чем соответствующие алканы.
Первые три представителя гомологического ряда алкенов – газы, углеводороды состава от C5Н10 до C16Н32 – жидкости, высшие алкены – твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Алкены нормального строения кипят при более высокой температуре, чем их изомеры, имеющие изостроение. Температуры кипения цис-изомеров выше, чем транс-изомеров, а температуры плавления — наоборот.
Алкены легче воды, практически нерастворимы в ней, но хорошо растворяются в органических неполярных растворителях. Этилен и пропилен горят коптящим пламенем.
Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, мало растворим в воде.


Химические свойства.
Алкены обладают большой реакционной способностью, чем алканы. Это обусловлено наличием в их молекулах двойной связи. π–Связь менее прочная, чем σ-связь. Она легко разрушается под воздействием различных реагентов.
Наличие подвижной, легко поляризуемой π–связи приводит к тому, что алкены легко вступают в реакции присоединения.
В реакциях присоединения двойная связь выступает как донор электронов, поэтому для алкенов характерны реакции электрофильного присоединения.
Реакции присоединения

Гидрирование или гидрогенизация (присоединение водорода)
Эта реакция протекает в присутствии катализатора – мелко раздробленного никеля, платины или палладия при нагревании и повышенном давлении.
При гидрогенизации олефины превращаются в предельные углеводороды.
Галогенирование (присоединение галогенов)
Присоединение галогенов по двойной связи С=С происходит легко при обычных условиях (при комнатной температуре, без катализатора). Образуются дигалогеналканы:
 
Реакция с бромной водой (р-р Br2 в Н2О) является качественной реакцией на наличие двойной связи. Происходит обесцвечивание красно-бурой окраски бромной воды.
Видеоопыт«Взаимодействие этилена с бромной водой»
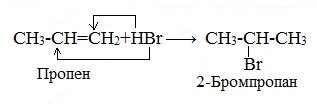
Гидрогалогенирование (присоединение галогеноводородов)
При взаимодействии алкенов с галогеноводородами (НCl, НBr) образуются галогеналканы.

Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей. Электрофилом является протон Н+ в составе молекулы галогеноводорода HX (X — галоген).
Присоединение галогеноводородов к алкенам несимметричного строения происходит по правилу В.В. Марковникова.
Правило Марковникова.
При присоединении галогеноводородов или воды к несимметричным алкенам или алкинам атом водорода присоединяется к наиболее гидрогенизированному (гидрированному) углеродному атому (т.е. к атому С, связанному с большим числом атомов Н), а атом галогена (или группа –ОН) – к наименее гидрогенизированному
Наиболее гидрогенизированный - это атом углерода, содержащий наибольшее число атомов водорода по месту кратной связи.
Наименее гидрогенизированный - это атом углерода, содержащий наименьшее число атомов водорода по месту кратной связи.
Присоединение против правила Марковникова происходит в том случае, когда
заместитель при двойной связи оттягивает электронную плотность на себя, т.е проявляет электроноакцепторные свойства (–I и/или –М-эффект).
В молекуле трихлопропена Сl3C-CH=CH2 группа СCl3 проявляет отрицательный индуктивный эффект и π -электронная плотность связи С=С смещается к менее гидрогенизированному атому углерода. В результате на атоме С(2) возникает частичный отрицательный заряд δ- , а на атоме С(1) – частичный положительный заряд δ+. При взаимодействии с галогеноводородом водород присоединяется к менее гидрогенизированному атому углерода, а галоген – к более гидрогенизированному:

Также в присутствии какого-либо органического пероксида полярные молекулы галогеноводородов реагируют с алкенами не по правилу Марковникова.

Это связано с тем, что в присутствии перекиси реакция присоединения идет не по электрофильному, а по радикальному механизму.
Гидратация (присоединение воды)
При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются одноатомные спирты.
Минеральные кислоты выполняют роль катализаторов и являются источниками протонов.

Присоединение воды к несимметричным алкенам идет по правилу Марковникова.

Реакция присоединения воды к этилену в присутствии твердых катализаторов используется для промышленного получения этилового спирта из непредельных углеводородов, содержащихся в газах крекинга нефти (попутных газов), а также в коксовых газах.
Реакции полимеризации.
Видео. Реакция полимеризации.

Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и др.
Реакции окисления
Горение
Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
Как и все углеводороды, алкены горят в кислороде, и при этом образуют диоксид углерода и воду:

Видеоопыт «Горение этилена»
Неполное (недостаток О2).

Неполное каталитическое окисление
Если смешать алкен с кислородом и пропустить эту смесь над нагретым до 2000С серебряным катализатором, то образуется оксид алкена (эпоксид). Циклические оксиды широко используются в органическом синтезе.

Окисление перманганатом калия в нейтральной или щелочной среде (реакция Вагнера)
Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов.

В результате этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4 и выпадает коричневый осадок оксида марганца (IV).
Видеоопыт «Взаимодействие этилена с раствором перманганата калия»
Эта реакция используется как качественная реакция на алкены и другие непредельные углеводорода.
Окисление перманганатом калия в кислой среде
При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи с образование а) карбоновых кислот; б) кетонов (если атом углерода при двойной связи содержит два заместителя); в) углекислого газа (если двойная связь на конце молекулы, то образуется муравьиная кислота, которая легко окисляется до CO2):

 
Задание 5. Выполни упражнения 6, 9. 11.
Реши задачи
Стр. 94.
|
Отметь знаком «+» материал, с которым ознакомился(лась)
|
 Скачать 365.23 Kb.
Скачать 365.23 Kb.





























