Определение момента инерции твёрдых тел. Лабораторная работа по курсу "Общая физика" определение отношения теплоемкостей газа методом клеманадезорма
 Скачать 125.5 Kb. Скачать 125.5 Kb.
|
|
Федеральное Агентство по образованию ТОМСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ СИСТЕМ УПРАВЛЕНИЯ И РАДИОЭЛЕКТРОНИКИ (ТУСУР) Кафедра физики ОТЧЕТ Лабораторная работа по курсу "Общая физика" ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ГАЗА МЕТОДОМ КЛЕМАНА–ДЕЗОРМА Преподаватель Студент группы 20__ г. 20__ г. 20__г. 1. ЦЕЛЬ РАБОТЫ Целью данной работы является изучение адиабатического и изохорического процессов в газах, определение отношения теплоемкостей (коэффициента Пуассона) и числа степеней свободы газа. 2. ОПИСАНИЕ УСТАНОВКИ И МЕТОДИКИ ЭКСПЕРИМЕНТА Величину коэффициента Пуассона можно определить с помощью прибора Клемана и Дезорма, изображенного на рисунке 2.1. 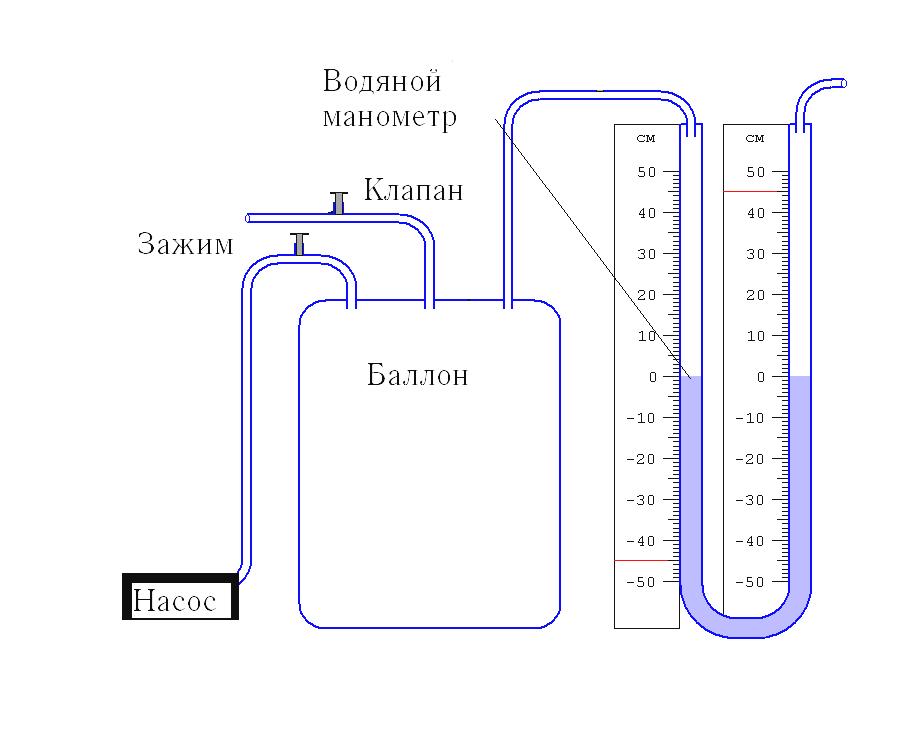 Рисунок 2.1 Схема экспериментальной установки Для определения отношения теплоемкостей 3. ОСНОВНЫЕ РАСЧЕТНЫЕ ФОРМУЛЫ Коэффициент Пуассона для каждого измерения: Средний коэффициент значения Пуассона: Экспериментальное число степеней свободы газа: Абсолютная погрешность вычисления среднего значения коэффициента Пуассона: 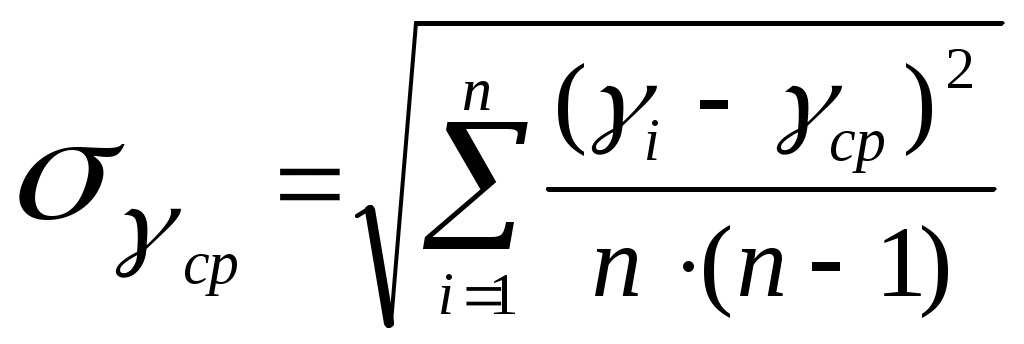 . (3.4) . (3.4) Относительная погрешность вычисления среднего значения коэффициента Пуассона в процентах: 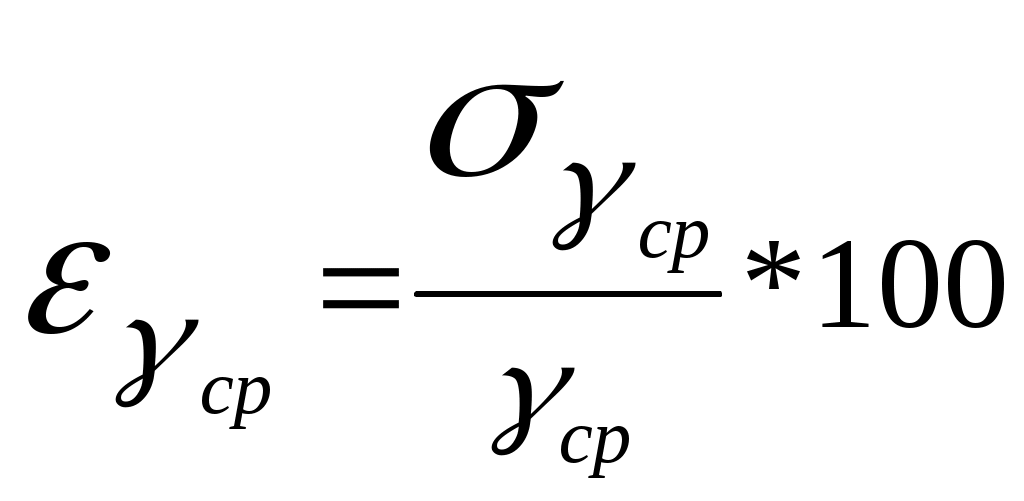 . (3.5) . (3.5) 4. РЕЗУЛЬТАТЫ РАБОТЫ И ИХ АНАЛИЗ. Таблица 4.1 Результаты прямых и косвенных измерений
5.РАСЧЕТ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ И ПОГРЕШНОСТЕЙ Средний коэфициент значения Пуассона вычисляем по формуле (3.3) С помощью преобразованой формулы (3.4) находится эксперементальное чило степеней свободы газа Число степеней свободы газа Вычисление погрешностей косвенного измерения Абсолютная погрешность вычисления среднего значения коэффициента Пуассона находится по формуле (3.5) 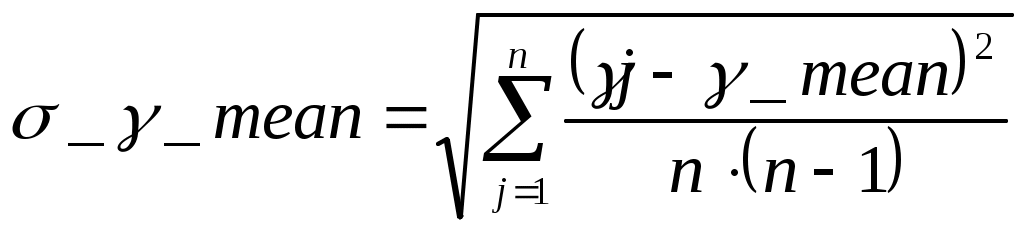 Относительная погрешность вычисления среднегокоэффициента Пуассона в процентах находится по формуле (3.6) 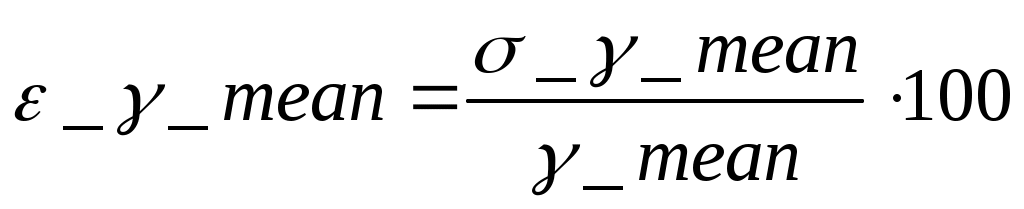 6. ВЫВОДЫ В ходе данной работы проведены опыты, изучены адиабатический и изохорический процессы в газах. Определено отношение теплоемкостей (коэффициент Пуассона) и число степеней свободы газа. Проверяемые газовые законы подтверждены данными экспериментами. 7. ОТВЕТЫ НА КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Какой газ называется идеальным? Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. 2. Что такое степени свободы молекул? Как число степеней свободы связано с коэффициентом Пуассона γ? Числом степеней свободы тела называется число независимых координат, которые необходимо задать для того, чтобы полностью определить положение тела в пространстве. Так, например, материальная точка, произвольно движущаяся в пространстве, обладает тремя степенями свободы (координаты x, y, z). Молекулы одноатомного газа можно рассматривать как материальные точки на том основании, что масса такой частицы (атома) сосредоточена в ядре, размеры которого очень малы (10-13см). Поэтому молекула одноатомного газа может иметь лишь три степени свободы поступательного движения. Молекулы, состоящие из двух, трех и большего числа атомов, не могут быть уподоблены материальным точкам. Молекула двухатомного газа в первом приближении представляет собой два жестко связанных атома, находящихся на некотором расстоянии друг от друга 3. Чему равна теплоемкость идеального газа при адиабатическом процессе? Теплоемкостью называется величина, равная количеству теплоты, которое нужно сообщить веществу, чтобы повысить его температуру на один кельвин. 4. В каких единицах измеряются в системе СИ давление, объем, температура, молярные теплоемкости? Давление – кПа, объем – дм3, температура – в Кельвинах, молярные теплоемкости – Дж/(мольК) 5. Что такое молярные теплоемкости Ср и Сv? У газа различают теплоемкость при постоянном объеме Сv и теплоемкость при постоянном давлении Ср. При постоянном объеме работа внешних сил равна нулю, и все сообщаемое газу извне количество теплоты идет целиком на увеличение его внутренней энергии U. Отсюда молярная теплоемкость газа при постоянном объеме Сv численно равна изменению внутренней энергии одного моля газа ∆U при повышении его температуры на 1К: ∆U=i/2*R(T+1)-i/2RT=i/2R Таким образом, молярная теплоемкость газа при постоянном объеме Сv=i/2R удельная теплоемкость при постоянном объеме Сv=i/2*R/µ При нагревании газа при постоянном давлении газ расширяется, сообщаемое ему извне количество теплоты идет не только на увеличение его внутренней энергии U, но и на совершение работы A против внешних сил. Следовательно, теплоемкость газа при постоянном давлении больше теплоемкости при постоянном объеме на величину работы A, которую совершает один моль газа при расширении, происходящем в результате повышения его температуры на 1K при постоянном давлении P: Ср= Сv+A Можно показать, что для моля газа работа A=R, тогда Ср= Сv+R=(i+2)/2*R Пользуясь соотношением между удельными в молярными теплоемкостями, находим для удельной теплоемкости: Ср=(i+2)/2*R Непосредственное измерение удельных и молярных теплоемкостей затруднительно, так как теплоемкость газа составит ничтожную долю теплоемкости сосуда, в котором находится газ, и поэтому измерение будет чрезвычайно неточно. Проще измерить отношение величии Ср/ Сv γ= Ср/ Сv =(i+2)/i. Это отношение зависит только от числа степеней свободы молекул, из которых состоит газ. 6. Чем молярная теплоемкость отличается от удельной, удельная – от полной? Теплоемкостью называется величина, равная количеству теплоты, которое нужно сообщить веществу, чтобы повысить его температуру на один кельвин. Удельной теплоемкостью называется физическая величина, численно равная количеству теплоты, которое надо сообщить единице массы этого вещества для увеличения ее температуры на один кельвин. Кроме того, часто пользуются молярной (мольной) теплоемкостью, которая в отличие от удельной теплоемкости отнесена не к одному килограмму, а к одному молю вещества. 7. Что такое адиабатный процесс? Адиабатическим называется такой процесс, когда система переходит из одного состояния в другое без теплообмена с внешними по отношению к этой системе телами. Практически адиабатный процесс всегда происходит при достаточно быстром расширении или сжатии газа. Условие адиабатичности будет выполнено, если процесс протекает так быстро, что теплообмен между газом и внешней средой не успевает произойти 8. Что такое уравнение Пуассона? Коэффициент Пуассона называется также показателем адиабаты, так как он входит в уравнение Пуассона которое характеризует адиабатический процесс, протекающий без теплообмена с окружающей средой Q=0. 9. Может ли случиться, что газ получает теплоту, а его внутренняя энергия уменьшается? Система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, т. е. изменяются ее макроскопические параметры (температура, давление, объем). Так как внутренняя энергия U однозначно определяется макроскопическими параметрами, характеризующими состояние системы, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением ΔU внутренней энергии системы. 10. Изменяется ли внутренняя энергия идеального газа при изотермическом процессе? В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0. Первый закон термодинамики для изотермического процесса выражается соотношением Q=A 11. Какое влияние на результат опытов может оказать наличие водяного пара в воздухе, которым наполнен баллон? Не всякий процесс, проведенный в адиабатической оболочке, т. е. без теплообмена с окружающими телами, удовлетворяет этому условию. Примером неквазистатического процесса, в котором промежуточные состояния неравновесные, может служить расширение газа в пустоту. На рис. 3.9.3 изображена жесткая адиабатическая оболочка, состоящая из двух сообщающихся сосудов, разделенных вентилем K. В первоначальном состоянии газ заполняет один из сосудов, а в другом сосуде – вакуум. После открытия вентиля газ расширяется, заполняет оба сосуда, и устанавливается новое равновесное состояние. В этом процессе Q = 0, т.к. нет теплообмена с окружающими телами, и A = 0, т.к. оболочка недеформируемая. Из первого закона термодинамики следует: ΔU = 0, т. е. внутренняя энергия газа осталась неизменной. Так как внутренняя энергия идеального газа зависит только от температуры, температуры газа в начальном и конечном состояниях одинаковы – точки на плоскости (p, V), изображающие эти состояния, лежат на одной изотерме. Все промежуточные состояния газа неравновесные и их нельзя изобразить на диаграмме. Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении. 12. Какие из термодинамических параметров, используемых в данной работе, являются функциями состояния? 13. Какие из термодинамических параметров, используемых в данной работе, являются функциями процесса? 14. Как изменяется энтропия при адиабатическом процессе? Ее статистический и термодинамический смысл? В термодинамике важную роль играет физическая величина, которая называется энтропией. Изменение энтропии в каком-либо квазистатическом процессе равно приведенному теплу ΔQ / T, полученному системой. Поскольку на любом участке адиабатического процесса ΔQ = 0, энтропия в этом процессе остается неизменной. 15. Чему равна теплоемкость при изотермическом процессе? В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует QV = CVΔT = ΔU. Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры. CV = ΔU/ΔT 16. Какие из термодинамических параметров, используемых в данной работе, являются аддитивными? Если послепредельная величина пропорциональна первой степени числа частиц, то её называют аддитивной. Примерами таких величин являются объем, энтропия, внутренняя энергия. Какие из термодинамических параметров, используемых в данной работе, являются не аддитивными? Если послепредельная величина пропорциональна нулевой степени числа частиц, то её называют не аддитивной. Примерами таких величин являются давление, температура, химический потенциал. Что такое обратимые процессы? Обратимый процесс в термодинамике - процесс, который возможно осуществить в обратном направлении, последовательно повторяя в обратном порядке все промежуточные состояния прямого процесса. Обратимым процессом может быть только равновесный процесс. Реальные процессы, строго говоря, являются необратимыми процессами. 8. ПРИЛОЖЕНИЕ К работе прилагается регистрационный файл (*.REG). |
