Лабораторная работа №2. Комплексные соединения. Лабораторная работа
 Скачать 89 Kb. Скачать 89 Kb.
|
Лабораторная работаКомплексные соединения
Ознакомление со свойствами комплексных соединений, способами их получения и устойчивостью в растворах. Получение навыков составления реакций с участием комплексных соединений
Строение комплексных соединений и их поведение в растворах объясняет координационная теория, созданная в конце ХIХ века швейцарским химиком Альфредом Вернером. Соединения такого типа, как BF3, CH4, NH3, H2O, CO2 и др., в которых элемент проявляет свою обычную валентность, называются валентнонасыщенными соединениями или соединениями первого порядка. При взаимодействии соединений первого порядка друг с другом получаются соединения высшего порядка (гидраты, аммиакаты, продукты присоединения кислот, органических молекул, двойные соли и многие другие). CoCl3 + 6NH3 = CoCl3 . 6NH3 или [Co(NH3)6]Cl3 BF3 + HF = BF3 . HF или H[BF4] Fe(CN)3 + 3KCN = Fe(CN)3 . 3KCN или K3[Fe(CN)6] Согласно теории Вернера, любой элемент после насыщения его обычных валентностей способен проявлять ещё и дополнительную валентность – координационную. Именно засчёт этой валентности и происходит образование соединений высшего порядка – комплексных соединений. В каждом комплексном соединении различают внутреннюю и внешнюю сферы. Болеетесно связанные частицы внутренней сферы называют комплексным ионом или комплексом (заключают в квадратные скобки). Центральный ион или атом внутренней сферы комплекса, вокруг которого группируются ионы или молекулы, называется комплексообразователем или ядром комплекса, а координируемые им во внутренней сфере ионы или молекулы – лигандами или аддендами. Роль комплексообразователей чаще всего выполняют катионы переходных металлов, реже анионы или нейтральные атомы, имеющие вакантные орбитали. Примерами лигандов могут служить анионы: Г-, OH-, CN-, CNS-, NO2-, CO32-, C2O42-; нейтральные молекулы: Н2О, NH3, CO, NO, Г2, N2H4, NH2-CH2-CH2-NH2(этилендиамин), аминоуксусная кислота NH2-CH2-COOH. Координационное число (К.Ч.) или координационная валентность – общее количество лигандов, входящих во внутреннюю сферу комплекса. Известны координационные числа 1, 2, 3, 4, 5, 6, 7, 8, 9, 12. Чаще других встречаются 4, 6 и 2. Эти числа соответствуют наиболее симметричной геометрической конфигурации комплекса – октаэдрической (6), тетраэдрической (4) и линейной (2). Координационная валентность зависит от природы комплексообразователя и лигандов, от степени окисления комплексообразователя, от соотношения размеров комплексообразователя и лигандов, концентрации раствора комплексного соединения. Чем выше степень окисления комплексообразователя, тем больше координационное число: [Cu+(NH3)2]+, но [Cu2+(NH3)4]2+. Незаряженные лиганды обычно присоединяются к комплексообразователю в большем числе, чем заряженные: [Сo(H2O)6]2+, но [СoCl4]2.-. Например, с ионами Cl-, Br-, I- алюминий проявляет К.Ч. 4, а с меньшим ионом F- - 6: K[AlCl4],но K3[AlF6]. 2.2. Химическая связь в комплексных соединениях. Метод валентных связей является весьма наглядным способом описания комплексных соединений. В его основе лежат следующие положения:
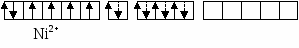
Рассмотрим, как МВС описывает электронную структуру и свойства некоторых комплексов, образованных 3d–элементами: кобальтом, никелем и медью. В таблице собственные электроннные пары комплексообразователей изображены сплошными стрелками, а электронные пары лигандов, ответственные за донорно-акцепторные σ-связи, представлены пунктирными стрелками.
Наряду с моноядерными комплексами, включающими только один центральный атом, существуют полиядерные, в структуре которых одновременно присутствуют два или несколько центральных атомов-комплексообразователей. Помимо МВС для описания комплексных соединений широко используют Теорию кристаллического поля (ТКП), основанную на электростатической модели, её усовершенствованную модель – Теорию поля лигандов (ТПЛ), в которой электростатическое взаимодействие дополнено идеей перекрывания орбиталей, и, наконец, Метод молекулярных орбиталей (ММО). 2.3 Номенклатура комплексных соединений. Названия комплексных соединений, применяемые в настоящее время, утверждены комиссией по номенклатуре неорганических соединений Международного Союза по теоретической и прикладной химии (IUPAC). Ниже приведены некоторые правила, заимствованные из материалов этой комиссии.
[Ag(NH3)2]Cl – диаминаргенто (1+) хлорид K2[CuCl3] – калия трихлоркупрат (1+) H2[Pt(CN)6] – гексацианоплатиновая кислота или водорода гексацианоплатинат (4+) [Al(H2O)6]Cl3 гексааквоалюминий хлорид [Cu(NH3)2]OH – диаминмедь (1+) гидроксид K4[SnF8] – калия октафторстаннат (4+)
комплексных ионов. Для комплексных соединений характерна первичная и вторичная диссоциация. Первичная диссоциация комплексных соединений на комплексный ион и противоположно заряженные ионы внешней сферы протекает полностью, как у сильных электролитов. K2[Zn(CN)4] = 2K+ +[Zn(CN)4]2- [Co(NH3)6](NO3)2 = [Co(NH3)6]2+ +2NO3- Поэтому, соединения, содержащие комплексные ионы, могут вступать в реакции обмена с электролитами с образованием малорастворимых веществ. 2 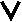 CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6] + 2K2SO4; CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6] + 2K2SO4;2 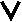 Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6] Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6] Однако, в отличие от “простых” ионов, комплексные ионы сами способны к диссоциации, которая называется вторичной диссоциацией. Она характеризует диссоциацию самого комплексного иона и протекает ступенчато, как у слабых электролитов, подчиняясь закону действия масс. Количественно каждая ступень характеризуется константой диссоциации. I ступень: [Ag(NH3)2]+ = [AgNH3]+ +NH3 Кд(I) [AgNH3]+ [NH3]  = [Ag(NH3)2]+ II ступень: [AgNH3]+ = Ag+ + NH3 Кд(II) =  [Ag+] [NH3] [Ag+] [NH3] [AgNH3]+ В целом устойчивость комплексного иона в растворе характеризуется величиной константы нестойкости Кн , которая равна произведению констант диссоциации отдельных ступеней. Кн = Кд(I) Кд(II) Общая константа нестойкости Кн является константой равновесия полной диссоциации комплекса: [Ag(NH3)2]+ = Ag+ + 2NH3 [Ag+] [NH3]2 К [Ag(NH3)2]+  н = Чем меньше константа нестойкости, тем прочнее комплексный ион. Комплексные соединения, в частности соли, очень сходны с двойными солями. Подобно комплексным, двойные соли также образуются путем соединения простых солей MgCl2+KCl=KCl∙MgCl2 Отличаются комплексные соли от двойных прежде всего величиной константы нестойкости: у типичных двойных солей константа нестойкости очень велика , у типичных комплексных солей она, наоборот, очень мала. Резкой границы между двойными и комплексными солями не существует. Двойные соли диссоциируют на те ионы, которые находились в растворах простых солей, послуживших для их образования, например, K  Cl∙MgCl2 K++Mg2++3Cl- Cl∙MgCl2 K++Mg2++3Cl-Двойные соли можно рассматривать как комплексные соли с малоустойчивой, легко диссоциирующей на ионы внутренней координационной сферой. 2.5. Получение и разрушение комплексных соединений. Образование и разрушение комплекса объясняется смещением равновесия его диссоциации и объясняется принципом Ле Шателье. Равновесие диссоциации иона [Ag(NH3)2]+ = Ag+ + 2NH3 смещается в сторону образования комплекса (влево) при увеличении концентрации ионов Ag+ и NH3. При этом образуются соединения, в которых центральный атом или лиганд связаны более прочно, чем в исходном комплексе. Многие комплексные соединения хорошо растворимы в воде, поэтому комплексообразование используется для перевода в раствор труднорастворимых соединений. Хлорид серебра растворяется в избытке цианида калия: AgCl + 2KCN = K[Ag(CN)2] + KCl AgCl + 2CN- = [Ag(CN)2]- + Cl- Это связано с тем, что ион серебра в ионе [Ag(CN)2]- связан более прочно, чем в AgCl.    AgCl = Cl- + Ag+ + 2CN = [Ag(CN)2]- ПР(AgCl) = 5∙10-8 Кн[Ag(CN)2]- = 1∙10-21 П  ри избытке CN- При добавлении азотной кислоты к [Ni(NH3)6]Cl2 происходит разрушение комплекса, о чём свидетельствует изменения окраски раствора. Это связано с образованием катиона аммония, в котором аммиак связан с катионом водорода более прочно, чем с катионом никеля.    [Ni(NH3)6]2+ = Ni2+ + 6NH3 + 6H+ = 6NH4+ + Ni2+ Кн[Ni(NH3)6]2+ = 1∙10-8 Кн[NH4]+ = 6∙10-10 П  ри избытке Н+ 2.6.Окислительно-восстановительные реакции с участием комплексных соединений. Комплексные соединения могут участвовать в окислительно-восстановительных реакциях. При этом изменяется степень окисления центрального атома. Возможны реакции двух типов: а) Изменение степени окисления без разрушения комплекса 2K3[Fe3+(CN)6] + 2KI = 2K4[Fe2+CN)6] + I2 б) Изменение степени окисления с разрушением комплекса в результате восстановления центрального иона до металла Zn + 2K[Au+(CN)2] = 2Auo + K2[Zn(CN)4]
3.2.1. Получение аммиачного комплекса меди. а) Налейте в пробирку 10-12 капель раствора сульфата меди(II) и добавьте по каплям 25%-й раствор аммиака. Наблюдайте первоначальное образование осадка гидроксосульфата меди и последующее его растворение в избытке аммиака с образованием окрашенного раствора комплексной соли. б) К полученному раствору добавьте небольшое количество раствора соляной кислоты. Наблюдайте изменение окраски раствора. (Координационное число Cu2+ равно 4.) 3.2.2. Получение аммиачного комплекса серебра. а) Налейте в пробирку 1-2 мл раствора нитрата серебра и столько же раствора хлорида натрия. Полученный осадок растворите, получив раствор комплексной соли серебра. Для этого добавьте несколько капель концентрированного раствора аммиака. б) Полученный раствор комплексной соли серебра разлейте в две пробирки. В одну пробирку добавьте раствор хлорида натрия, в другую – раствор йодида калия. Наблюдайте отсутствие осадка в первой пробирке и его наличие во второй. (Координационное число Ag+ равно 2, ПР(AgCl) = 1.10-10, ПР(AgI) = 1.10-16, Кн[Ag(NH3)2]+ = 9,3.10-8.) 3.2.3. Получение гидроксокомплекса цинка. а) Налейте в пробирку 2-3 мл раствора сульфата цинка и добавьте по каплям раствор гидроксида натрия до появления осадка. К раствору с осадком добавьте избыток щёлочи до полного растворения осадка в результате образования раствора комплексной соли. б) К полученному раствору добавьте 3-4 капли раствора серной кислоты. Наблюдайте появление осадка в виде помутнения раствора. (Координационное число Zn2+ равно 4.) 3.2.4. Получение роданидного комплекса железа. В первую пробирку налейте 2-3 мл раствора хлорида железа (Ш), а во вторую – столько же раствора калия гексацианоферрита (3+). В каждую пробирку добавьте несколько капель раствора роданида калия. Наблюдайте изменение цвета раствора только в первой пробирке. На основании опыта сделайте вывод о том, какой из двух комплексов железа (3+) более устойчив – цианидный или роданидный? 3.2.5. Получение аммиачного комплекса никеля. Налейте в пробирку 1 мл раствора сульфата никеля и добавьте по каплям концентрированный раствор аммиака. Наблюдайте осадок сульфата никеля и последующее его растворение вследствие образования раствора комплексной соли. К полученному раствору добавьте равный объём насыщенного раствора бромида калия и наблюдайте образование осадка гексааминникеля (2+) бромида. Затем к осадку добавьте раствор соляной кислоты. Отметьте растворение осадка и изменение цвета раствора. На основании результатов опыта сделайте вывод о том, какое соединение аммиака – [NH4]+ или [Ni(NH3)6]2+ более устойчиво в данных условиях. 3.3. Окислительно – восстановительные реакции с участием комплексных соединений.
(Координационное число Со2+ и Со3+ равно 6.)
К полученному раствору по каплям добавляйте дистиллированную воду и наблюдайте за изменением цвета. (Координационное число Со2+ равно 4.)
|