Лабораторные животные в вирусологии. Вирусология лаб. Лабораторные животные и их использование в вирусологии
 Скачать 0.79 Mb. Скачать 0.79 Mb.
|
|
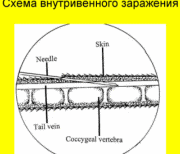
ЛЗ №4 ТЕМА: «Лабораторные животные и их использование в вирусологии» Цель занятия: Ознакомление с целями использования лабораторных животных в вирусологии, требованиями к лабораторным животным, методами экспериментального заражения лабораторных животных и методикой вскрытия трупов лабораторных животных и взятия от них патматериала. 1. Опишите содержание и кормление лабораторных животных. Лaбopатopных животных размещают так, чтобы с одной стороны было обеспечено функционирование всех систем организма в пределах физиологической нормы, с другой - исключено взаимное перезаражение и распространение инфекции за пределы вивария. Виварий для лабораторных животных должен иметь : основное помещение для животных, моечную (с боксом, сушильными и стерилизационными установками), кухню для приготовления корма с одним по крайней мере столом, оборудованным для приготовления корма, и холодильником для скоропортящихся продуктов, кладовую, операционную, гардероб и санитарное помещение для обслуживающего персонала. Запасы корма следует хранить в специальных помещениях. В местах содержания опытных животных желательно иметь гигрометр и термометр. Животных содержат в виварии с учетом их физиoлoгическoй пoтpебнoсти в освещенности и температуре. Taк, мышам, крысам нужны полумрак и температура воздуха oколо 20о С, морским свинкам, кролика и курам -.дневной свет и температура в пределах 16-23, 14-18 и не ниже 0о C соответственно. Мышей, крыс, хомяков и морских свинок в период опыта рекомендуется содержать в стеклянных банках с крышкой из проволочной сетки или перфорированного листового железа. Это облегчает наблюдение за ними, а банки легко чистить и дезинфицировать. Плoтнoсть посадки должна сoставлять примерно 1 г массы лaбopaтopных животных на 1 см2 дна клетки. В качестве подстилки применяют материалы, которые адсорбируют влагу и могут быть использованы животными для постройки гнезда: стружку для мышей, крыс, хомяков, морских свинок, хорьков, кур; опилки для крупных мышей, крыс, хомяков, хорьков, кур; солому для хомяков, морских свинок, кроликов, собак, кур; мякину для мышей, крыс; сено для мышей, крыс, хомяков, хорьков, кур; песок для кур. Следует использовать такую подстилку, которая образует как можно меньше пыли, так как последняя может привести к заболеванию органов дыхания. Любую подстилку необходимо предварительно стерилизовать при 100 °С в течение 30 мин. Если виварий один, зараженных животных содержат изолированно от здоровых и с последних начинают уборку помещения и кормление. Для ухода за зараженными животными используют отдельный инвентарь и кормушки. Лучше иметь 2 вивария: для содержания здоровых и зараженных животных. Обслуживающий персонал при работе в виварии пользуется спецодеждой: Халат Резиновые перчатки Фартук Непромакаемая обувь В виварии ежедневно дезинфицируют инвентарь и проводят влажную уборку с применением дезинфицирующих веществ. По окончании эксперимента клетки дезинфицируют, погибших животных обезвреживают сжиганием в печах или автоклавированием. Кормление: Животных обеспечивают регулярным и полноценным кормлением и постоянно питьевой водой. При составлении рациона для лабораторных животных необходимо исходить из ряда условий: потребность животных данного вида, предельно допустимые количества ингредиентов и их соответствие оптимальным условиям питания в периоды повышенной потребности. Большую роль в рационе играют витамины, которые доставляются животным в молоке, рыбьем жире, зеленых кормах (морковь, трава и др.). В рацион крыс, помимо указанного, обязательно включается мясо. 2. Опишите методы маркировки лабораторных животных Метка является непременным условием использования животных в эксперименте. На клетке, в которой помещены зараженные животные, укрепляют бирку с надписью, отражающей использованный для заражения вирус (или номер экспертизы исследуемого патологического материала), количество зараженных животных, дату заражения и, если надо, другие сведения. Для животных разных видов применяют разные способы индивидуальной метки. Для крупных животных и кур используют металлические бирки со штампованным номером. Бирки надевают на корень уха (кроликам), вставляют в ушную раковину по типу серьги (морским свинкам), надевают на ногу – окольцовывают (курам). При использовании в эксперименте небольшой группы животных и при непродолжительном сроке его можно выстригать шерсть знаками на спине, бедрах (у кроликов). Морских свинок можно различать по окраске, которую регистрируют в рабочем журнале. Метка белых мышей, белых крыс может быть проведена ампутацией отдельных пальцев на передних или задних конечностях, каждый из которых соответствует тому или другому порядковому номеру: на передних лапах – единицам, на задних – десяткам. Однако чаще пользуются методом нанесения цветных пятен на непигментированную шерсть. Н  асыщенный раствор пикриновой кислоты лучше других красителей (растворов фуксина, бриллиантовой зелени) удерживается на шерсти и коже животных. асыщенный раствор пикриновой кислоты лучше других красителей (растворов фуксина, бриллиантовой зелени) удерживается на шерсти и коже животных. Цветные метки ставятся в местах, соответствующих определенному порядковому номеру животного. Так, если тело животного мысленно разделить на три продольные части (левый бок, спина, правый бок), то нанесение цветных пятен начинают с левого верхнего угла, т. е. лопатки, и это будет соответствовать 1 (рис. 8). Тогда, двигаясь назад, левый бок соответствует 2, а левое бедро – 3, далее затылок – 4, спина – 5, область репицы – 6, правое плечо – 7, правый бок – 8, правое бедро – 9. Используя два цвета красителей, можно дать обозначения одним из них – единиц, другим – десятков. 3.Заполните таблицу
4. Заполните таблицу
5. Преимущества и недостатки культивирования вирусов в организме лабораторных животных по сравнению с другими методами Преимущество данного метода перед другими состоит в возможности выделения тех вирусов, которые плохо репродуцируются в культуре или эмбрионе. К его недостаткам относятся контаминация организма подопытных животных посторонними вирусами и микоплазмами, а также необходимость последующего заражения культуры клеток для получения чистой линии данного вируса, что удлиняет сроки исследования. Недостатками метода являются невосприимчивость животных ко многим вирусам, наличие собственной микрофлоры. |