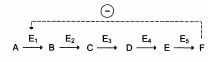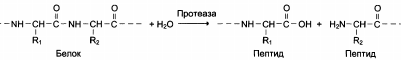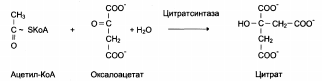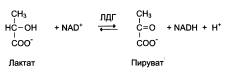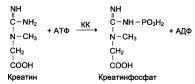|
Макурина Ольга Николаевна стр.
Тема 3. Ферменты
Лекция 5. Ферменты
Общие представления о катализе (энергетическая диаграмма реакции, переходное состояние, энергия активации). Механизмы катализа. Зависимость активности ферментов от температуры и рН среды. Единицы активности ферментов. Специфичность действия ферментов.
Кофакторы и коферменты. Ингибирование активности ферментов: обратимое, необратимое, конкурентное, неконкурентное. Регуляция скоростей синтеза и распада ферментов. Индукция и репрессия синтеза ферментов.
Компартментация ферментов. Аллостерическая регуляция. Ингибирование по принципу обратной связи. Ковалентная модификация ферментов: ограниченный протеолиз проферментов, фосфорилирование и дефосфорилирование.
Классификация и номенклатура ферментов. Изоферменты. Органоспецифические ферменты. Энзимодиагностика и энзимотерапия. Ингибиторы ферментов как лекарственные препараты. Наследственные энзимопатии.
Практическое значение анализа изоферментных спектров в крови (ЛДГ, КК и др.). Применение ферментов как аналитических реагентов при лабораторной диагностике.
Краткое содержание
|
Конспект
|
1. Общие представления о катализе (энергетическая диаграмма реакции, переходное состояние, энергия активации). Механизмы катализа. Зависимость активности ферментов от температуры и рН среды. Единицы активности ферментов. Специфичность действия ферментов
|
Ферменты являются белковыми катализаторами биохимических реакций, т.е. они являются реакционно-специфическими катализаторами.
Схема процесса катализа:
Е + S ↔ ES ↔ EP → E + P
Свойства ферментов: 1. Специфичность. 2.Каталитическая эффективность. 3. Лабильность ферментов. 4. Способность ферментов к регуляции. 5. Высокий коэффициент полезного действия (100 %).
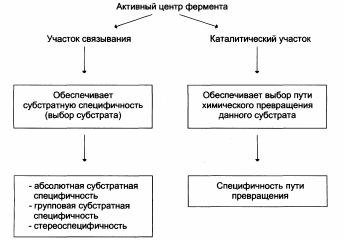
Строение активного центра фермента:
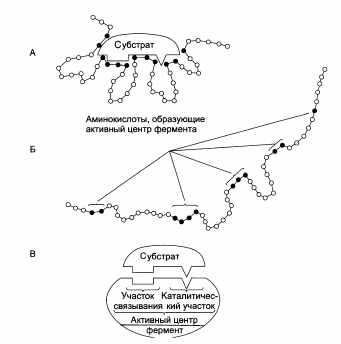
|
А – присоединение субстрата к ферменту в активном центре.
Б – положение аминокислотных остатков, формирующих активный центр фермента в первичной структуре белка.
В – активный центр фермента условно разделяется на участок связывания и каталитический участок.
Участок связывания представлен радикалами аминокислот, функциональные группы которых обеспечивают связывание субстрата. Каталитический участок образован радикалами аминокислотных остатков, функциональные группы которых обеспечивают химические превращения субстрата.
|
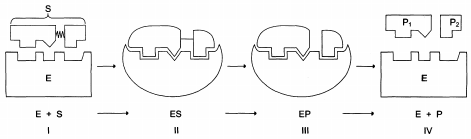
Этапы ферментативного катализа:
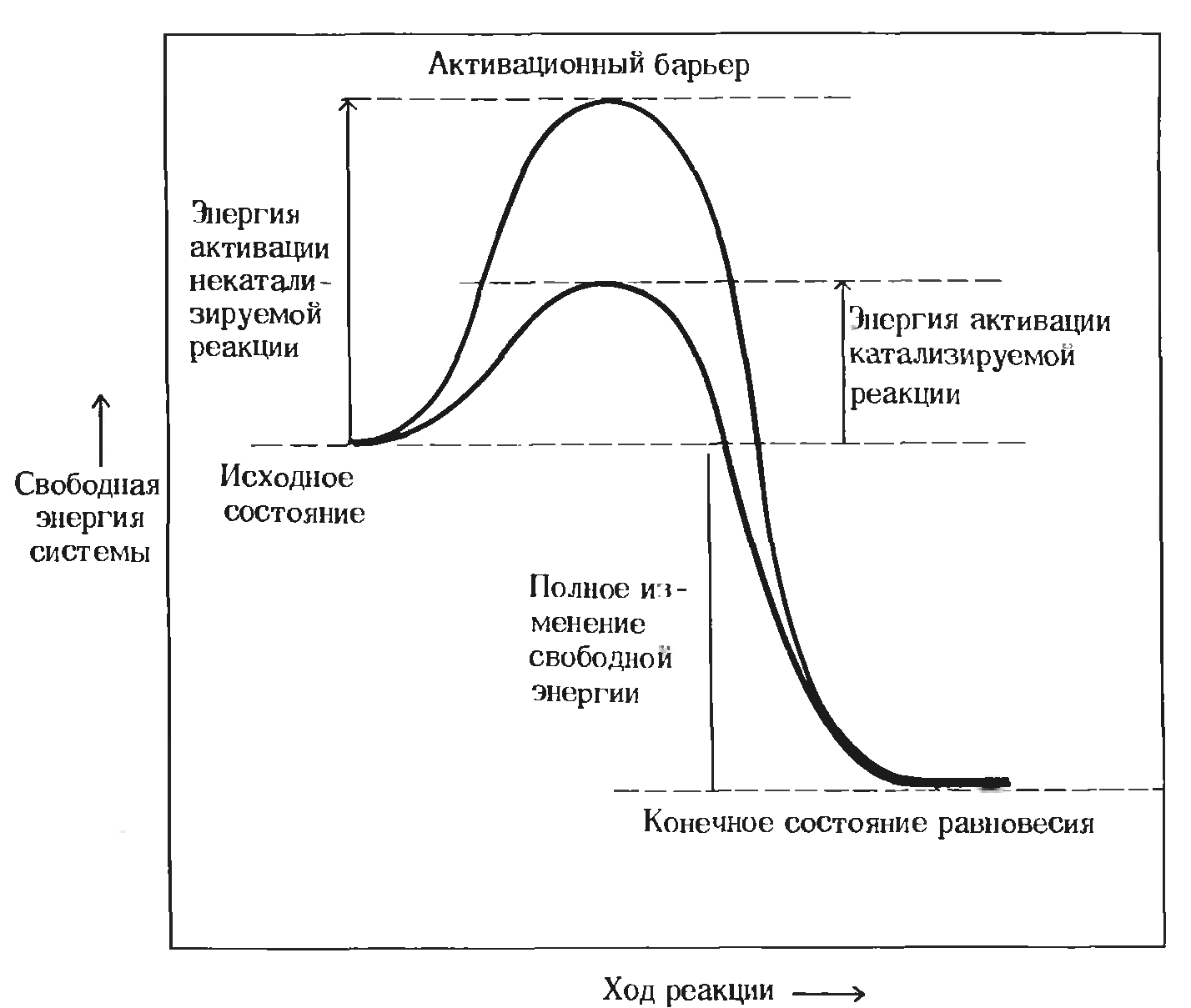
Энергия активации
Энергией активации называют дополнительное количество кинетической энергии, необходимое молекулам вещества, чтобы они вступили в реакцию.
Разницу энергий между исходным реагентом и конечными продуктами называют изменением свободной энергии реакции (ΔG).
Зависимость скорости ферментативной реакции (V) от концентрации фермента:
|
|
Зависимость скорости ферментативной реакции (V) от температуры:
|
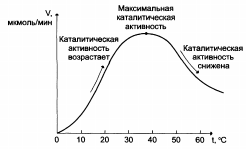
|
Зависимость скорости ферментативной реакции (V) от рН среды:
|
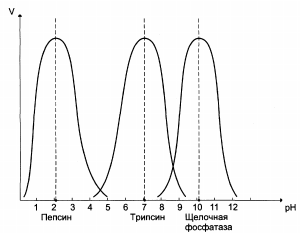
|
Единицы активности ферментов
Количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: одна международная единица активности (МЕ) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции.
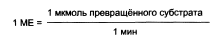
В 1973 г. была принята новая единица активности ферментов: 1 кат (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с. Количество каталов определяю по формуле:

В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности – МЕ.
Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд.ак.) фермента, численно равную количеству единиц активности фермента (nМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани:
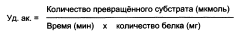
Специфичность ферментов: субстратная, каталитическая.
Субстратная специфичность
Субстратная специфичность – это способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Выделяют три вида субстратной специфичности: 1. Абсолютная. 2. Групповая. 3. Стереоспецифичность.
1. Абсолютная субстратная специфичность:
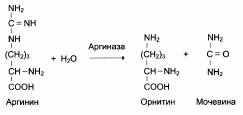
2. Групповая субстратная специфичность:
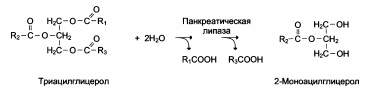
3. В организме человека наблюдается специфичность ферментов к следующим стереоизомерам: 1) к D-сахарам; 2) цис-транс-изомерам; 3) к L-аминокислотам; 4) к α- и β-гликозидным связям.
Стереоспецифичность к D-сахарам:
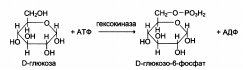
К аталитическая специфичность аталитическая специфичность
Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения. Это свойство обеспечивается строением каталитического центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата:
|
Относительные размеры молекулы фермента (мол. масса 100 000, диаметр 7 нм) и типичной молекулы субстрата (мол. масса 250, длина 0,8 нм). Активный центр занимает лишь незначительную часть поверхности молекулы фермента. Для сравнения показана также молекула воды.
|
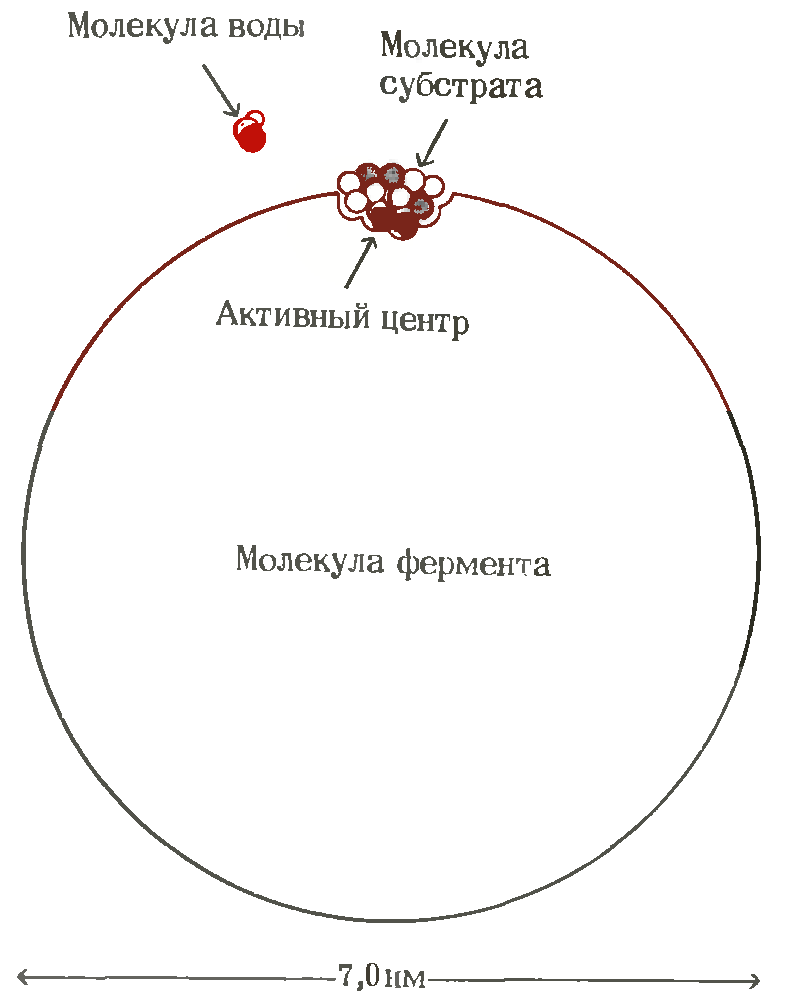
|
Функциональная значимость отдельных участков активного центра фермента:
|
|
I – этап сближения и ориентации субстрата относительно активного центра фермента;
II – образование фермент-субстратного комплекса (ES) в результате индуцированного соответствия;
III – деформация субстрата и образование нестабильного комплекса фермент0продукт (ЕР);
IV – распад комплекса (ЕР) с высвобождением продуктов реакции из активного центра фермента и освобождением фермента.
Изменение свободной энергии в ходе химической реакции, некатализируемой и катализируемой ферментами:
|
|
|
2. Кофакторы и коферменты. Ингибирование активности ферментов: обратимое, необратимое, конкурентное, неконкурентное. Регуляция скоростей синтеза и распада ферментов. Индукция и репрессия синтеза ферментов
|
Большинство ферментов для проявления активности нуждаются в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).
Белковая часть сложного фермента называется апоферментом (в отсутствии кофермента не обладает каталитической активностью). Кофермент с белковой молекулой называется холоферментом (обладает каталитической активностью).
Роль кофакторов: 1. Роль металлов в присоединении субстрата в активном центре фермента. 2. Роль металлов в стабилизации третичной и четвертичной структуры фермента. 3. Роль металлов в ферментативном катализе. 4. Роль металлов в регуляции активности ферментов
Коферменты
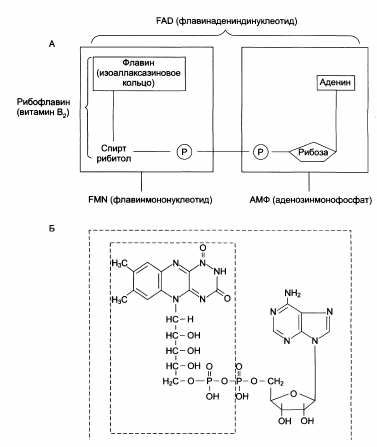
Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (ФАД, ФМН, биотин, липоевая кислота).
Примером кофермента, связанного с ферментом нековалентной связью, является тиаминдифосфат, НАД+, НАДФ+.
Разнообразие коферментов: Производные витаминов. Гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой. Нуклеотиды – доноры и акцепторы остатка фосфорной кислоты. Убихинон, или кофермент Q, участвующий в переносе электронов и протонов в цепи переноса электронов. S-аденозилметионин – донор метильной группы. Глутатион, участвующий в окислительно-восстановительных реакциях.
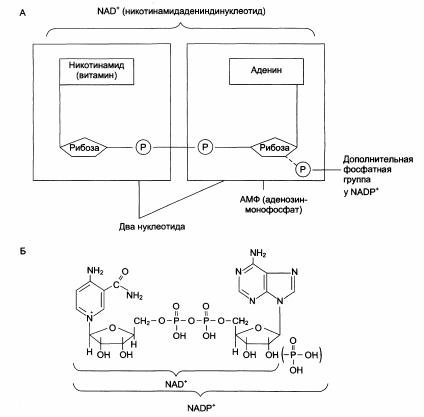
Структура (А) и химическое строение (Б) коферментов FMN (ФМН) и FAD (ФАД):
|
|
Структура (А) и химическое строение (Б) коферментов NAD+ (НАД) и NADP+ (НАДФ): →
Роль коферментов:
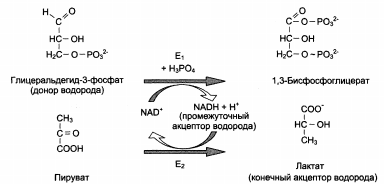
|
|
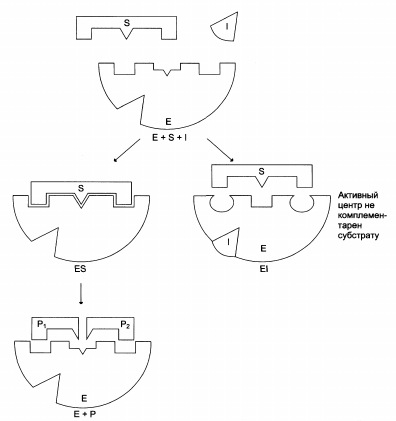
Ингибирование ферментативной активности:
Обратимое (конкурентное, неконкурентное, бесконкурентное).
Необратимое.
Схема конкурентного ингибирования активности фермента:
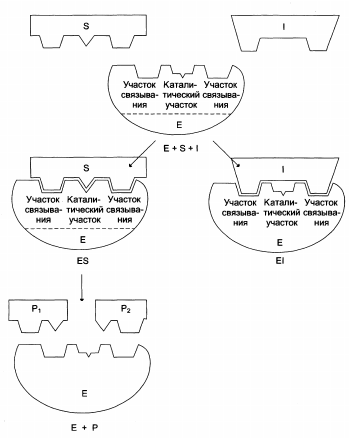
Схема неконкурентного ингибирования активности фермента:
Необратимое ингибирование
Механизм действия ионов ртути как необратимого ингибитора:
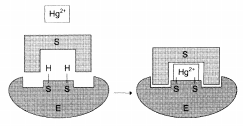
Индукция и репрессия синтеза ферментов
Клетки могут синтезировать специфические ферменты в ответ на присутствие специфических низкомолекулярных индукторов.
Ферменты, концентрация которых в клетке не зависит от добавления индукторов, называются конститутивными.
Обычно клетки содержат небольшое, но измеримое количество соответствующего фермента даже в отсутствие индуктора. Это – базовый уровень. Величина отклика данного организма на введение индуктора определяется генетически.
При индукции может наблюдаться повышение содержания фермента, варьирующее от двукратного до тысячекратного. Таким образом, содержащаяся
в клетке наследственная генетическая информация определяет и характер, и величину реакции на введение индуктора.
Примерами индуцируемых ферментов у млекопитающих являются триптофанпирролаза, треониндегидраза, тирозин-α-оксоглутарат-трансаминаза, инвертаза, ферменты цикла мочевины, HMG-СоА-редуктаза и цитохром Р-450.
|
Некоторые ферменты, для действия которых необходимы в качестве кофакторов ионы и атомы металлов:
|

|
Коферменты, выполняющие роль промежуточных переносчиков некоторых атомов или функциональных групп:
|

|
|
3. Компартментация ферментов. Аллостерическая регуляция. Ингибирование по принципу обратной связи. Ковалентная модификация ферментов: фосфорилирование и дефосфорилирование, ограниченный протеолиз проферментов
|
Пространственное распределение и клеточная компартментация ферментов, субстратов и кофакторов имеют кардинальное значение. Например, в клетках печени ферменты гликолиза локализованы в цитоплазме, а ферменты цикла лимонной кислоты – в митохондриях.
В различных тканях также наблюдается различный состав ферментов.
Регуляция скорости ферментативных реакций осуществляется на трёх независимых уровнях:
1. Изменением количества молекул фермента (индукция ферментов).
2. Доступностью молекул субстрата и кофермента.
3. Изменением каталитической активности молекулы фермента.
Основные способы регуляции активности ферментов:
Аллостерическая регуляция.
Регуляция с помощью белок-белковых взаимодействий.
Регуляция путём фосфорилирования/дефосфорилирования молекулы фермента.
Регуляция частичным (ограниченным) протеолизом.
Схема, поясняющая работу аллостерического фермента:
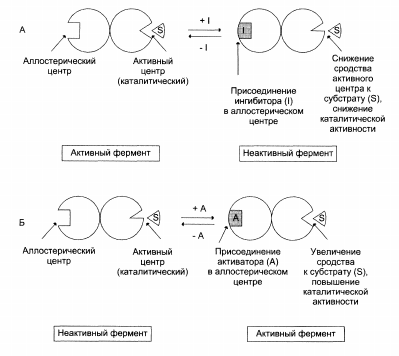
Принципы регуляции метаболических путей
Регуляция каталитической активности фермента – отрицательная обратная связь:
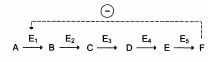
Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования:
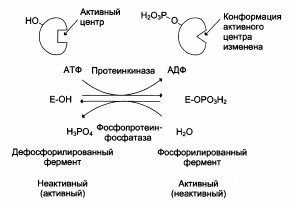
Ковалентная модификация, регулирующая работу фермента и осуществляемая путем фосфорилирования/дефосфорилирования остатка серина
|
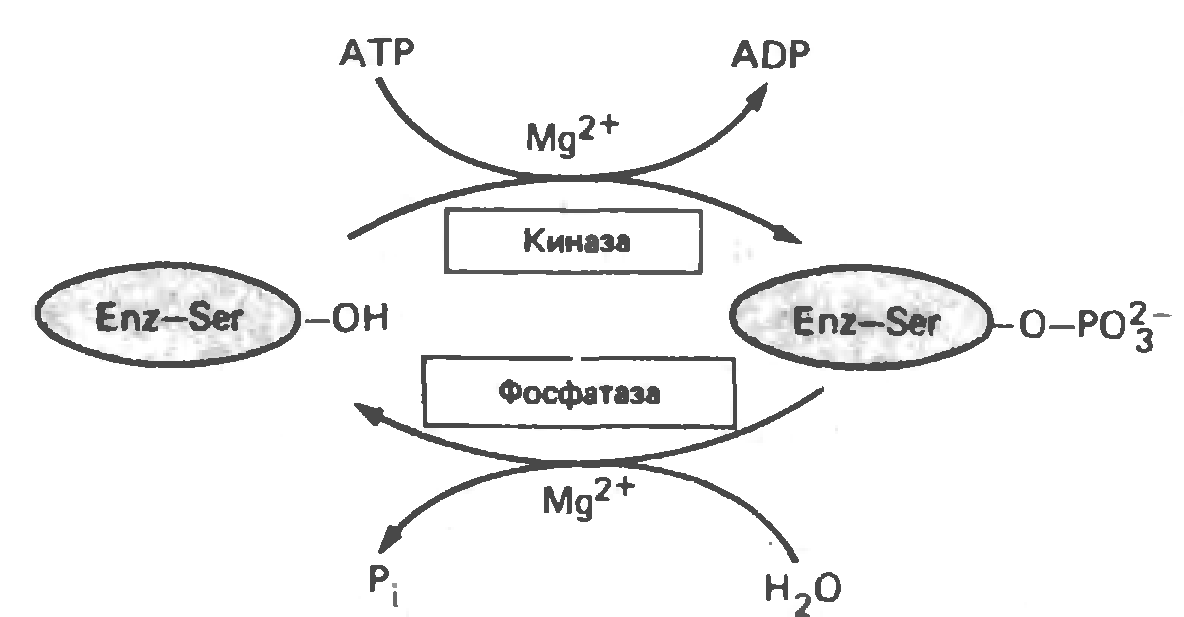
|
Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом:
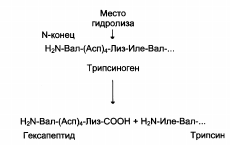
|
Гомеостаз – это способность живого организма поддерживать относительно постоянным состав внутриклеточной среды, т.е. все необходимые ферментативные реакции протекают со скоростями, соответствующими изменениям внутренней среды организма и его окружения.
Клетку или организм можно считать больными, если они неадекватно реагируют на внутреннее или внешнее воздействие.
Ингибирование по принципу обратной связи на различных участках разветвленного биосинтетического пути.
|
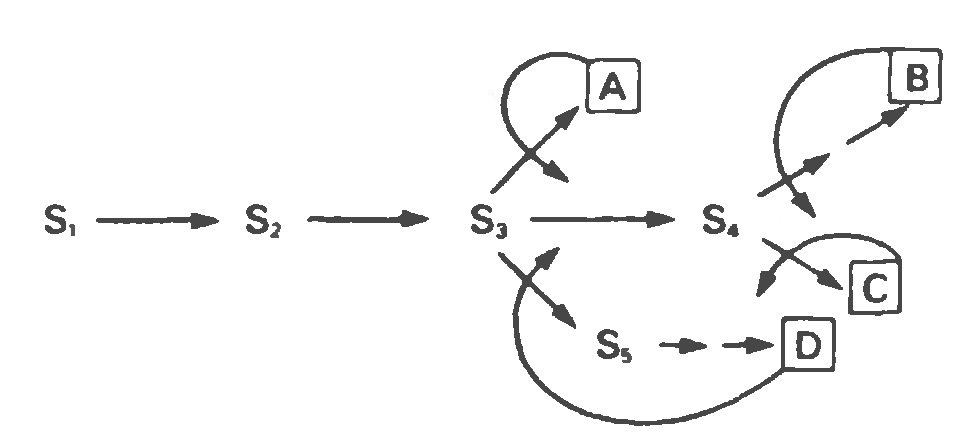
|
S1-S5 – промежуточные соединения, образующиеся в ходе биосинтеза конечных продуктов A-D. Прямые стрелки соответствуют ферментам, катализирующим указанные превращения. Кривыми стрелками указаны петли обратной связи и вероятные участки ингибирования по принципу обратной связи специфическими конечными продуктами.
Некоторые ферменты млекопитающих, каталитическая активность которых в фосфорилированном и дефосфорилированном состояниях различна (Е – дефосфофермент, ЕР – фосфофермент):
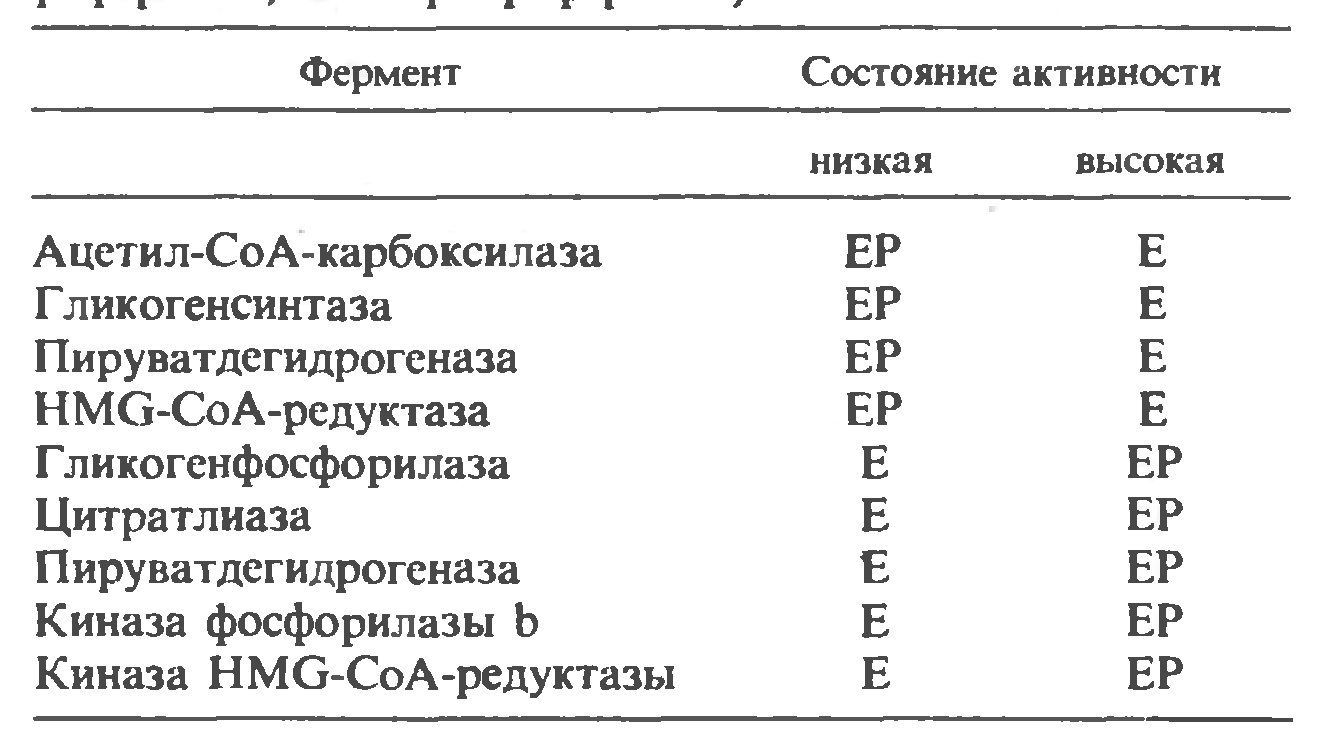
|
4. Классификация и номенклатура ферментов. Изоферменты. Органоспецифические ферменты. Энзимодиагностика и энзимотерапия. Ингибиторы ферментов как лекарственные препараты. Наследственные энзимопатии
|
Классификация ферментов (6 классов):
Оксидоредуктазы
|
Перенос электронов и протонов
|
Трансферазы
|
Перенос групп атомов, отличных
от атомов водорода
|
Гидролазы
|
Гидролиз различных связей (с участием молекулы воды)
|
Лиазы
|
Образование двойных связей за счет удаления групп или добавление групп за счет разрыва двойных связей
|
Изомеразы
|
Внутримолекулярный перенос групп с образованием изомерных форм
|
6. Лигазы (синтетазы)
|
Соединение двух молекул и образование связей С—С, С—О, С—S и С—N, сопряженных с разрывом пирофосфатной связи АТФ
|
1. Оксидоредуктазы
Дегидрогеназы

2. Трансферазы
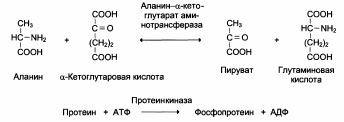
3. Гидролазы
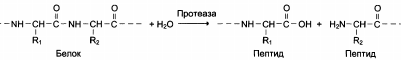
4. Лиазы
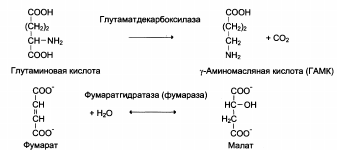
5. Изомеразы

Когда изомеризация состоит из внутримолекулярном переносе группы, фермент называют «мутазой»:

6. Лигазы (синтетазы)

В случае, когда источником энергии служит любое другое макроэргическое соединение (не АТФ), ферменты называют синтазами
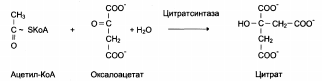
Физически различимые формы ферментов, обладающие одним и тем же видом каталитической активности, могут присутствовать в разных тканях одного организма, в разных типах клеток одной ткани и даже в прокариотическом организме, например в Е. coli.
Термин «изофермент» («изозим») охватывает все вышеупомянутые физически различимые белки с данной каталитической активностью, однако на практике, и особенно в клинической медицине, его употребляют в более узком смысле, подразумевая физически различимые и поддающиеся разделению формы данного фермента, присутствующие в различных типах клеток данного эукариотического организма, например человека. Известны изоферментные формы дегидрогеназ, оксидаз, трансаминаз, фосфатаз, трансфосфорилаз и протеолитических ферментов. В различных тканях могут находиться разные изоферменты, и эти изоферменты могут иметь неодинаковое сродство к субстратам.
Органоспецифичность
В процессе дифференцировки клеток происходит изменение ферментного состава клеток. Так, фермент аргиназа (участвует в синтезе мочевины) находится только в клетках печени, кислая фосфатаза (участвует в гидролизе моноэфиров ортофосфорной кислоты) – в клетках простаты.
Ферменты в клинической диагностике
Некоторые ферменты, проферменты и их субстраты в норме постоянно циркулируют в крови человека и выполняют физиологические функции. Примерами функциональных ферментов плазмы являются липопротеинлипаза, псевдохолинэстераза, а также проферменты компонентов систем свертывания крови и растворения кровяного сгустка. Они синтезируются в печени, и их концентрация в крови либо такая же, как в тканях, либо более высокая.
Как следует из названия, нефункциональные ферменты плазмы не выполняют в крови никаких известных физиологических функций. Их субстраты в плазме обычно не обнаруживаются, и в норме их концентрация в крови человека почти в миллион раз ниже, чем в тканях. Появление этих белков в плазме в повышенных концентрациях указывает на повышенную скорость деструкции тканей. Таким образом, измерение в крови уровня нефункциональных ферментов плазмы дает врачу ценную диагностическую и прогностическую информацию.
Диагностическое и прогностическое значение специфических ферментов:
количественное определение некоторых нефункциональных ферментов плазмы (таблица) →
Для диагностики генетических заболеваний применяют эндонуклеазы рестрикции (пренатальный скрининг наследственных нарушений благодаря картированию ДНК зародышевых клеток, находящихся в амниотической жидкости).
Энзимотерапия
Заместительная терапия (прижелудочно-кишечные заболевания, связанные с недостаточностью секреции пищеварительных соков. Препараты – фестал, креон, мезим-форте и др.).
Элементы комплексной терапии – применение ферментов в сочетании с другой терапией. Так, протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран, для удаления сгустков крови и пр. Рибонуклеазу и дезоксирибонуклеазу используют в качестве противовирусных препаратов. Ферментные препараты применяют при тромбозах и тромбоэмболиях (фибринолизин, стрептолиазы, стрептодеказы, урокиназы). Гиалуронидазу (лидаза) используют подкожно и внутримышечно для рассасывания контрактур рубцов после ожогов и операций. Ферментные препараты применяют при онкологических заболеваниях (аспарагиназа используется при лечении лейкозов).
Ингибиторы ферментов, как лекарственные препараты
Многие лекарственные препараты оказывают своё терапевтическое действие по механизму конкурентного ингибирования. Так, например, ингибиторы холинэстеразы (прозерин и др.) используют для лечения мышечных дистрофий.
В качестве ингибиторов ферментов, действующих по конкурентному механизму, в медицинской практике используют вещества, называемые антиметаболитами. С одной стороны, эти вещества, являясь структурными аналогами природных субстратов, вызывают конкурентное ингибирование ферментов, а с другой – могут использоваться этими же ферментами в качестве псевдосубстратов, что приводит к синтезу аномальных продуктов. Аномальные продукты не обладают функциональной активностью и в результате наблюдается снижение скорости определённых метаболических путей. Такими антиметаболитами являются: сульфаниламидные препараты (аналоги пара-аминобензойной кислоты), аналоги нуклеотидов и др.
Аспирин – пример лекарственного препарата, действующего по принципу необратимого ингибирования. Он необратимо ингибирует циклооксигеназу (фермент катализирует реакцию образования простагландинов из арахидоновой кислоты), в результате чего снижается образование простагландинов, которые являются, кроме всего прочего, медиаторами воспаления.
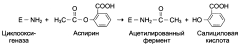
Наследственные энзимопатии
Энзимопатии – нарушения функционирования ферментов в клетке. Различают 2 вида энзимопатий: 1) первичные (наследственные – дефектные ферменты наследуются в основном по аутосомно-рецессивномутипу. Примеры – альбинизм, алкаптонурия, болезнь Гирке); 2) вторичные (приобретённые, по-видимому, наблюдаются при всех болезнях).
|
Номенклатура, введенная Международным биохимическим союзом (IUB), на первый взгляд кажется сложной и громоздкой, но зато она является однозначной. Главный ее принцип состоит в том, что ферменты называют и классифицируют в соответствии с типом катализируемой химической реакции и ее механизмом; это существенно облегчает систематизацию данных, относящихся к различным аспектам метаболизма. Основные черты системы, введенной IUB, состоят в следующем.
1. Реакции и ферменты, которые их катализируют, подразделяются на шесть классов, в каждом из которых имеется несколько подклассов (от четырех до 13).
2. Название фермента состоит из двух частей: первая часть – название субстрата (или субстратов); вторая указывает тип катализируемой реакции и
оканчивается на -аза.
3. Дополнительная информация, если она необходима для уточнения, заключается в скобки.
4. Каждый фермент имеет кодовый номер по классификации ферментов (КФ): первая цифра характеризует класс реакции, вторая – подкласс и третья —
подподкласс. Четвертая цифра указывает порядковый номер фермента в его подподклассе. Таким образом, КФ 2.7.1.1 означает, что фермент относится к классу 2 (трансфераза), подклассу 7 (перенос фосфата) и подподклассу 1 (акцептором фосфата является спирт). Последняя цифра обозначает фермент гексокиназу, или АТР: D-гексозо-б-фотрансферазу, т.е. фермент, катализирующий перенос фосфата с АТР на гидроксильную группу атома углерода в шестом положении глюкозы.
Медицинский интерес к изозимам возник после того, как было обнаружено, что сыворотка человека содержит несколько изознмов лактатдегидрогеназы и что их относительное содержание значительно изменяется при определенных патологических состояниях. Впоследствии было выявлено много других случаев изменения относительного содержания изозимов при разных заболеваниях.

Приведите примеры других наследственных энзимопатий и их клинические проявления.
|
5. Практическое значение анализа изоферментных спектров в крови (ЛДГ, КК и др.). Применение ферментов как аналитических реагентов при лабораторной диагностике
|
Физически различимые формы ферментов, обладающие одним и тем же видом каталитической активности, могут присутствовать в разных тканях одного организма, в разных типах клеток одной ткани и даже в прокариотическом организме. В более узком смысле изоферменты (изозимы) – это физически различимые (различаются по первичной структуре) и поддающиеся разделению формы данного фермента, присутствующие в различных типах клеток данного эукариотического организма, например человека.
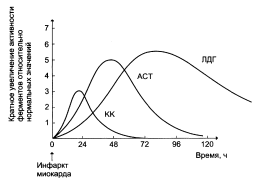
Сыворотка человека содержит несколько изознмов лактатдегидрогеназы (ЛДГ) и их относительное содержание значительно изменяется при определенных патологических состояниях. ЛДГ (тетрамер) катализирует реакцию образования пирувата из лактата:
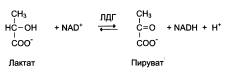
Изозимы лактатдегидрогеназы:
I1
I2
I3
I4
I5
|
Субъединичный состав:
НННН
НННМ
ННММ
НМММ
ММММ
|
Изоформы креатинкиназы
Креатинкиназа (КК) это димер, который катализирует реакцию образования креатинфосфата:
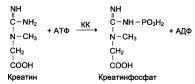
Существует 3 изофермента – ВВ, МВ, ММ (В – brain – мозг, М – musle – мышца). Изофермент ВВ преимущественно находится в мозге, ММ – в скелетных мышцах, МВ – в сердечной мышце. В норме активность КК не должны превышать 90 МЕ/л.
Энзимодиагностика
Энзимодиагностика – это постановка диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принцип энзимодиагностики основан на следующих позициях:
при повреждении клеток в крови (или другой биологической жидкости) увеличивается концентрация внутриклеточных ферментов повреждённых клеток;
количество высвобождённого фермента достаточно для его обнаружения;
активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени и отличается от нормальных значений;
ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность);
существуют различия во внутриклеточной локализации ряда ферментов.
С помощью ферментов можно также определять содержание различных веществ в биологических жидкостях (глюкоза, холестерин и др.).
|
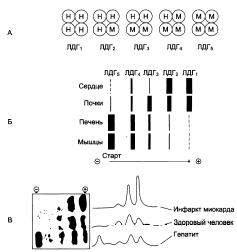
А – строение различных изоформ ЛДГ; Б – распределение на электрофореграмме и относительные количества изоформ ЛДГ в различных органах; В – содержание изоформ ЛДГ в плазме крови в норме и при патологии.
Изменение активности ферментов в плазме крови при инфаркте миокарда.
|
|
|
|
 Скачать 0.84 Mb.
Скачать 0.84 Mb.






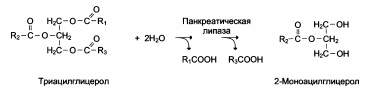
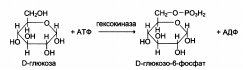
 аталитическая специфичность
аталитическая специфичность