Анализ железа в водопроводной воде. МЕТОДЫ КОНТРОЛЯ И АНАЛИЗА КУРСОВИК. Методы определения ионов Fe и Fe в питьевой и водопроводной воде
 Скачать 200.81 Kb. Скачать 200.81 Kb.
|
|
Министерство науки и высшего образования РФ  Федеральное государственное бюджетное образовательное Федеральное государственное бюджетное образовательное учреждение высшего образования Санкт-Петербургский горный университет Кафедра Металлургии КУРСОВАЯ РАБОТА По дисциплине Методы контроля и анализа веществ (наименование учебной дисциплины согласно учебному плану) Тема: Методы определения ионов Fe 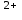 и Fe и Fe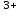 в питьевой и водопроводной воде. в питьевой и водопроводной воде.Выполнил: студент гр. МЦ-17 Муратов М.Д. (шифр группы) (подпись) (Ф.И.О.) Проверил: доцент Цыбизов А.В. (должность) (подпись) (Ф.И.О.) Санкт-Петербург 2020 Аннотация В данной курсовой работе рассматриваются методы определения ионов Fe 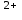 и Fe и Fe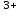 в питьевой и водопроводной воде. в питьевой и водопроводной воде.Приведены краткие теоретические данные по содержанию ионов железа, ПДК железа в воде, влияние железа на организм человека. Рассмотрены методы определения железа в воде. Произведено два лабораторных анализа: перманганатометрическое определение содержания железа (+2) и фотоколориметрические методы анализа определения содержания ионов железа в воде. Теоретически рассмотрены методы обезжелезивания воды. Курсовая работа содержит 17 страниц, 2 рисунка и 1 график. Annotation This course work discusses methods for determining Fe 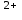 and Fe and Fe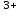 ions in drinking and tap water. ions in drinking and tap water.Brief theoretical data on the content of iron ions, the maximum concentration of iron in water, and the effect of iron on the human body are presented. Methods for determining iron in water are considered. Two laboratory analyses were performed: permanganatometric determination of iron content (+2) and photocolorimetric analysis methods for determining the content of iron ions in water. Methods of water de-Ironing are theoretically considered. The course work contains 17 pages, 2 figures and 1 graph. Содержание Введение 5 ПДК железа в воде. Польза и вред. Влияние на организм 6 Методы определения железа в воде 7 Визуальный анализ 7 Лабораторный анализ 7 Перманганатометрическое определение содержания железа (+2) 7 Фотоколориметрические методы анализа определения содержания ионов железа в воде 9 Визуальные колориметрические методы 11 Фотоэлектрический метод анализа 12 Методы обезжелезивания воды 15 Заключение 16 Список использованных источников 17 ВведениеВода – одно из самых распространённых веществ в природе (гидросфера занимает 71 % поверхности Земли). Воде принадлежит важнейшая роль в геологии. Без воды невозможно существование живых организмов, так как даже хотя бы рассмотреть тело человека, то оно почти на 63% - 68% состоит из воды. Практически все биохимические реакции в каждой живой клетке – это реакции в водных раствора. Вода – среда обитания для многих живых организмов. В растворах же протекает большинство технологических процессов на предприятиях химической промышленности, в производстве лекарственных препаратов и пищевых продуктов. И в металлургии вода чрезвычайно важна, причём не только для охлаждения. Не случайно гидрометаллургия – извлечение металлов из руд и концентратов с помощью растворов различных реагентов – стала важной отраслью промышленности. Природная вода содержит растворенные соли, газы, органические вещества. К основным можно отнести Cl, Na, Ca, Mg, HCO,K. Другие ионы находятся в гораздо меньших количествах. Но основное внимание в данной работе будет уделено ионам Fe 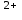 и Fe и Fe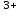 . .Повышенное содержание железа в воде, особенно в питьевой воде, является постоянной проблемой жителей городов, использующих водопроводную воду, и сельских местностей, использующие воду из скважин и колодцев. Железистая вода негативно влияет на здоровье человека (особенно Fe 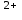 ,негативно влияющий на печень и почки), сильно сокращает срок эксплуатации сантехники (происходит зарастание труб) и бытовых приборов (у стиральных машин значительно ухудшается качество стирки, и убивается мягкость одежды). Имеет неприятный вкус, цвет и запах. ,негативно влияющий на печень и почки), сильно сокращает срок эксплуатации сантехники (происходит зарастание труб) и бытовых приборов (у стиральных машин значительно ухудшается качество стирки, и убивается мягкость одежды). Имеет неприятный вкус, цвет и запах.В природных водах железо в основном встречается в форме Fe 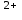 и Fe и Fe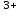 . Определить, что в воде есть данные ионы иногда можно даже и невооруженным взглядом. Например, набрав свежую воду из скважины, и, дав ей постоять открытой на воздухе, можно заметить, что вода окрашивается постепенно в коричневый цвет. Это связано с тем, что растворимое соединение двухвалентного железа вступает в реакцию с кислородом воздуха и переходит в нерастворимую форму трехвалентного железа, которая простым языком называется ржавчиной. . Определить, что в воде есть данные ионы иногда можно даже и невооруженным взглядом. Например, набрав свежую воду из скважины, и, дав ей постоять открытой на воздухе, можно заметить, что вода окрашивается постепенно в коричневый цвет. Это связано с тем, что растворимое соединение двухвалентного железа вступает в реакцию с кислородом воздуха и переходит в нерастворимую форму трехвалентного железа, которая простым языком называется ржавчиной. ПДК железа в воде. Польза и вред. Влияние на организмЖелезо в воде встречается в двух формах: Трехвалентная (окисленная), ржавчина. Окрашивает воду в бурый цвет и хлопьями оседает на дне; Двухвалентная (растворенная). Изначально не заметно в воде. Можно определить по запаху и привкусу металла в воде. Проявляется в виде бурого осадка только после контакта с водой. Двухвалентное железо также проявляется в том, что оно оставляет желтые следы на поверхностях емкостей, в которых находится вода с высоким его содержанием. Согласно нормам СанПин, допустимое содержание железа в питьевой воде может достигать не более 0,3 мг/л (имеется ввиду суммарное количество Fe 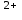 и Fe и Fe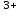 ). Превышение данной нормы легко ощутимо по запаху, цвету и вкусу. ). Превышение данной нормы легко ощутимо по запаху, цвету и вкусу. Содержащая железо вода изначально прозрачна на вид. Однако даже при непродолжительном контакте с кислородом воздуха железо окисляется, придавая воде желтовато-бурую окраску. Уже при концентрациях железа выше 0,3 мг/л такая вода способна вызвать появление ржавых потеков на сантехнике и пятен на белье при стирке. При содержании железа выше 1 мг/л вода становится мутной, окрашивается в желто-бурый цвет, у нее ощущается характерный металлический привкус. Все это делает такую воду практически неприемлемой как для технического, так и для питьевого применения. Организму человека необходимо железо, и суточная норма варьируется в интервале 15-22 мг. Практически все нужное количество железа организм получает из пищи: мяса, круп, овощей и фруктов с высоким содержанием необходимого элемента. Избыток железа, марганца и других примесей не только не усвоится, но и может навредить. Большое содержание металла может нанести серьезный вред организму. Избыток железа чреват заболеваниями: Поражениям тканей; Болезнями почек и печени; Вялостью и снижением иммунитета; Сухостью кожи и ломкостью волос; Увеличение риска инфарктов. Вода с повышенным содержанием железа также может навредить имуществу: Коррозия сантехники и нагревательных приборов; Ржавые пятна на постиранных вещах; Налет на металлических приборах (часто можно наблюдать в чайнике); Нарастание водопроводных труб. Методы определения железа в водеВизуальный анализОпределить наличие железа в воде может абсолютно любой человек, не обладая большим количеством знаний в области химии. Данный анализ имеет очевидную погрешность, так как точно определить количество железа данным методом не является возможным. Но зная определенные признаки избытка железа в воде, можно сделать вывод о наличии данного элемента. К этим признакам относятся: Железистая вода отличается цветностью (бурый цвет трехвалентного окисленного железа); Вода пахнет железом и имеет специфический металлический привкус при пробе; Вода прозрачная (двухвалентное железо), но желтеет по мере нахождения на открытом воздухе (железо окисляется до трехвалентного), ржавчина выпадает в осадок и оседает; Если поверхности, в которых хранится вода, желтеют, то это означает, что используется вода, имеющая повышенное содержание железа.  Рисунок 1. Образец ржавой воды из-под крана, отстоявшейся на открытом воздухе в течение 3 часов Лабораторный анализПерманганатометрическое определение содержания железа (+2)Берется три пробы: Проба ржавой водопроводной воды; Проба водопроводной на вид прозрачной воды (взята в Горном Университете); Питьевая вода «Святой источник». Так как мы заведомо знаем, что концентрация Fe 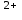 достаточно мала, то для максимальной точности эксперимента было отобрано по 5 л вышеуказанной воды. достаточно мала, то для максимальной точности эксперимента было отобрано по 5 л вышеуказанной воды.Сущность работы заключается в следующей реакции:  От первой избыточной капли титранта появляется розовая окраска, по которой отмечают эквивалентную точку. Содержание протокола работы: Объем аликвоты Val =2500 мл Концентрация перманганата калия CN(KMnO4) =0,1 экв/л. Эксперимент на пробе №1. Объём перманганата калия, расходованный на титрование: V1(KMnO4) = 1,9 мл; V2(KMnO4) = 1,4 мл; Vср(KMnO4) =1,65 мл. 1. Вычислена нормальная концентрация железа (II) в пробе:  2. Выражено содержание железа (II) в пробе в мг/л: 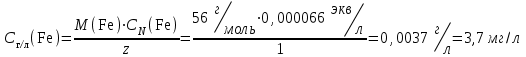 Эксперимент на пробе №2. Объём перманганата калия, расходованный на титрование: V1(KMnO4) = 0,3 мл; V2(KMnO4) = 0,3 мл; Vср(KMnO4) = 0,3 мл. 1. Вычислена нормальная концентрация железа (II) в пробе: 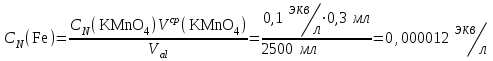 2. Выражено содержание железа (II) в пробе в мг/л: 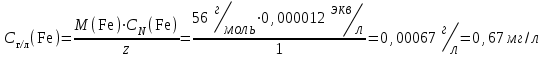 Эксперимент на пробе №3. Данный метод на чистой питьевой воде марки «Святой источник» показал, что содержание железа (II) в данной пробе не может быть определено в рамках данного эксперимента, так как содержание Fe 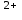 максимально приближено к нулю. максимально приближено к нулю. Вывод к эксперименту. В ходе выполнения данной работы было проведено титрование трех проб воды перманганатом калия. Эксперимент показал, что содержание двухвалентного железа в ржавой воде 10 раз превышает нормы ПДК, водопроводная вода Горного Университета также имеет повышенное содержание железа и выше нормы ПДК. В питьевой воде марки «Святой источник» ион Fe 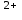 в данном эксперименте не выявлен, содержание данного иона в питьевой воде стремится к нулю, ПДК данного элемента не превышает норму, питьевая вода «Святой источник» пригодна в пищу. в данном эксперименте не выявлен, содержание данного иона в питьевой воде стремится к нулю, ПДК данного элемента не превышает норму, питьевая вода «Святой источник» пригодна в пищу.Фотоколориметрические методы анализа определения содержания ионов железа в водеФотоколориметрия — метод анализа, основанный на измерении поглощения света окрашенными растворами в видимой части спектра (400-760 нм). Определяемый ион с помощью реактива приводят в устойчивое окрашенное соединение постоянного состава и интенсивной окраски (комплексные соединения), затем проводится дальнейшее исследование. В  данном случае определение железа основано на способности катиона Fe 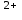 в интервале pH = 3-9 образовывать с орто-фенантролином комплексное оранжево-красное соединение. Анализ проводится в ацетатном буферном растворе при pH = 4,5-4,7. в интервале pH = 3-9 образовывать с орто-фенантролином комплексное оранжево-красное соединение. Анализ проводится в ацетатном буферном растворе при pH = 4,5-4,7. Рисунок 2. Схема реакции образования комплексного соединения При наличии в воде Fe 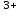 оно восстанавливается солянокислым гидроксиламином до Fe оно восстанавливается солянокислым гидроксиламином до Fe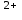 по реакции: по реакции: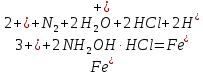 Образовавшееся в результате восстановления Fe 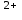 далее вступает в реакцию с орто-фенантролином. Таким образом, в пробе определяется суммарное содержание Fe далее вступает в реакцию с орто-фенантролином. Таким образом, в пробе определяется суммарное содержание Fe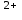 и Fe и Fe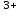 . .Между интенсивностью окраски и содержанием в этом растворе окрашенного вещества, содержащего анализируемый ион, существует зависимость, называемая законом Бугера-Ламберта-Бера: I=I0·10-ɛCl , где: I - интенсивность света, прошедшего через раствор; I0 - интенсивность падающего на раствор света; ε - коэффициент поглощения света (постоянная величина, характерная для каждого окрашенного вещества и зависящая от его природы); С - концентрация окрашенного вещества в растворе; концентрация анализируемого иона; l - толщина светопоглощающего слоя. Физический смысл этого закона заключается в том, что растворы одного и того же окрашенного вещества при одинаковой концентрации и толщине слоя раствора поглощают равное количество световой энергии. В зависимости от способа измерения концентрации веществ в окрашенных растворах и от применяемой аппаратуры методы фотоколориметрического метода анализа подразделяют на визуальный и фотоэлектрический. Визуальные колориметрические методыМетод стандартных серий (метод цветной шкалы). Приготавливают ряд стандартных растворов какого-либо вещества с постепенно изменяющимися концентрациями в определенном объёме растворителя. Помещают определенный объём каждого стандартного и такой же объем анализируемого раствора в пробирку, добавляют равные объемы необходимых реактивов. Сравнивают интенсивность полученной окраски исследуемого и стандартных растворов. Метод дает приближенные результаты, и во время работы необходимо часто возобновлять шкалу из-за неустойчивости окраски некоторых стандартных растворов. При выполнении анализа методом стандартных серий соблюдение основного закона колориметрии (закона Бугера-Ламберта-Бера) не является обязательным из-за большой погрешности метода. Метод колориметрического титрования (метод дублирования). Определенный объем анализируемого окрашенного раствора неизвестной концентрации сравнивают с таким же объемом воды, к которой добавляют из бюретки окрашенный стандартный раствор того же вещества определенной концентрации до уравнивания интенсивности окрасок. По совпадению интенсивности окрасок стандартного и исследуемого растворов определяют содержание вещества в растворе неизвестной концентрации. Метод неприменим при реакциях, протекающих медленно, и при необходимости дополнительных обработок (кипячение, фильтрование и др.). Метод уравнивания. Сравнение интенсивности окрасок анализируемого и стандартного растворов проводят в колориметрах. Метод основан на том, что, изменяя толщину слоя двух растворов с различной концентрацией одного и того же вещества, добиваются такого состояния, при котором интенсивность светового потока, прошедшего через оба раствора, будет одинакова — наступает оптическое равновесие. Метод уравнивания является наиболее точным методом визуального колориметрирования. Метод разбавления. Одинаковую интенсивность окраски анализируемого и стандартного растворов получают путем постепенного разбавления водой или соответствующим растворителем того раствора, который более окрашен. Фотоэлектрический метод анализаФотоэлетрический метод анализа - метод анализа, основанный на поглощении световых потоков, анализ проводят с помощью приборов фотоколориметров в видимой области спектра. Сущность метода заключается в следующем: Готовят серию стандартных окрашенных растворов, т.е. растворов с разным, но известным количеством анализируемого иона. Измеряют оптическую плотность стандартных окрашенных растворов. По полученным данным строят градуировочный график. Готовят анализируемый окрашенный раствор, измеряют его оптическую плотность Ах и по градуировочному графику, соответственно Ах, определяют Сх – содержание иона в анализируемом растворе. Ход работы: 1. Приготовление градуировочных растворов. Из раствора соли железа с концентрацией 1000 мг/дм3 получили раствор с концентрацией 100 мг/дм3 для более удобных дальнейших расчетов. Для этого с помощью дозатора отобрали 5 мл исходного раствора (по закону сохранения масс) в колбу объемом 50 мл и долили до отметки дистиллированную воду. Тщательно перемешали. Далее из этого раствора с концентрацией 100 мг/дм3 готовили градуировочные растворы с концентрациями 0,5, 1 и 2 мг/дм3. По закону сохранения масс: C1V1 = C2V2 (где Cn – концентрации растворов, Vn – объемы растворов) находим объемы раствора 100 мг/дм3 необходимые для приготовления градуировочных растворов: для 0,5 мг/дм3 – 0,25 мл; для 1 мг/дм3 – 0,5 мл; для 2 мг/дм3 – 1 мл; для 4 мг/дм3 – 2 мл. Отобрали с помощью дозатора эти объемы в колбы 50 мл и долили до отметки дистиллированную воду. Тщательно перемешали. 2. Приготовление окрашенных стандартных растворов и пробы воды. Отобрали в склянки по 10 мл каждого градуировочного раствора и аназилируемой воды (склянки необходимо предварительно ополоснуть дистиллированной водой). Используя универсальную индикаторную бумагу, определили pH воды. С помощью пипетки, а также, в зависимости от pH среды, растворы гидроксида натрия или соляной кислоты, довели до pH = 4-5. В каждую склянку добавили 0,2 мл раствора солянокислого гидроскиламина. Склянки закрыли пробками и встряхнули для перемешивания растворов. Далее поочередно добавили 1,0 мл ацетатного буферного раствора и 0,5 мл раствора орто-фенантролина. После каждого прибавления склянки закрывали пробками и встряхивали для перемешивания раствора. Растворы в склянках оставили на 20 минут для полного развития окраски. Далее провели визуальное колориметрирование и фотоэлектроколориметрирование. Обработка результатов эксперимента В данном эксперименте также берутся 3 пробы воды, как и в предыдущем опыте. В результате сравнения окраски пробы с окраской образцов на цветной контрольной шкале определили концентрацию железа в исследуемом образце воды: Ржавая вода Спробы ≈ 3,5 мг/ дм3; Водопроводная вода Спробы ≈ 0,5 мг/ дм3 (по цвету идентично с первым градуировочным раствором); Питьевая вода не имеет окраски. Можно сделать вывод, что, как и в прошлом эксперименте, концентрация ионов железа приближено к нулю. В результате фотоэлектрического анализа были получены значения оптической плотности и светопропускаемости растворов при 𝜆 = 470 нм. Таблица 1. Результаты измерений
По полученным данным строим калибровочный график для определения концентрации проб. График приведен на миллиметровой бумаге в приложении эксперимента. Спробы (ржавая вода) ≈ 3,14 мг/л. Спробы (водопроводная вода) ≈ 0,48 мг/л. Спробы (питьевая вода марки « Святой источник») ≈ 0,05 мг/л. Вывод к эксперименту: В ходе выполнения эксперимента с помощью фотоколориметричекого метода анализа была определена концентрация ионов железа в пробе воды. Были рассмотрены визуальный и фотоэлектрический методы фотоколориметрического анализа. Результаты визуального метода анализа имеют значительную погрешность. Фотоэлектрический анализ показал самое точное содержание ионов железа в пробах воды (например, только данный вывод смог определить концентрацию ионов железа в питьевой воде). Определена концентрация ионов железа в ржавой и водопроводной воде, которая превышает ПДК. Методы обезжелезивания водыУпрощенная аэрация Метод основан на способности воды, содержащей двухвалентное железо и растворенный кислород, при фильтрации через слой загрузки выделять образованное в процессе окисления кислородом трехвалентное железо на поверхности зерен загрузки. В процессе аэрации кислород воздуха окисляет двухвалентное железо, при этом из воды удаляется углекислота, что ускоряет процесс окисления и последующий гидролиз с образованием гидроксида железа. Преимущества: Низкая стоимость обезжелезивания по сравнению с другими методами; улучшение вкусовых качеств воды вследствие обогащения воды кислородом; экологическая безопасность при отсутствии предварительной обработки воды реагентами-окислителями. Недостатки: Неэффективно при высоких концентрациях железа в воде; При высоких концентрациях железа в воде требуется предварительная обработка воды реагентами-окислителями. Коагулляция и осветление Метод основан на образовании с помощью коагулянтов хлопьев, которые образуются из нерастворенных соединений железа. В процессе отстаивания хлопья выпадают в осадок. Для ускорения протекания процесса коагуляции в воду вводят флокулянты, способствующие укрупнению хлопьев. Преимущества: Ускорение естественного процесса осаждения трехвалентного железа; Связывание в хлопья коллоидных частиц трехвалентного железа с последующим осаждением. Недостатки: Необходимость соблюдения четкого количества дозирования коагулянта; Необходимость помещения для хранения коагулянтов. 3. Ионообменный метод Для удаления железа данным методом применяются катиониты — синтетические ионообменные смолы. Синтетические ионообменные смолы способны удалять из воды не только растворённое двухвалентное железо, но также и другие двухвалентные металлы, в частности кальций и магний. Теоретически методом ионного обмена можно удалять из воды очень высокие концентрации железа, при этом не потребуется стадии окисления двухвалентного железа с целью получения нерастворимого гидроксида. Преимущества: Глубокая степень обезжелезивания; Возможность регенерации загрузочного материала; Отсутствие осадка после обработки воды. Недостатки: Необходимость периодической замены загрузочного материала в фильтрах без предусмотренной функции регенерации, в связи с этим необходимы дополнительные затраты денежных средств; Высокая стоимость фильтров с предусмотренной функцией регенерации; При присутствии в воде трехвалентного железа происходит неизбежное засорение смолы и проблематичное удаление его из загрузочного материала; Во избежание увеличения концентрации трехвалентного железа в очищаемой воде необходимо следить за концентрациями кислорода и реагентов-окислителей в ней; Наличие в очищаемой воде органического железа приводит к быстрому зарастанию ионообменной смолы. 4. Оборотный осмос Метод основан на продавливании воды через полупроницаемую мембрану, которая не пропускает мельчайшие примеси. В результате чего вода после прохождения через полупроницаемую мембрану становится дистиллированной. Преимущества: Глубокая степень обезжелезивания; Очистка воды практически от всех видов загрязнений. ЗаключениеБольшое количество ионов железа в воде значительно ухудшает качество воды. Вода, содержащая концентрацию ионов более 0,3 мг/л не применима в пищу, также такой водой не стоит пользоваться в хозяйственных целях. В данной лабораторной работе было проведено несколько экспериментов, позволяющих определить содержание ионов железа в отобранных пробах воды: Перманганатометрическое определение содержания железа (+2). Данный эксперимент показывает приблизительное значение концентрации ионов железа в отобранных растворах. Как и предполагалось, содержание железа в ржавой воде в разы превышает нормы ПДК, а питьевая вода не содержит железа, исходя из данного эксперимента. Визуальный колометрический метод. Данный анализ также далек от точного определения концентрации железа в пробах воды. В данном методе была приготовлена шкала цветных растворов с известными концентрациями, по которым было произведено сравнение с пробами воды. Измерения с незначительной погрешностью схожи с результатами первого эксперимента. Фотоэлектрический метод. Данный анализ наиболее точно показал концентрацию ионов железа в пробах воды. Для каждой пробы при одинаковом значении длины волны была определена оптическая плотность. Также была определена оптическая плотность для растворов с известными концентрациями. Был построен калибровочный график, благодаря которым было возможным найти максимально точно концентрацию ионов железа в пробах воды. В теории были рассмотрены лабораторные методы обезжелезивания воды с их преимуществами и недостатками. Список использованных источниковГерасимова Н.С.. Фотоколориметрические методы анализа: Методические указания к выполнению домашних заданий по аналитической химии. – М: Издательство МГТУ им. Н.Э. Баумана, 2010. – 40 с. Стифатов Б.М.. Фотометрический анализ. – Самара: Издательство Самарский государственный университет, 2017. – 34 с. Авалов Н.В.. Основы аналитической химии. В 2 т. – М: Издательский центр «Академия», 2012. – 416 с. https://www.msulab.ru/ Лекомцев, В. Р. Молодой ученый. Обзор основных методов обезжелезивания воды. – М: 2017. – 246 с. Торосян В.Ф.. Аналитическая химия и физико-химические методы анализа. Практическое руководство: учебно-методическое пособие – Томск: Изд-во Томского политехнического университета, 2010. – 195 с. |
