Методические указания дисциплины б в. Дв 1 Биохимия пищеварения и питания
 Скачать 287 Kb. Скачать 287 Kb.
|
На правах рукописи Минобрнауки России Федеральное государственное бюджетное образовательное учреждение высшего образования «Оренбургский государственный университет» Кафедра биохимии и микробиологии МЕТОДИЧЕСКИЕ УКАЗАНИЯ ДИСЦИПЛИНЫ «Б.1.В.ДВ.2.1 Биохимия пищеварения и питания» Уровень высшего образования БАКАЛАВРИАТ Направление подготовки 06.03.01 Биология (код и наименование направления подготовки) Биохимия (наименование направленности (профиля) образовательной программы) Тип образовательной программы Программа академического бакалавриата Квалификация Бакалавр Форма обучения Очная Год набора 2018 Методические указания рассмотрены и утверждены на заседании кафедры Кафедра биохимии и микробиологии наименование кафедры протокол № _7_______от "25___" _01________ 2018 г. Заведующий кафедрой Кафедра биохимии и микробиологии Е.С. Барышева наименование кафедры подпись расшифровка подписи Исполнители: Зав. кафедрой БХМБ Е.С. Барышева должность подпись расшифровка подписи № регистрации РП
Содержание Статья I. Раздел 1 Биохимия пищеварения и питания. Лабораторный практикум 4 1.1 Лабораторная работа №1. Переваривание в ротовой полости 4 2.2 Лабораторная работа № 2. Участие пепсина в переваривании белков 5 1.3 Лабораторная работа № 3. Состав желудочного сока 6 1.4 Лабораторная работа №4 Особенности расщепления жиров в тонком кишечнике 9 1.5 Лабораторная работа № 5. Влияние поджелудочной железы на переваривание нутриентов 10 1.6 Лабораторная работа № 6. Особенности расщепления простых и сложных углеводов 12 1.7 Лабораторная работа №7. Белковый обмен, конечные продукты обмена 13 Список использованных источников 17 Статья I.Раздел 1 Биохимия пищеварения и питания. Лабораторный практикум1.1 Лабораторная работа №1. Переваривание в ротовой полостиНа местах повреждения слизистой оболочки полости рта происходит эмиграция гранулоцитов, которые принимают участие в защитных реакциях. В гранулоцитах локализован фермент лактопероксидаза, которая окисляет имеющийся в слюне роданид с помощью перекиси водорода бактериального происхождения в гипотиоционат: 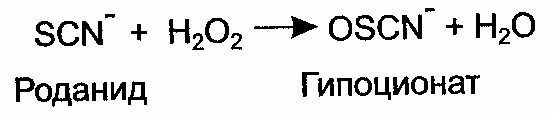 Гипотиоционат чрезвычайно бактерициден и совместно с Н2О2 или ее радикалами действует антикариесогенно. Содержание роданидов велико в слюне курильщиков, что связано с поступлением в их организм синильной кислоты табачного дыма. Роданиды слюны обнаруживают по появлению красного окрашивания придобавлении к слюне хлорного железа. Это типичная и чувствительная реакция на роданиды обусловлена образованием роданистой соли трехвалентного железа в результате взаимодействия ионов Fe3+ и SCN и образования различных комплексов, имеющих состав от Fe(H2O)5NCS2+ до Fe(NCS)63. Некоторые органические соединения, например, соли лимонной и уксусной кислот, препятствуют образованию окраски. Реактивы: 1) Хлорное железо, 0,01 %раствор; 2) Соляная кислота, 2 %раствор. Техника: 1) К 5 каплям слюны добавляют 2 капли 2 % раствора HCI и 2 капли 0,01% раствора FeCl3; 2) Развивается красное окрашивание. Рекомендации к составлению протокола При составлении протокола сравните интенсивность окраски роданида железа в слюне курильщика и у некурящих табак. Определение рН слюны Изменение рН в щелочную сторону связано с увеличением количества кальция и фосфора в слюне. Рост концентрации кальция в слюне может приводить к образованию камней в протоках слюнных желез. Если рН слюны снижается, это говорит о недостатке кальция и фосфора в слюне. Сдвиг рН слюны в кислую сторону, нарушает процессы минерализации тканей зуба и способствует развитию кариеса, а также созданию условий для воздействия кислых протеиназ на ткани пародонта. Реактивы Индикаторная бумага. Техника Каплю слюны наносят на универсальную индикаторную бумагу. Немедленно выравнивают полученную окраску со шкалойрНот6,0до8,0 Рекомендации к составлению протокола Записать в лабораторный журнал наблюдения, сделанные в процессе работы, и отметить, что слюна имеет рН, близкий к нейтральному (6,4-7,0). 2.2 Лабораторная работа № 2. Участие пепсина в переваривании белковПереваривание белков начинается в желудке под влиянием желудочного сока. Желудочный сок, выделяемый железами слизистой оболочки стенок желудка, представляет собой жидкость, содержащую 99 % воды, свободную соляную кислоту, кислореагирующие фосфаты, хлористый натрий, протеолитический фермент — пепсин, липолитический фермент — липазу (расщепляет только эмульгированный жир и другие вещества). Пепсин выделяется главными клетками желез слизистой желудка в виде неактивного профермента — пепсиногена. Под влиянием соляной кислоты от пепсиногена отщепляются полипептиды, в результате чего пепсиноген превращается в активный фермент пепсин, способный к гидролитическому расщеплению пептидных связей белков. Оптимальное значение рН для пепсина человека составляет 1,5-2,5. В нейтральной и щелочной средах пепсин неактивен. Соляная кислота не только участвует в активации пепсиногена и создании оптимального значения рН, но и способствует набуханию и денатурации белков, что создает более благоприятные условия для действия пепсина. Пепсин является эндопептидазой, так как действует преимущественно на внутренние пептидные связи. Однако под влиянием пепсина разрываются также некоторые пептидные связи, находящиеся на конце полипептидной цепи, что сопровождается появлением свободных аминокислот. В результате гидролиза белков пепсином образуются пептоны — смесь более или менее сложных полипептидов, а также в небольшом количестве свободные аминокислоты. Реактивы и материалы: 1) Фибрин. 2) Желудочный сок или 0,1 % раствор пепсина в 0,2 % соляной кислоте; 3) Натрий углекислый, 2 %раствор; 4) Едкий натрий, 0,4 % и 10 %растворы; 5) Соляная кислота, 0,2 %раствор; 6) Сернокислая медь, 1 %раствор. Оборудование: 1) Штатив с пробирками; 2) Лакмусовая бумага; 3) Капельницы; 4) Термометр; 5) Водяная баня или термостат на 38 ºС - 40ºС. Техника В одну пробирку наливают 20 капель желудочного сока или 0,1 % раствор пепсина в 0,2 % соляной кислоте. В другую пробирку помещают 20 капель желудочного сока или 0,1 % раствор пепсина в 0,2 % соляной кислоте, нейтрализованный содой. В третью пробирку наливают 20 капель желудочного сока или 0,1 % раствор пепсина в 0,2 % соляной кислоте, предварительно подщелоченного 0,4% NaOH. В четвертую пробирку закапывают 20 капель желудочного сока или 0,1% раствор пепсина в 0,2 % соляной кислоте, предварительно подвергнутого кипячению. В пятую пробирку отмеривают 20 капель 0,2% раствора HСl. Во все пять пробирок добавляют одинаковые небольшие кусочки фибрина, и пробирки помещают в термостат при температуре от 38 ºС до 40 ºС. После переваривания (растворения) фибрина в первой пробирке (примерно через 30 минут от начала опыта) все пробирки вынимают из термостата и наблюдают измененияфибрина. Переваривание фибрина в первой пробе указывает на то, что пепсин действует в присутствии соляной кислоты. Фибрин во второй и третьей пробе остался неизменным, так как пепсин в нейтральной и щелочной средах не активен. В четвертой пробе, где фермент был инактивирован кипячением, и в пятой пробе, в которой пепсина не было, может произойти набухание фибрина под влиянием соляной кислоты. Содержимое каждой пробирки фильтруют и с фильтром производят биуретовую реакцию. Продолжительная реакция обнаруживается только в первой пробе, где был активный пепсин, соляная кислота, фибрин, что указывает на присутствие в фильтре продуктов переваривания белка. Рекомендации к составлению протокола Результаты наблюдений занести в таблицу 1. Таблица 1 - Действие пепсина на фибрин в различных условиях
В соответствии с полученными данными указать оптимальные условия для переваривания белка пепсином и роль соляной кислоты в этом процессе. 1.3 Лабораторная работа № 3. Состав желудочного сокаЖелудочный сок представляет собой бесцветную жидкость с сильнокислой реакцией (рН 1,5 - 2,0). За сутки у человека выделяется около 1,5 л желудочного сока; в его состав входят вода, неферментативные белки, ферменты (пепсин, гастриксин), муцин, фактор Касла, соляная кислота, гидрофосфаты и некоторые другие соединения. Кислая реакция желудочного сока обусловлена присутствием соляной кислоты, гидрофосфатов, а при патологических процессах молочной кислоты и жирных кислот. Совокупность всех веществ желудочного сока, способных быть донорами протонов, составляют общую кислотность. Соляную кислоту, связанную с белками и продуктами их переваривания, называют связанной соляной кислотой, а находящуюся в несвязанном виде — свободной соляной кислотой. Содержание последней подвержено значительным колебаниям, тогда как количество связанной соляной кислоты достаточно постоянно. В характере секреции желудочного сока различают следующие патологические изменения: гиперхлоргидрию — увеличение содержания свободной соляной кислоты и общей кислотности. Такое состояние преимущественно наблюдается при язвенной болезни желудка; гипохлоргидрию — уменьшение количества свободной соляной кислоты и общей кислотности; ахлоргидрию — полное отсутствие соляной кислоты, общая кислотность при этом значительно снижена; ахилию — отсутствие секреции желудочного сока. Уменьшение или отсутствие соляной кислоты в желудке может наблюдаться при хроническом гастрите, раке желудка, злокачественном малокровии. В клинике используют рН-метрию желудочного сока, однако подобную информацию можно получить простым способом, предложенным ниже. Суть метода заключается в последовательном оттитровывании одного из трех образцов желудочного сока раствором NaOH в присутствии двух индикаторов и формировании вывода о кислотности желудочного сока на основании расчетов. Пользуясь различными индикаторами (диметиламиноазобензол и фенолфталеин), в одной и той же пробе желудочного сока определяют как общую кислотность, так и содержание обшей, свободной и связанной соляной кислоты. Общую кислотность желудочного сока выражают количеством миллилитров 0,1 М раствора NaOH, пошедших на титрование 100 мл желудочного сока в присутствии индикатора фенолфталеина (интервал перехода окраски рН 8,2 – 10,0). В норме общая кислотность составляет 40 - 60 титрационных единиц(ед.). Свободную соляную кислоту выражают количеством миллилитров 0,1 М раствора NaOH, пошедших на титрование 100 мл желудочного сока в присутствии индикатора диметиламиноазобензола (интервал перехода окраски рН 1,0 - 3,0). В норме содержание свободной соляной кислоты составляет 20 - 40ед. Общая соляная кислота — это сумма свободной и связанной с белками соляной кислоты (последнюю находят по разности между общей и свободной соляной кислотой). Реактивы и материалы: 1) Желудочный сок; 2) Диметиламиноазобензол; 3) Фенолфталеин; 4) Едкий натр, 10 %раствор. Оборудование: 1) Колбы для титрования; 2) Бюретки, 10мл; 3) Капельницы. Техника В колбу для титрования вносят из бюретки 5 мл исследуемого желудочного сока. Добавляют 1 каплю раствора диметиламиноазобензола и 2 капли раствора фенолфталеина. Появляется розово-малиновое окрашивание. Пробу титруют 0,1 М раствором NaOH до оранжевого окрашивания и отмечают количество миллилитров щелочи, пошедших на титрование свободной соляной кислоты (I пункт титрования). Далее титрование продолжают до появления лимонно-желтой окраски и отмечают общее количество миллилитров NaOH, пошедших на титрование от начала общего титрования (II пункт титрования). Затем титрование продолжают до появления малинового окрашивания и отмечают количество миллилитров щелочи, вновь пошедших на титрование от начала общего титрования (III пункт титрования). Расчеты Допустим, что на титрование 5 мл желудочного сока до пункта 1 пошло от 0 до 1,5 мл 0,1 М раствора NaOH, до пункта II- от 0 до 2 мл и до пункта III - от 0 до 3 мл. Тогда общая кислотность составит 3 • 100/5 = 60 ед., количество свободной соляной кислоты - 1,5 • 100/5 = 30 ед.; количество общей соляной кислоты (среднее арифметическое между пунктами титрования II и III) - (2+3)/2-100/5 = 50 ед., а количество связанной соляной кислоты находят по разнице между содержанием общей и свободной соляной кислоты: 50 - 30 = 20ед. Рекомендации к составлению протокола Результаты титрования и расчетов занести в таблицу 2. На основании расчетов сделать вывод о кислотности желудочного сока: нормальная, повышенная или пониженная. Сравнить с другими образцами и отметить характер изменения общей кислотности, а также общей, свободной и связанной соляной кислоты. Таблица 2- Данные титрования и расчета
1.4 Лабораторная работа №4 Особенности расщепления жиров в тонком кишечникеЭмульгирование жиров необходимо для ускорения переваривания жиров пищи в полости кишечника ферментом липазой, так как оно вызывает увеличение соприкосновения жира с водным раствором липазы. Эмульгаторами являются: поверхностно-активные вещества –белки, соли желчных кислот, мыла. Наибольшей эмульгирующей активностью обладают щелочно- реагирующие соли желчных кислот, которые вместе с желчью изливаются в двенадцатиперстную кишку через желчный проток. Они адсорбируются на поверхности жировых капель, образуя тончайший слой, причем гидрофильные группы желчных кислот обращены в сторону водной фазы, а гидрофобные радикалы направлены к жиру. При этом происходит уменьшение поверхностного уменьшения на разделе двух фаз (вода/жир), что приводит к распаду капелек жира на более мелкие. Реактивы и материалы: 1) Растительное масло или рыбий жир; 2) Желчь, разведенная в два раза; 3) Раствор белка; 4) Натриевое мыло, 1 %раствор; 5) Натрий углекислый , 1 %раствор. Оборудование: 1) Штатив с пробирками; 2) Капельницы. Техника: 1) Берут 5пробирок: а) Впервуюналивают15капельдистиллированнойводы; б) во вторую – 15 капель разведенной желчи; в) в третью – 15 капель раствора белка; г) в четвертую – 15 капель 1 % раствора мыла; д) в пятую – 15 капель 1 % раствора соды. 2) В каждую пробирку добавляют по 3 - 4 капли растительного масла, одновременно взбалтывают содержимое всех пробирок и ставят их по порядку в штатив; 3) Наблюдают в первой пробирке расслоение неустойчивой эмульсии на жир и воду, а во второй, третьей, четвертой, пятой–образование эмульсии. Эмульгирование жира содой обусловлено образованием мыла в результате взаимодействия углекислого натрия с присутствующими в жире свободными жирными кислотами. Рекомендации к составлению протокола Результаты опыта занести в таблицу 3, отметив стойкость образовавшейся эмульсии и степень ее дисперсности. Таблица 3– Эмульгирование жира
В выводах указать, в присутствии каких эмульгаторов получалась наиболее стойкая эмульсия. Отметить сравнительную значимость разных физиологических эмульгаторов жиров в процессе переваривания их в кишечнике. 1.5 Лабораторная работа № 5. Влияние поджелудочной железы на переваривание нутриентовРасщепление жиров в кишечнике на глицерин и высшие жирные кислоты совершается, главным образом, при участии липазы, секретируемой поджелудочной железой, и, в меньшей степени, липазы, выделяемой железами слизистой оболочки кишечника. Липаза отщепляет сначала остатки жирных кислот от триглицеридов, преимущественно в α-положениях. Образующийся β- моноглицерид изомеризуется в α-моноглицерид, после чего также может быть расщеплен липазой на глицерин и жирную кислоту. В итоге, триглицерид распадается на глицерин и три молекулы жирных кислот 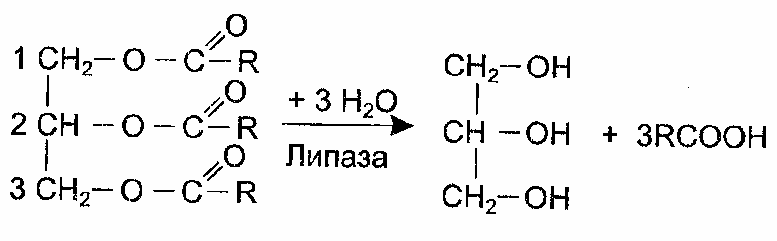 Для действия липазы на жир необходимо присутствие желчных кислот, образующихся в печени. Они вызывают эмульгирование жиров, приводящее к увеличению поверхности соприкосновения жира с липазой. Для действия липазы на жир необходимо присутствие желчных кислот, образующихся в печени. Они вызывают эмульгирование жиров, приводящее к увеличению поверхности соприкосновения жира с липазой.Опыт основан на расщеплении жира молока под воздействием липазы на глицерин и жирные кислоты. Последние сдвигают реакцию среды в кислотную сторону и обнаруживаются титрованием щелочью. Опыт предусматривает три варианта воздействия на молочный жир: 1) липазой без желчи; 2) липазой вместе с желчными кислотами; 3) желчью без липазы. Реактивы и материалы: 1) Молоко прокипяченное; 2) фенолфталеин, 1 % раствор в этиловом спирте. 3) едкий натр, 10 %раствор; 4) едкий натр, 0,1н. раствор; 5) панкреатин – препарат поджелудочной железы, содержащий липазу (навески по 100мг); 6) желчь. Оборудование: 1) мерный цилиндр; 2) конические колбочки; 3) бюретки; 4) пипетки на 5мл. Техника В колбочку наливают 20 мл молока и нейтрализуют его кислотность, обусловленную присутствием кислых солей. Для этого в колбу приливают 2 капли 1 % раствора фенолфталеина и 4 капли 10 % раствора едкого натра (избегать избытка), после чего при тщательном перемешивании содержимого колбы осторожно добавляют 0,1 н. раствор едкого натра до слаборозовой окраски. Из нейтрализованного молока готовят в конических колбочках опытные пробы по схеме, указанной в таблице 4. Пробы тщательно перемешивают и оставляют при комнатной температуре. Через 15 минут от начала инкубации пробы титруют из бюретки 0,1 Н раствором NaOH до слабо-розовой окраски, после чего вновь оставляют при комнатной температуре. Количество израсходованной щелочи фиксируют в таблице4. Титрование проб повторяют через 30, 45 и 60 минут от начала инкубации. Каждый раз оттитровывается то количество жирных кислот, которое освобождается из жира молока при его гидролизе липазой за данный отрезок времени (15 минут) (таблица 4). Таблица 4 - Гидролиз жира молока липазой
Рекомендации к составлениюпротокола Изобразить графически динамику расщепления жира липазой для каждой пробы, откладывая на оси абсцисс время в минутах, а на оси ординат – количество 0,1 н. раствора NaOH (в мл), израсходованного на нейтрализацию жирных кислот, образовавшихся за данное время (15, 30, 45, 60 минут). Выразить активность липазы как концентрацию карбоксильных групп жирных кислот, образовавшихся в 100 мл молока за все время исследования, пользуясь следующей формулой: 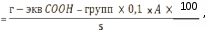 мг %;гдеx– концентрацияCOOH– групп, образующихся в 100 мл молока, 0,1 – нормальность раствора NaOH; A– количество 0,1 Н раствора NaOH, израсходованного на титрование 5 мл молока за все время инкубации (сумма всех титрований), мл; 5 – количество молока в титруемой пробе, мл. На основании хода кривых на графике и полученных данных концентрации карбоксильных групп сделать вывод о зависимости активности липазы от присутствия желчных кислот. Отметить зависимость количества образовавшихся свободных жирных кислот от продолжительности ферментативного действия. 1.6 Лабораторная работа № 6. Особенности расщепления простых и сложных углеводовКрахмал и сахароза – обычные углеводы пищи. Амилаза и сахараза – ферменты, участвующие в расщеплении этих углеводов. Амилаза слюны расщепляет крахмал до мальтозы, а затем мальтоза расщепляет последнюю до свободной глюкозы. Сахараза кишечного сока расщепляет сахарозу до глюкозы и фруктозы. Источником ферментов могут быть слюна (для амилазы) и пекарские дрожжи (для сахарозы). Принцип метода основан на специфичности действия амилазы слюны и сахаразы дрожжей на соответствующие субстраты. О расщеплении крахмала и сахарозы судят по образованию глюкозы, которую определяют пробой Троммера (модификация пробы «медного зеркала» на альдегидную группу). Крахмал и сахароза не содержат способной окисляться альдегидной группы и не дают положительной пробы Троммера при нагревании. Реактивы и материалы: 1) едкий натр, 30 %раствор; 2) сернокислая медь, 7 %раствор; 3) крахмал; 4) сахароза; 5) слюна; 6) пекарские дрожжи. Оборудование: 1) штатив с пробирками; 2) водяная баня или термостат на 40 ºС; 3) горелка. Техника Слюну разводят в соотношении 1:5 и полученный раствор используют как источника амилазы. Получение сахаразы осуществляют следующими образом: 10 г пекарских дрожжей тщательно растирают в ступке, добавляют 15 мл воды, а полученный фильтрат используют как источник фермента. В четыре пробирке по каплям добавляют следующие реактивы: крахмал, сахароза, амилаза, сахараза. Пробы перемешивают и инкубируют при 40 ºС в течение 10 мин, а затем проводят пробу Троммера содержимым каждой пробирки: а) к содержимому исследуемого раствора добавляют равный объем 30 % раствора NaOH и 1 каплю 7 % раствора CuSO4 (так, чтобы не растекались по стенкам пробирки) до появления в верхнем слое неисчезающей голубой мути - вследствие образования гидроксида меди (II) Cu(OH)2; б) осторожно, не встряхивая пробирку, нагревают ее на горелке. При кипячении выпадает желтый осадок гидроксида меди (I) CuOH или красный осадок Cu2O. В случае избытка CuSO4 образуется черный осадок CuO. Рекомендации к составлению протокола Результаты анализа проб в реакциях на наличие глюкозы записывают в таблицу 5. Таблица 5–Результаты проб Троммера
1.7 Лабораторная работа №7. Белковый обмен, конечные продукты обменаОсновными конечными азотсодержащими продуктами белкового обмена являются аммиак и мочевина. Аммиак образуется преимущественно при дезаминировании аминокислот под влиянием дегидрогеназ аминокислот, главным образом глютаматдегидрогеназы. Процесс сводится к потере аминокислотой аминогруппы в виде аммиака, при этом аминокислота превращается в кетокислоту. Устранение аммиака, относящегося к сильным токсическим веществам, осуществляется: за счет синтеза аммонийных солей; за счет синтеза мидаглютаминовой кислоты (глютамина); путем связывания угольной кислотой с образованием мочевины. В виде аммонийных солей в норме с мочой за сутки выделяется 0,5 - 1,2 г аммиака. Аммонийные соли образуются при нейтрализации аммиаком кислот, поступающих в организм извне или получающихся в организме в процессах обмена веществ: 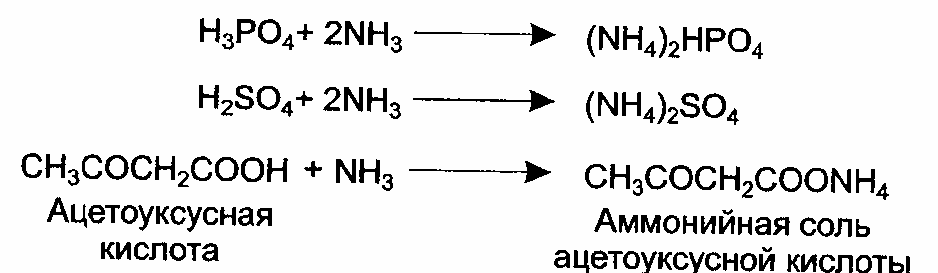 Экскреция аммиака с мочой зависит, прежде всего, от кислотно- щелочного равновесия. Выведение аммиака с мочой значительно увеличивается при заболеваниях, сопровождающихся ацидозом, поэтому по количеству выделенного аммиака в виде аммонийных солей можно судить о размерах образования кислот в организме. Ацидоз имеет место, например, при сахарном диабете, когда образуются ацетоновые тела (ацетоуксусная кислота, β-гидроксимасляная кислота) и увеличивается количество фосфорной и серной кислот в связи с усилением расщепления тканевых белков в организме больного диабетом. Уменьшение количества аммиака в моче характерно для поражения почек за счет потери пораженной почечной тканью способности получать аммиак из глютамина. Принцип способа состоит в том, что при действии формальдегида на аммонийные соли мочи образуется уротропин (гексаметилентетрамин) и выделяется эквивалентное аммиаку количество кислоты: 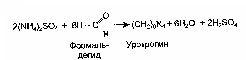 Кислоту оттитровывают раствором щелочи, а отсюда вычислением узнают содержание аммиака в моче, учитывая, что 1 мл 0,1 н. раствора едкого натра эквивалентен 0,0017 г аммиака (титр 0,1 н. раствора аммиака). Реактивы и материалы: 1) моча, собранная за сутки; 2) фенолфталеин, 1 % спиртовый раствор; 3) едкий натр, 0,1н.раствор; 4) формалин, предварительно нейтрализованный раствором едкого натра в присутствии фенолфталеина. Оборудование: 1) конические колбочки; 2) пипетки емкостью 5 мл с делениями; 3) бюретки; 4) капельницы. Техника. 5 мл мочи отмеривают в колбу, добавляют 25 мл дистиллированной воды, 2 капли 1 % спиртового раствора фенолфталеина и титруют при помешивании 0,1 н. раствором едкого натра до появления слаборозовой окраски. Этим достигается нейтрализации кислореагирующих на фенолфталеин веществ мочи. К содержимому колбы прибавляют 1,5 - 2,5 мл формалина, предварительно нейтрализованного раствором щелочи. Смесьобесцвечиваетсявследствиеразложенияаммиачныхсолейипоявленияврастворекислоты. После добавления формалина смесь вновь титруют 0,1 н. раствором NaOH до возникновения розового окрашивания жидкости. Количество израсходованных при последнем титровании миллилитров щелочи умножают на 0,0017 и узнают количество аммиака во взятом для анализа объеме мочи, а отсюда и его содержание в суточной моче. Расчеты К примеру, суточное количество мочи - 1240 мл, взято для анализа - 5 мл; после добавления формалина израсходовано при титровании 0,1 н. раствора щелочи - 1,33 мл; количество аммиака во взятом для анализа объеме мочи = 1,33 х 0,0017 = 0,00226 г. Содержание аммиака в суточной моче = (0,00226 х 1240) / 5 = 0,56г. Рекомендации к составлению протокола Полученные данные содержания аммиака в анализируемой суточной моче сопоставить с количеством аммиака, выделяемым с мочой за сутки в норме. Сделать вывод о наличии или отсутствии ацидоза у исследуемого субъекта. 1.8 Лабораторная работа №8. Защита лабораторных работ Студенты защищают выполненные лабораторные работы и представляют отчет о их выполнении. Раздел 2 Самостоятельная работа для практических занятий 2.1 Вопросы для самостоятельного изучения дисциплины Вопросы к разделу 1. Биохимия пищеварения и питания. Общий раздел. 1.1 Система пищеварения: строение и функции органов желудочно-кишечного тракта. 1.2 Типы пищеварения. 1.3 Регуляция и этапы всасывания основных групп нутриентов (белков, жиров, углеводов, воды, витаминов и химических элементов). 1.4 Пищеварение в различных отделах пищеварительного тракта: ротовая полость, желудок, тонкий и толстый кишечник. 1.5 Моторика и секреция в пищеварительном тракте. 1.6 Передвижение химуса. 1.7 Образование и состав желчи. 1.8 Принципы методов изучения и оценки пищеварительной функции желудочно-кишечного тракта. 1.9 Основы голода и насыщения. 1.10 Биохимия питания. 1.11 Роль белков, жиров, углеводов, витаминов, минеральных веществ. 1.12 Энергетическая ценность продуктов питания, виды энергозатрат. 1.13 Роль обмена веществ в обеспечении пластических и энергетических потребностей организма. Вопросы к разделу 2. Биохимия пищеварения и питания. Частный раздел 2.1 Основные принципы рационального питания. 2.2 Режим питания. 2.3 Теории питания. 2.4 Защитные компоненты пищевых продуктов. 2.5 Компоненты пищи, неблагоприятно влияющие на организм. 2.6 Дифференцированное питание различных групп населения. 2.7 Система пищеварения и питание беременных женщин. Факторы риска. 2.8 Функции системы пищеварения и питание в антенатальном периоде. 2.9 Система пищеварения и питание ребенка на первом году жизни. Факторы риска. 2.11 Основные принципы диетического питания. Питание при различных заболеваниях. 2.12 Характеристика диет. 2.13 Лечебно-профилактическое питание рабочих, занятых на производствах с вредными условиями труда. 2.14 Характеристика рационов лечебно-профилактического питания. Список использованных источников1.Агаджанян, Н. А. Физиология человека / Н. А. Агаджанян. - М.: Медицинская книга; Н.Новгород: Издательство НГМА, 2001.- 526 с.: ил. 2. Баранова, О.В. Основы физиологии питания (краткий курс): учеб.пособие для вузов. В 2-х ч. Ч.1. Теоретические основы / О.В. Баранова, Е.С. Барышева - Оренбург: ИПК ГОУОГУ, 2007. - 158 с. 3. Барышева, Е. С. Биохимические основы физиологии питания: учебное пособие для студентов / Е. С. Барышева. - Оренбург: ОГУ, 2017. 4. Барышева, Е.С.Основы физиологии питания (краткий курс): учеб.пособие для вузов. В 2-х ч. Ч.2.Практичексие основы / Е.С. Барышева, О.В. Баранова - Оренбург: ИПК ГОУ ОГУ, 2007. - 266 с. 5. Барышева, Е.С. Практические основы биохимии: учебное пособие / Е. С. Барышева, О.В. Баранова, Т.В. Гамбург - Оренбург: РИС ОГУ, 2011. -154 с. 6. Барышева, Е.С. Теоретические основы биохимии: учебное пособие / Е. С. Барышева, О.В.Баранова, Т.В. Гамбург- Оренбург: РИС ОГУ, 2011. -360 с. 7. Бурак И. И. Гигиена: учеб.пособие / И.И.Бурак. – М.: Высш. шк., 2004.-256 с. 8. Бурцева, Т.И. Дневник питания: рабочая тетрадь/Т.И. Бурцева, О.В. Баранова.- Оренбург: ГОУ ОГУ, 2007.- 11 с. 9. Владимирова, Е. Г. Биохимия: метод.указания к лаб. практикуму / Е. Г. Владимирова, О. П. Кушнарева - Оренбург : ИПК ГОУ ОГУ, 2010. - 60 с. 10. Глебов, М. Н. Все о диетах / М. Н. Глебов. - СПб.: ИК «Невский проспект», 2004.- 304 с. - (Серия «Энциклопедия»). 11.Голубев, В. Н. Справочник работника общественного питания / В. Н. Голубев, М. П. Могильный, Т. В. Шленская; Под ред. В.Н.Голубева. - М. :ДеЛипринт, 2003. - 589 с. 12. Доронин, А. Ф. Функциональное питание / А. Ф. Доронин, Б. А. Шендоров. - М.: ГРАНЬ, 2002. - 296 с. 13. Доценко, В. А. Диетическое питание: справочник / В. А. Доценко, Е. В. Литвинова, Ю. Н. Зубцов. – СПб.: Издательский дом «Нева»; М.: «Олма-Пресс», 2002.- 352 с. 14.Дроздова, Т.М. Физиология питания: учебник / Т.М. Дроздова, П.Е. Влощинский, В.М. Позняковский. - М.: ДеЛи плюс, 2012. - 352 c. 15. Ковалев, Н. И. Технология приготовления пищи / Н. И. Ковалев, М. Н. Куткина, В. А. Кравцова; Отрасл. центр повышен.квалиф. работников торговли; Под ред. М.А. Николаевой. - М. : ИД "Деловая литература" : Омега-Л, 2003. - 467 с. 16. Лебедь, В. А. Лечебные диеты: учеб.пособие / В. А. Лебедь, Д. А. Крюкова. - Ростов н/Д:Феникс, 2004.- 320 с. 17. Малышева, Н. В. Биохимия пищеварения и питания: метод.указания к лаб. практикуму / Н. В. Малышева, О. А. Науменко, М. В. Фомина - Оренбург : ГОУ ОГУ, 2011 18.Мартинчик, А.Н. Микробиология, физиология питания, санитария: Учебник для студентов сред.проф. учебных заведений / А.Н. Мартинчик, А.А. Королев, Ю.В. Несвижский. - М.: ИЦ Академия, 2012. - 352 c. 19.Мартинчик, А.Н. Микробиология, физиология питания, санитария: Учебник для студентов сред.проф. учебных заведений / А.Н. Мартинчик, А.А. Королев, Ю.В. Несвижский. - М.: ИЦ Академия, 2013. - 352 c. 20. Матюхина, З.П. Основы физиологии питания, гигиены и санитарии: учеб.для начального профессионально образования: учеб. пособие для среднего профессионального образования / З.П. Матюхина. – 2-е изд., стер. - М.: Издательский центр «Академия», 2004. - 184 с. 21.Панченко, Л. Ф. Клиническая биохимия микроэлементов / Л. Ф. Панченко, И. В. Маев, К.. Г. Гуревич. - М.: ГОУ ВУНМЦ МЗ РФ, 2004. - 368 с. 22. Покровский, В. И. Политика здорового питания / В. И. Покровский; Федеральный и региональные уровни. - Новосибирск: Сибирский университет, 2002. - 340 с. 23. Рогожин, В. В. Практикум по биологической химии : учеб.-метод. пособие / В. В. Рогожин . - СПб. : Лань, 2006. - 256 с. : ил. 24. Родина, Т. Г. Сенсорный анализ продовольственных товаров : учеб.для студ. вузов / Т. Г. Родина. - М.: Академия, 2004. - 202 с. 25. Рубина, Е.А. Микробиология, физиология питания, санитария: учебное пособие / Е.А. Рубина, В.Ф. Малыгина. - М.: Форум, НИЦ ИНФРА-М, 2013. – 240c. 26. Теплов, В.И. Физиология питания: учебное пособие / В.И. Теплов, В.Е. Боряев. - М.: Дашков и К, 2013. - 452 c. 27. Ткаченко, Б. И. Физиологические основы здоровья человека: учебник для студентов высших учебных заведений / Б. И. Ткаченко. – Санкт - Петербург, Архангельск: Издательский центр Северного государственного медицинского университета, 2001. - 728 с. 28. Федюкевич, Н.И. Анатомия и физиология человека: учебное пособие / - Н.И. Федюкевич. - Ростов-н/Д.: Изд-во «Феникс», 2000.-416 с. 29. Физиологические основы здоровья человека / под ред. Б. И. Ткаченко. - Санкт-Петербург; Архангельск: Издательский центр Северного государственного медицинского университета, 2001. – 728 с. 30. Фурс, И. Н. Технология производства продукции общественного питания : учеб.пособие для студ. спец. "Коммерческая деят. вузов" / И. Н. Фурс. - Минск: Новое знание, 2002. - 798 с. 31. Харченко, Н. Э. Технология приготовления пищи : учеб.пособие для образоват. учреждений нач. профес. образования / Н. Э. Харченко, Л. Г. Чеснокова. - М. : Академия, 2004. - 281 32. Шатун, Л. Г. Технология приготовления пищи: учебник / Л. Г. Шатун. - М. : Дашков и Ко, 2004. - 479 с. 33. Davis, A. Нутрицевтика. Питание для жизни, здоровья и долголетия / A. Davis. - М.: Саттва, 2004. - 544 с. 34. Krause, S. Food, nutrition and therapy / S. Krause; еd by K. Mahan, S. Escott -Stamp.Philodelphia: [s.n.] 2000. - 1194 p. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
