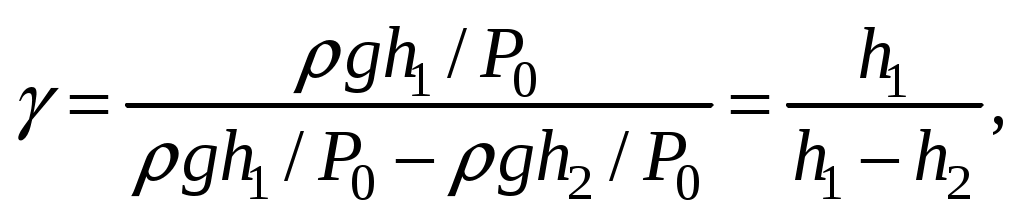|
|
Соотношение теплоёмкостей. 16 Соотношение теплоемкостей воздуха. Методические указания к лабораторной работе 16 по курсу физики для студентов дневной и заочной форм
Федеральное агентство по образованию
Дальневосточный государственный технический университет
(ДВПИ им. В.В. Куйбышева)
Соотношение теплоемкостей воздуха
при постоянном давлении и постоянном объеме
Методические указания
к лабораторной работе №16
по курсу физики для студентов дневной и заочной форм
обучения всех технических специальностей
Владивосток ∙2009
Одобрено научно – методическим советом университета
УДК 53.082.1; 531.76
И88
Соотношение теплоемкостей воздуха при постоянном давлении и постоянном объеме: метод. указания / сост. В.В. Зауткин. – Владивосток: Изд-во ДВГТУ, 2009. – 8с.
В методических указаниях приводятся краткие сведения по термодинамике изопроцессов в идеальных газах, получена теоретическая формула для соотношения теплоемкостей газа при постоянном давлении и постоянном объеме. Дано описание установки для экспериментальной проверки указанных теплоемкостей (методом Клемана – Дезорма), приведены необходимые рекомендации по проведению опытов, обработке их результатов, а так же вопросы для самоконтроля.
Методические указания предназначены для студентов дневной и заочной форм обучения всех технических специальностей университета.
Печатается с оригинал-макета, подготовленного автором

Типография ДВГТУ, 690950, Владивосток, Пушкинская, 10
Лабораторная работа №16
Соотношение теплоёмкостей воздуха
при постоянном давлении и постоянном объёме
Цель работы: определить отношение удельных теплоемкостей воздуха при 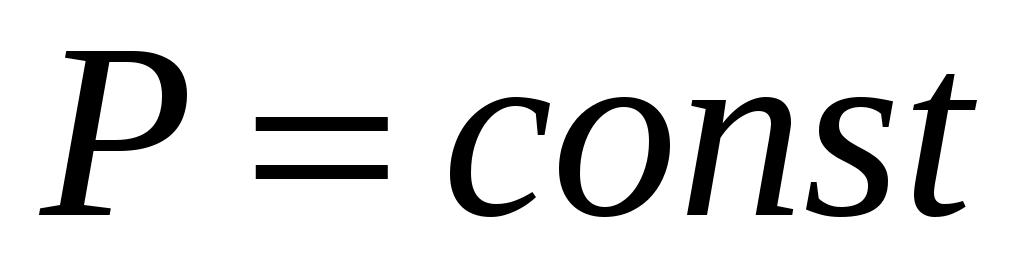 и при и при 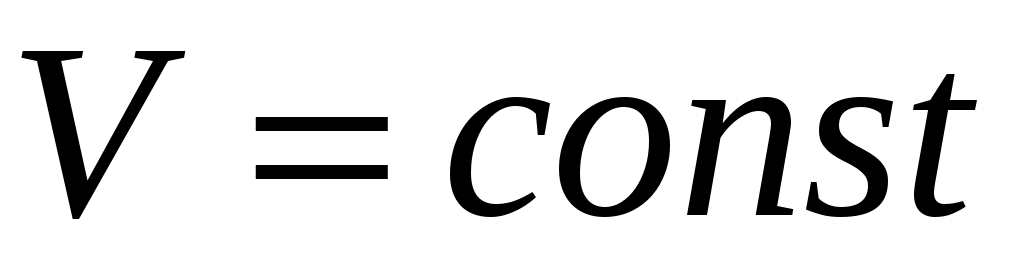 методом Клемана-Дезорма. методом Клемана-Дезорма.
Постановка задачи
Теплоёмкость– одно из важнейших понятий в термодинамике. Теплоёмкостью тела (газообразного, жидкого, твёрдого) называют отношение количества тепла Q, сообщенного телу при нагревании, к изменению его температуры  : :
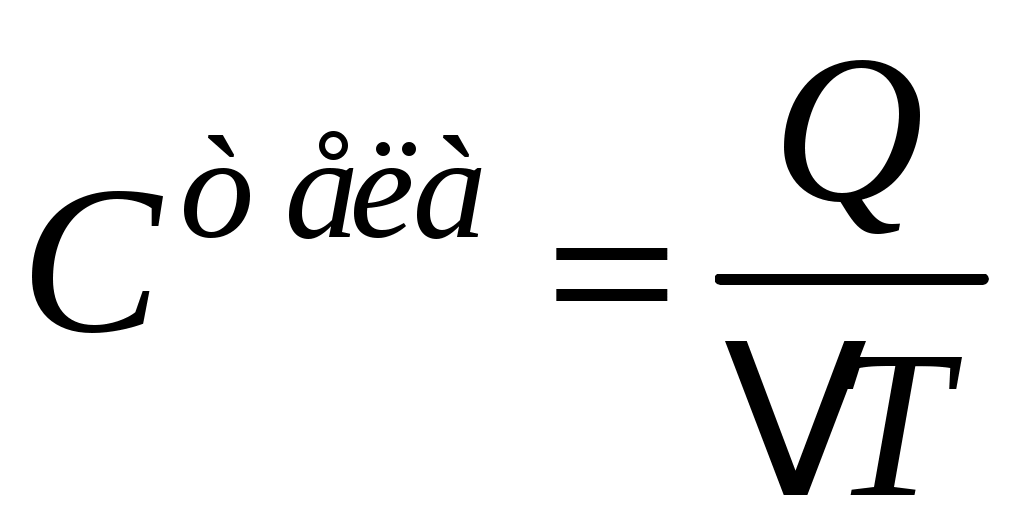 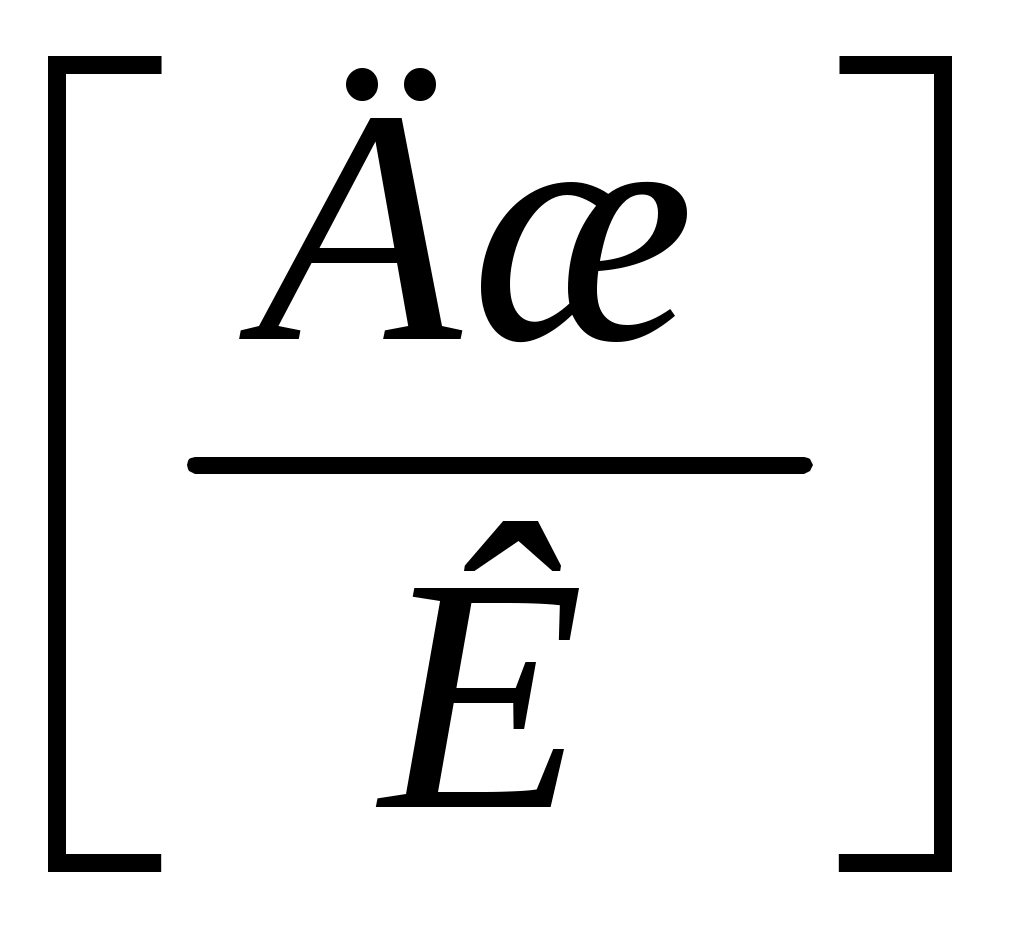 (1) (1)
Физический смысл теплоёмкости можно сформулировать проще: из определения (1) видно, что при 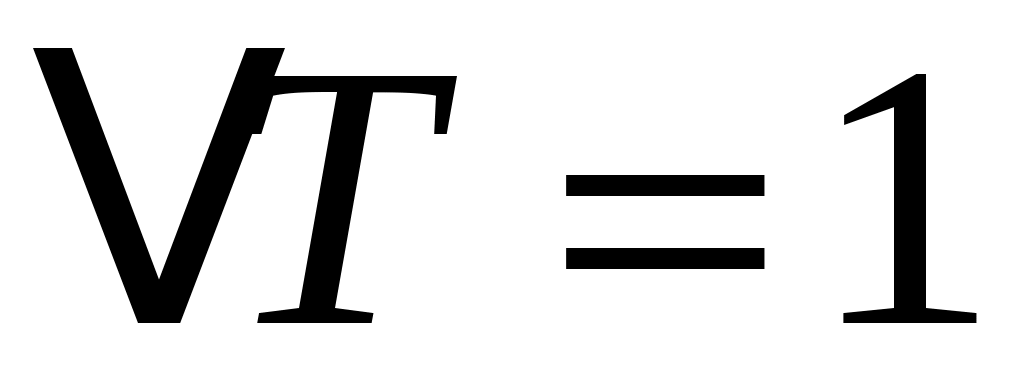 теплоемкость теплоемкость 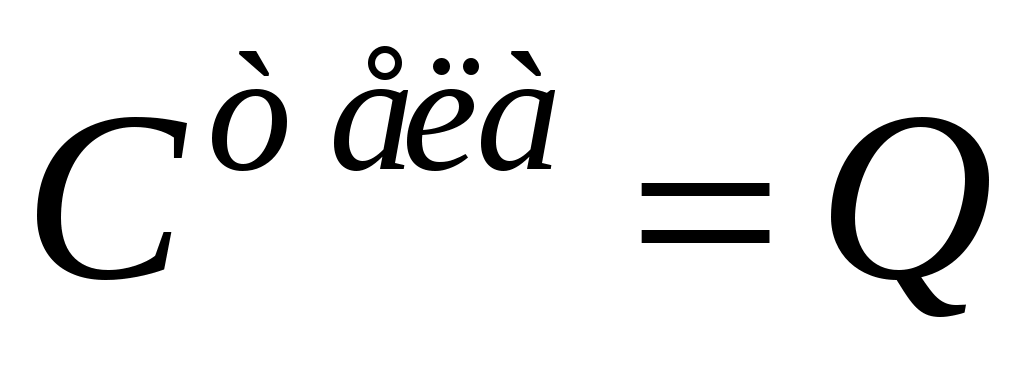 ; значит, теплоёмкость тела численно равна количеству тепла, которое надо сообщить телу, чтобы нагреть его на 1 градус (Кельвин). Если теплоёмкость всего тела разделить на его массу, то получим теплоёмкость единицы массы, которую называют удельной теплоёмкостью ; значит, теплоёмкость тела численно равна количеству тепла, которое надо сообщить телу, чтобы нагреть его на 1 градус (Кельвин). Если теплоёмкость всего тела разделить на его массу, то получим теплоёмкость единицы массы, которую называют удельной теплоёмкостью
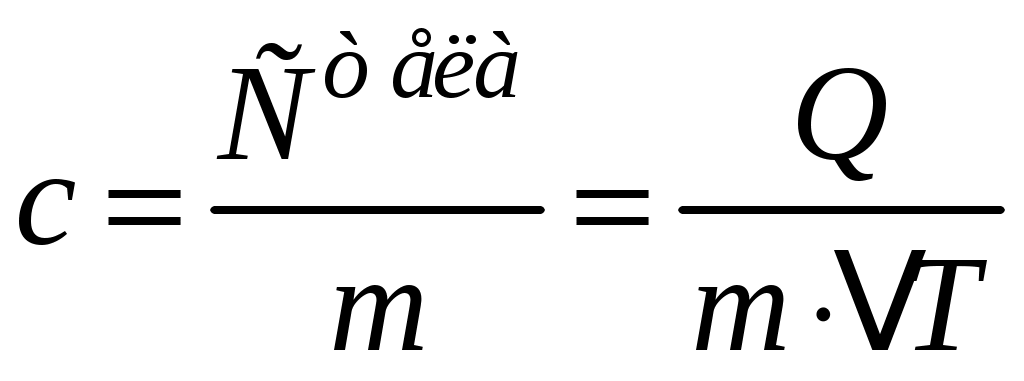 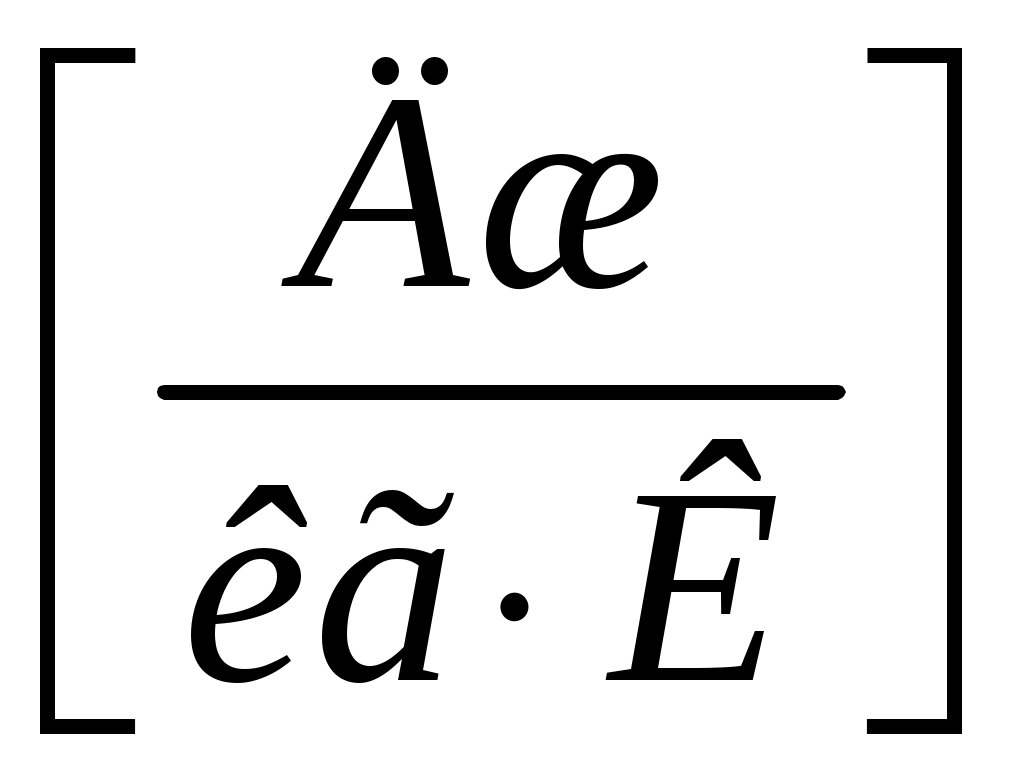 . (2) . (2)
Все тела в общем случае имеют разные значения удельных теплоёмкостей, которые приводят в справочных таблицах физических констант. Зная величину c, легко посчитать количество тепла, необходимое для нагрева данного тела массой mна любое число градусов
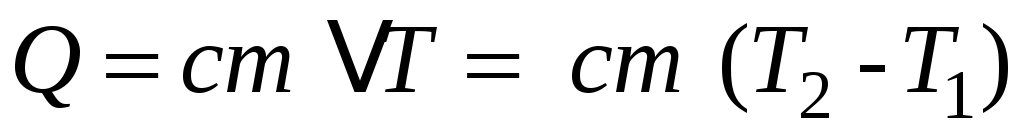 . .
Записанные выше определения являются лишь напоминанием базовых понятий, которые должны быть известны читателю из школьного курса физики.
Теперь сделаем важное уточнение. В формулах (1-2) теплоёмкость считается константой, отражающей физические свойства тела. Однако если речь идёт о газообразных телах, то для одного и того же газа эта константа оказывается различной в зависимости от того, в каком процессе нагревается газ. Это легко понять на основе также известного из школы первого закона (первого начала) термодинамики, который выражает закон сохранения энергии в наиболее общей форме и является одним из самых универсальных законов физики:
Количество тепла Q, подведённое к термодинамической системе, идёт на увеличение её внутренней энергии  U и на совершение этой системой работы A против внешних сил: U и на совершение этой системой работы A против внешних сил:
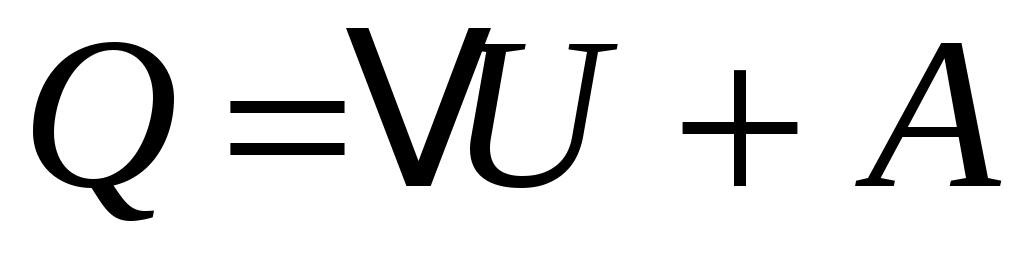 , (3) , (3)
где 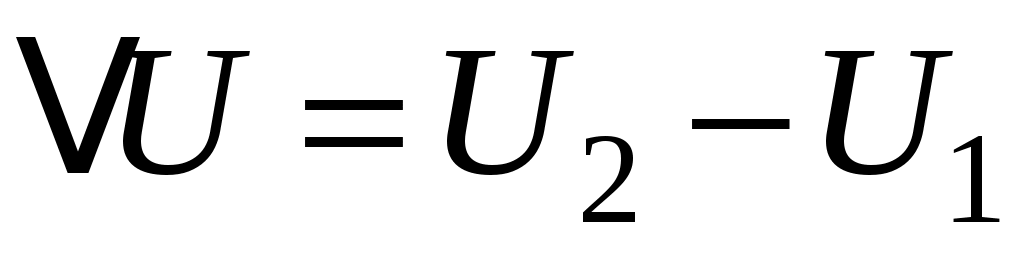 , а U2 и U1 – конечное и начальное значение внутренней энергии, накопленной хаотически движущимися молекулами. Здесь очень важно напомнить читателю, что внутренняя энергия идеального газа всегда строго пропорциональна его температуре (так как по определению температура и является мерой средней энергии движения молекул). , а U2 и U1 – конечное и начальное значение внутренней энергии, накопленной хаотически движущимися молекулами. Здесь очень важно напомнить читателю, что внутренняя энергия идеального газа всегда строго пропорциональна его температуре (так как по определению температура и является мерой средней энергии движения молекул).
Действие закона легко представить на примере газа в цилиндре под поршнем. Если подвести к газу тепло Q, то в общем случае за счет подведения тепловой энергии он нагреется (увеличит свою внутреннею энергию U–энергию молекул) и толкнёт поршень (совершит работу A по перемещения поршня). Заметим, что газ совершает работу только когда он расширяется – когда силой своего давления перемещает внешние тела: поршень, стенки сосуда, другие массы газа и т.п., то есть когда изменяется объём рассматриваемого газа.
Сравним с позиции термодинамики два известных процесса: изохорный и изобарный. При изохорном нагреве 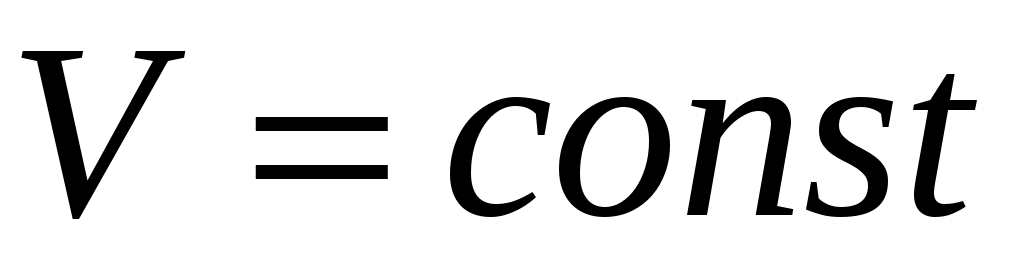 , а значит, работа не совершается , а значит, работа не совершается 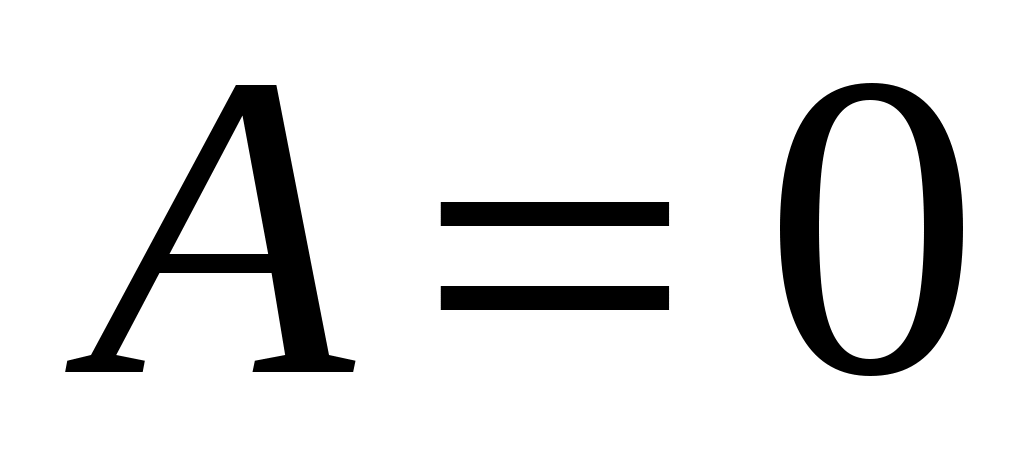 , поэтому в соответствии с (3) все подведённое тепло идёт только на нагрев , поэтому в соответствии с (3) все подведённое тепло идёт только на нагрев 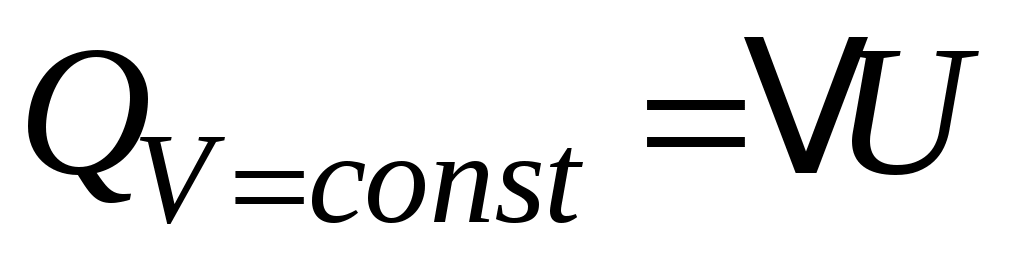 , т.е. на увеличение температуры. , т.е. на увеличение температуры.
При изобарном нагреве давление P неизменно, а объём возрастает пропорционально температуре (закон Гей-Люссака) и газ совершает работу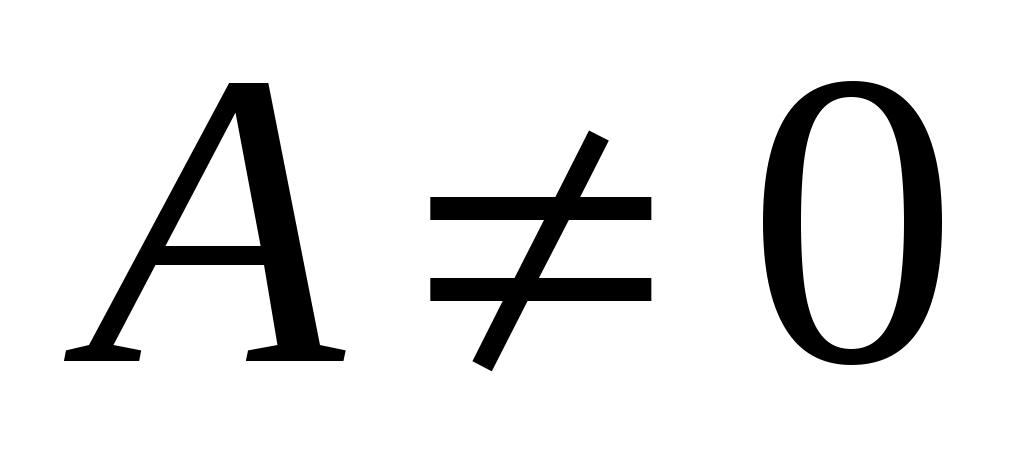 . В этом случае из всего подведённого тепла Q в соответствии с (3) только часть его идёт на нагрев газа (на увеличение внутренней энергии . В этом случае из всего подведённого тепла Q в соответствии с (3) только часть его идёт на нагрев газа (на увеличение внутренней энергии 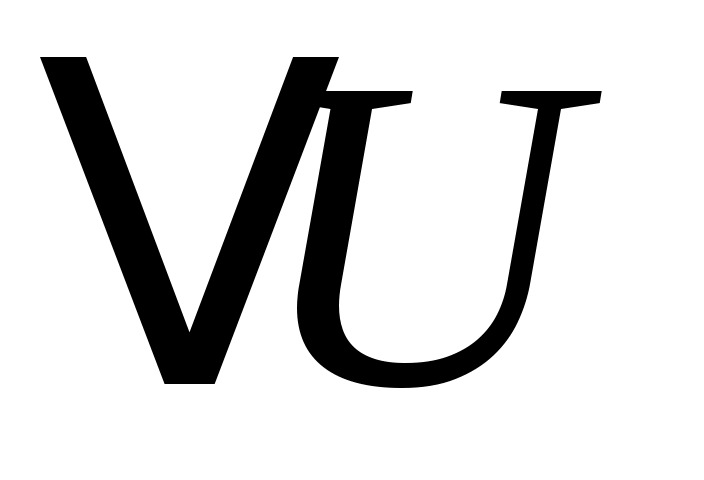 ), при этом ), при этом 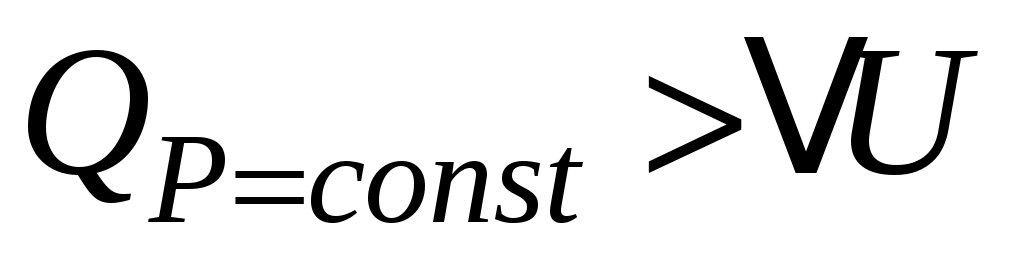 . .
Именно по этой причине для нагрева на 1 градус Кельвина при изобарном нагреве нужно к газу подводить тепла больше, чем при изохорном. Другими словами, удельная теплоёмкость любого газа при постоянном давлении сpбольше его удельной теплоёмкости при постоянном объёме сv, а их отношение:
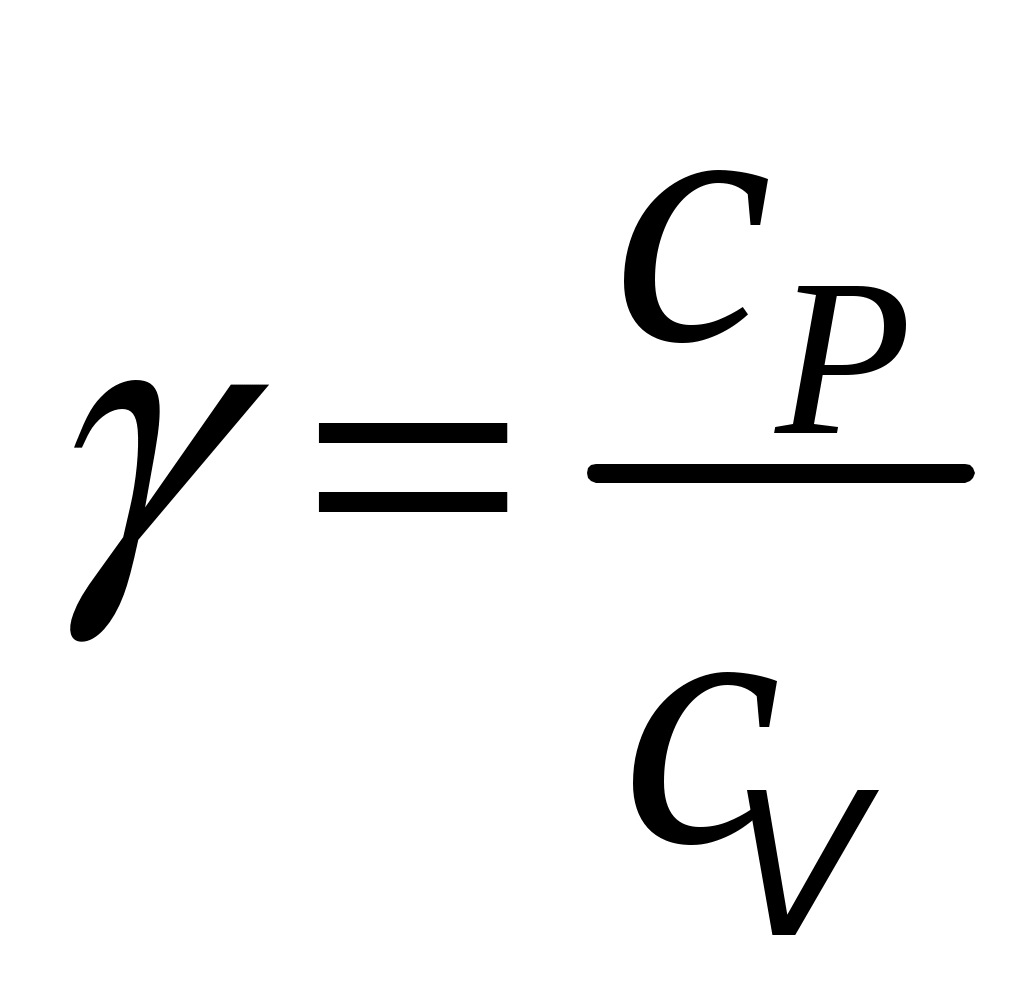 (4) (4)
всегда больше единицы. Это отношение играет в термодинамике весьма важную роль. В частности, как показывается в лекционном курсе физики, оно входит в уравнение Пуассона, которое описывает адиабатное расширение газа:
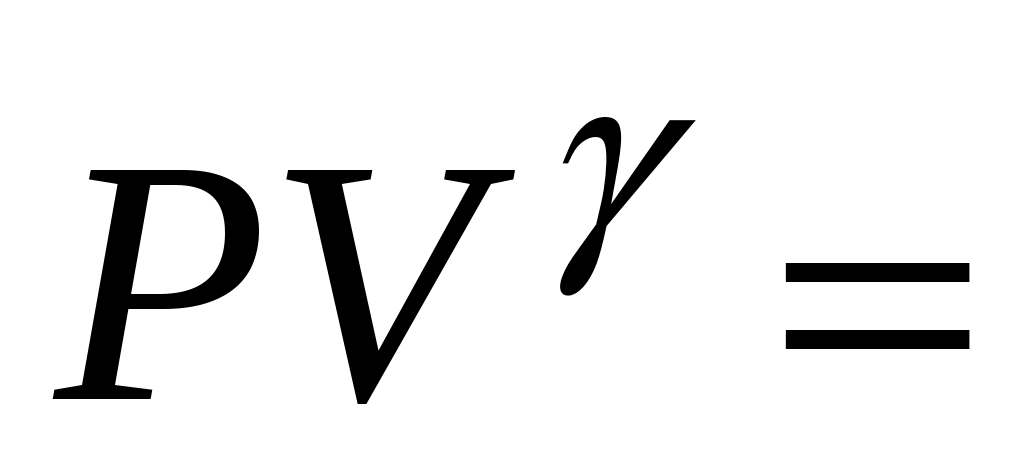 const, или const, или 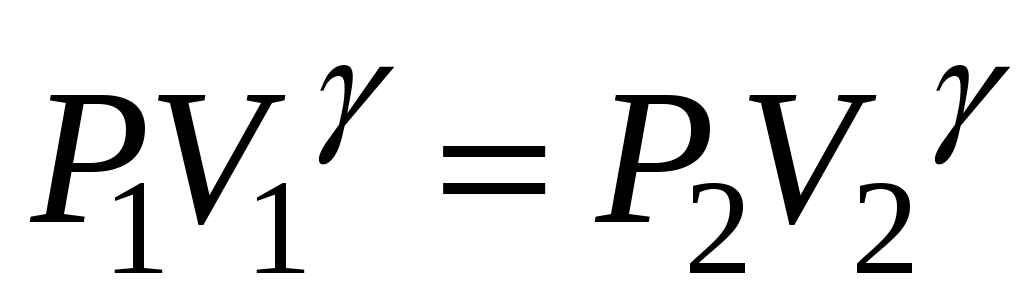 , т.е. , т.е. 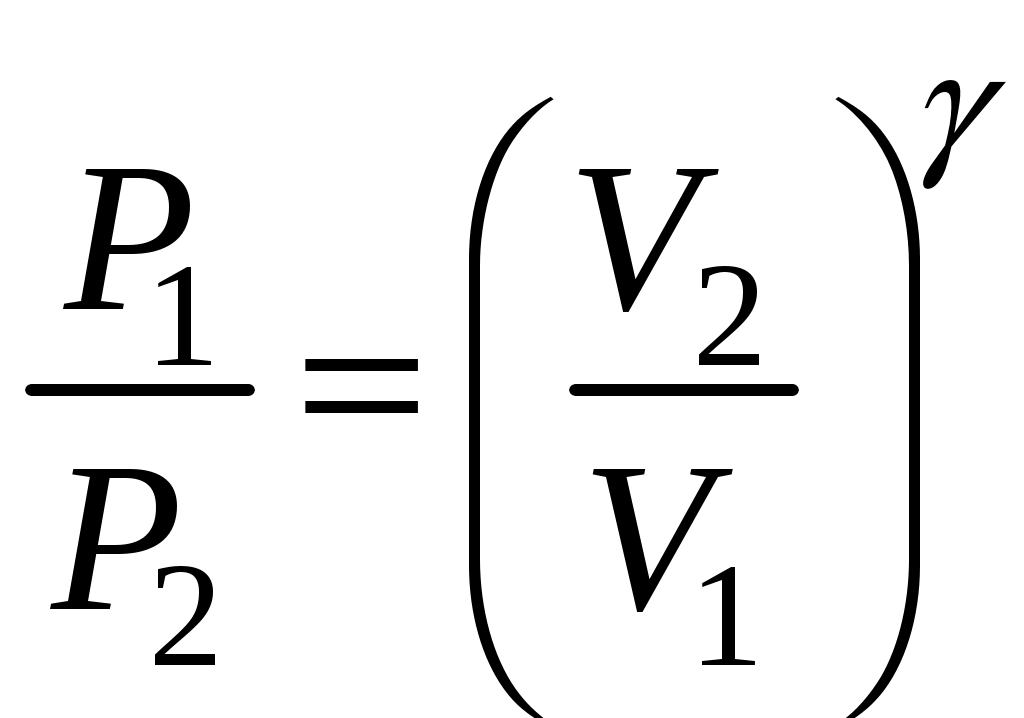 – (5) – (5)
– увеличение объема приводит к резкому уменьшению давления.
Напомним, что адиабатным называется процесс, при котором теплота к газу не подводится и не отводится от него (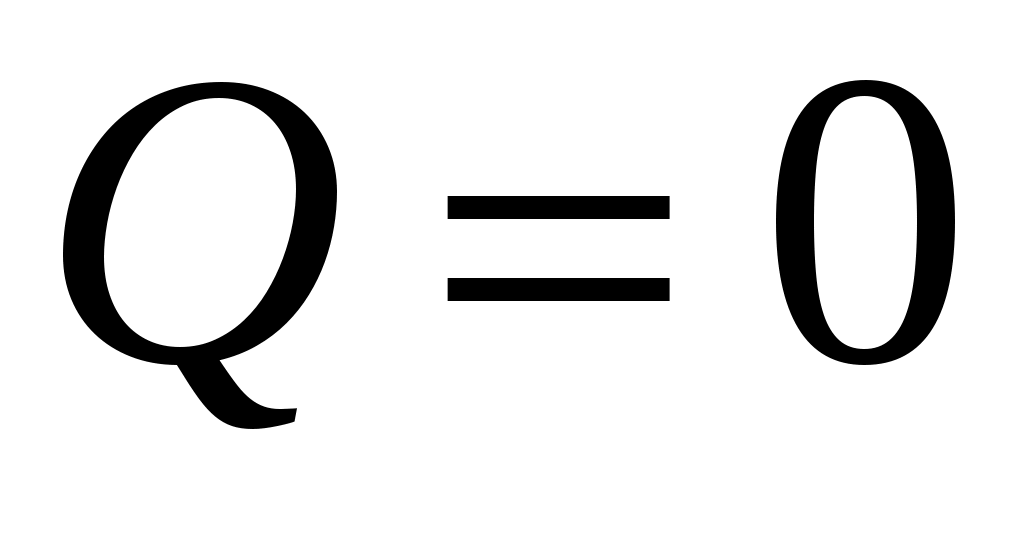 ). На практике часто быстрое расширение и быстрое сжатие газа считают именно адиабатными процессами, так как за малое время теплообмен газа с окружающей средой не успевает произойти ( ). На практике часто быстрое расширение и быстрое сжатие газа считают именно адиабатными процессами, так как за малое время теплообмен газа с окружающей средой не успевает произойти (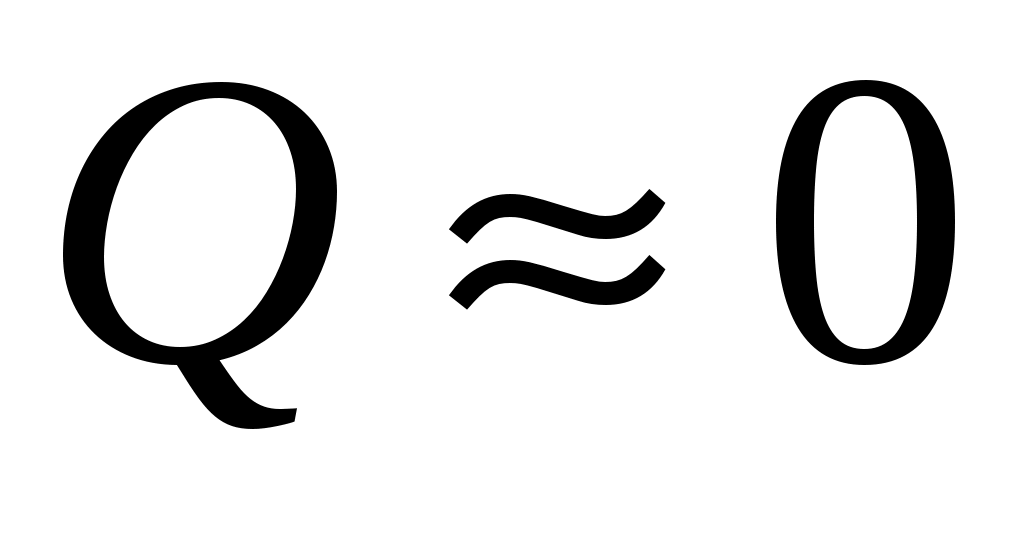 ). ).
Задачей данной работы и является нахождение отношения 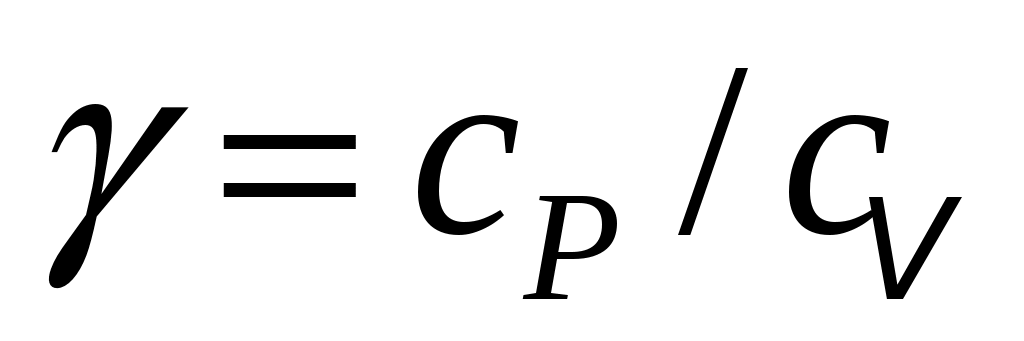 для воздуха методом Клемана и Дезорма, в описании которого мы используем уравнение Пуассона и газовые законы, известные из школьного курса физики: закон Бойля-Мариотта (P1V1= P2V2при Т=const) и закон Шарля (P=const для воздуха методом Клемана и Дезорма, в описании которого мы используем уравнение Пуассона и газовые законы, известные из школьного курса физики: закон Бойля-Мариотта (P1V1= P2V2при Т=const) и закон Шарля (P=const Tпри V=const). Tпри V=const).
Лабораторная установка.
Экспериментальная установка Клемана-Дезорма (рис.1) состоит из стеклянного баллона А (ёмкость около 20 л), который сообщается с трубкой В, ведущей к нагнетательному насосу и жидкостному (водяному) U-образному манометру М. Кран К1 позволяет отсечь баллон А от насоса, а кран К2 позволяет сообщать баллон с атмосферой.
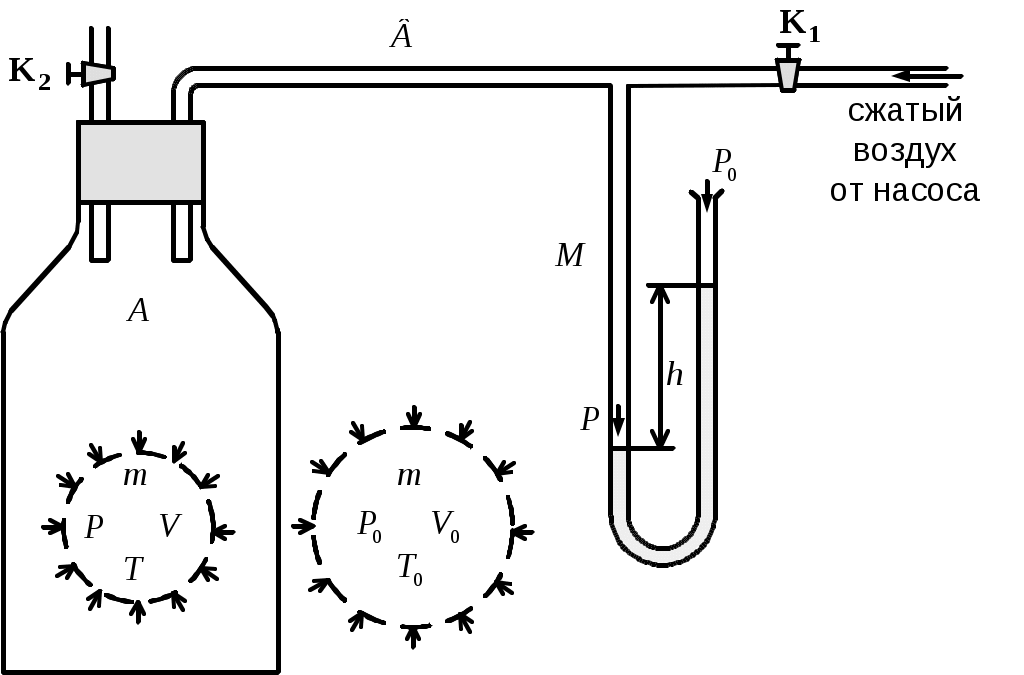  Подготовим установку к эксперименту. Для этого откроем кран К1 и закачаем в баллон избыточный воздух (кран К2 закрыт). Возрастание давления фиксирует манометр М. При накачке воздуха температура его повышается. Это объясняется тем, что силы, прилагаемые к поршню насоса, совершают работу по сжатию газа в баллоне, и средняя энергия молекул, а следовательно, и температура газа в баллоне возрастает. Достигнув перепада высот h в манометре порядка Подготовим установку к эксперименту. Для этого откроем кран К1 и закачаем в баллон избыточный воздух (кран К2 закрыт). Возрастание давления фиксирует манометр М. При накачке воздуха температура его повышается. Это объясняется тем, что силы, прилагаемые к поршню насоса, совершают работу по сжатию газа в баллоне, и средняя энергия молекул, а следовательно, и температура газа в баллоне возрастает. Достигнув перепада высот h в манометре порядка 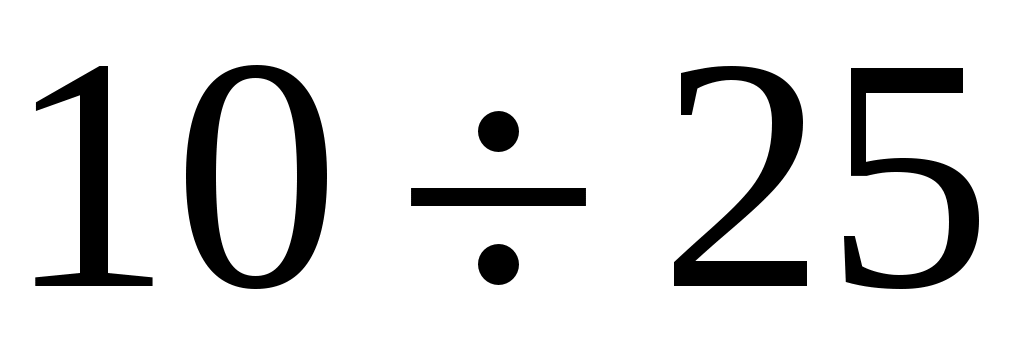 см водяного столба, перекроем кран К1. см водяного столба, перекроем кран К1.
Б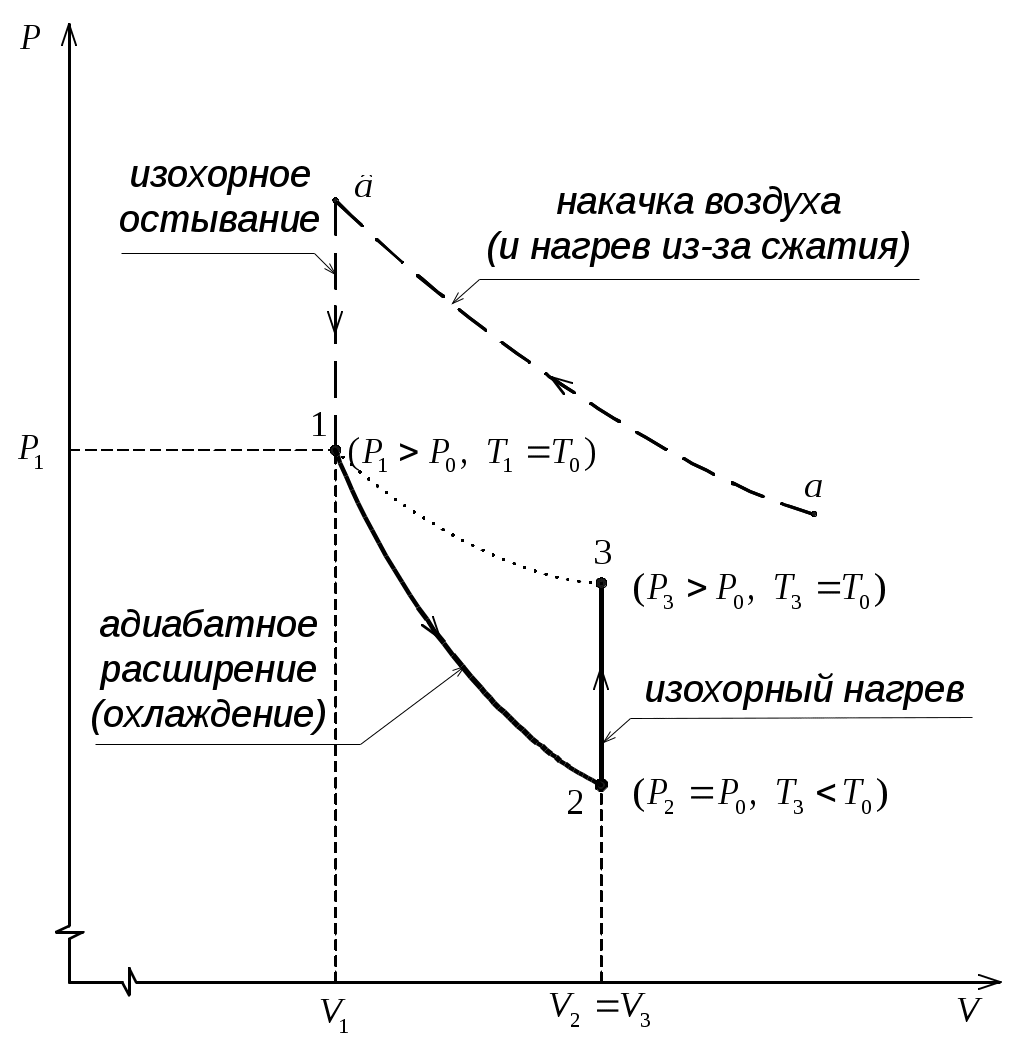  удем мысленно следить за некоторой массой m воздуха внутри баллона. При накачивании в баллон избыточного воздуха давление P и температура T рассматриваемой порции газа возрастают относительно P0и T0 – параметров окружающей среды (комнаты), а объем V – уменьшается (газ сжат). Этот процесс накачки можно изобразить кривой удем мысленно следить за некоторой массой m воздуха внутри баллона. При накачивании в баллон избыточного воздуха давление P и температура T рассматриваемой порции газа возрастают относительно P0и T0 – параметров окружающей среды (комнаты), а объем V – уменьшается (газ сжат). Этот процесс накачки можно изобразить кривой 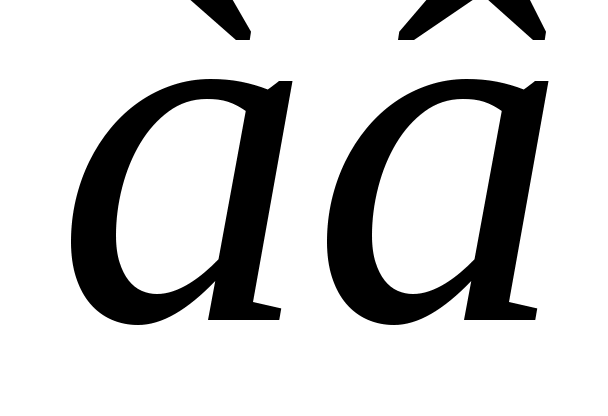 на диаграмме P-V (рис. 2). После перекрывания крана К1 газ оказывается в точке на диаграмме P-V (рис. 2). После перекрывания крана К1 газ оказывается в точке 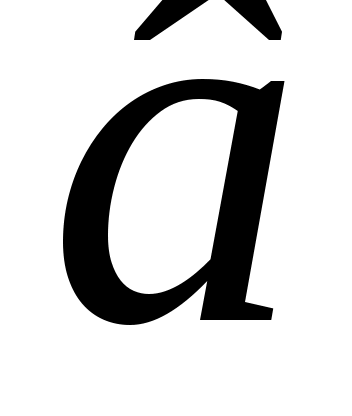 . Поскольку газ нагрет ( . Поскольку газ нагрет (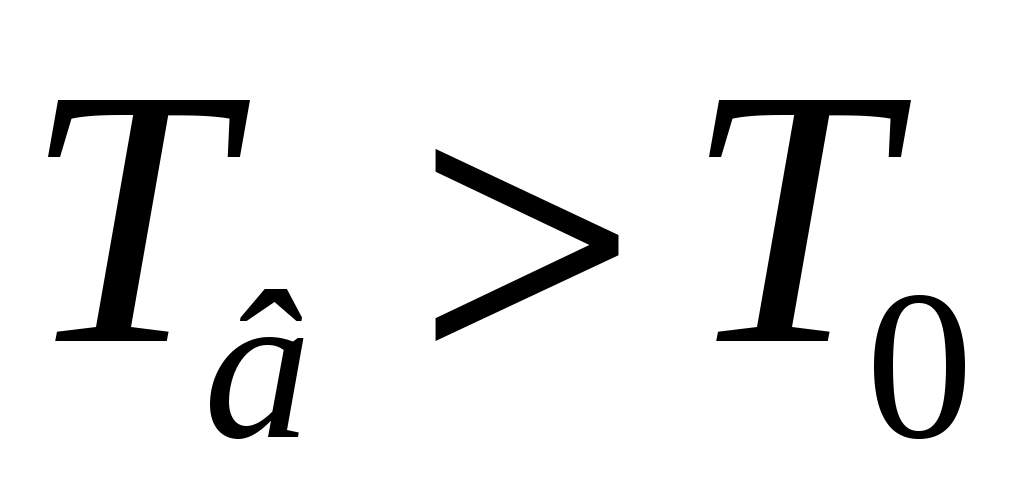 ), а стенки баллона обладают определённой теплопроводностью, то газ начинает постепенно остывать пока температура его не сравняется с комнатной. Это изохорное охлаждение ( ), а стенки баллона обладают определённой теплопроводностью, то газ начинает постепенно остывать пока температура его не сравняется с комнатной. Это изохорное охлаждение (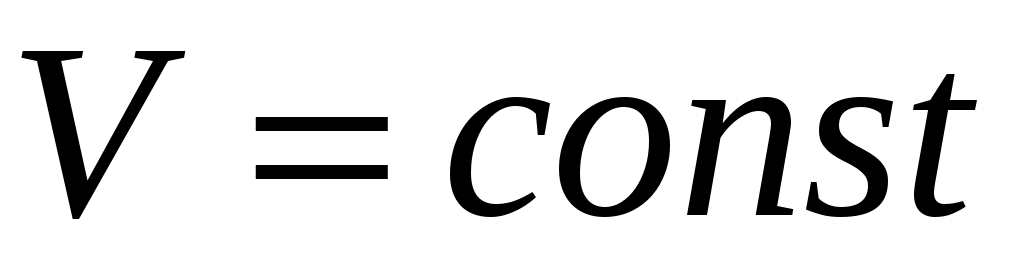 ) на рис.2 изображено линией ) на рис.2 изображено линией 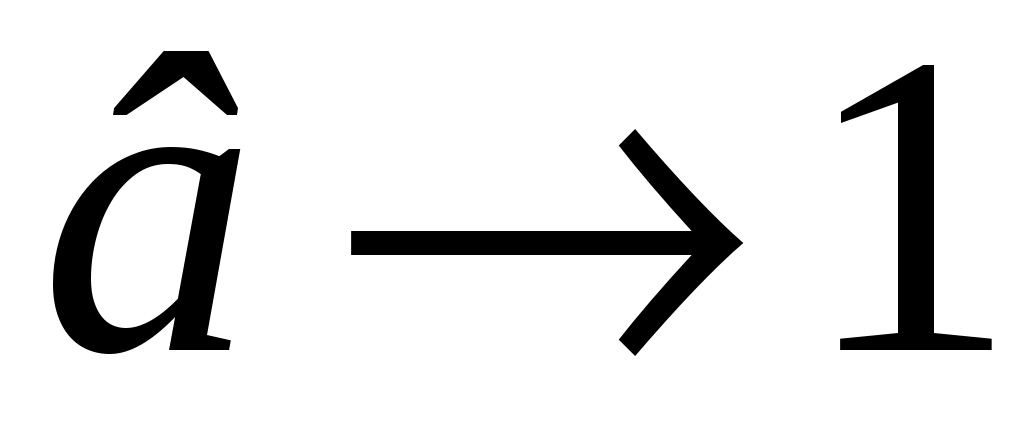 . Изохорное охлаждение по закону Шарля (P пропорционально T) сопровождается уменьшением давления и на установке это наблюдается по уменьшению столба жидкости h в манометре. Когда уровень жидкости в манометре перестанет снижаться, точка 1 достигнута. Это начальная точка для экспериментальных измерений. В ней P1>P0, T1=T0. Измерим это установившееся давление с помощью манометра . Изохорное охлаждение по закону Шарля (P пропорционально T) сопровождается уменьшением давления и на установке это наблюдается по уменьшению столба жидкости h в манометре. Когда уровень жидкости в манометре перестанет снижаться, точка 1 достигнута. Это начальная точка для экспериментальных измерений. В ней P1>P0, T1=T0. Измерим это установившееся давление с помощью манометра 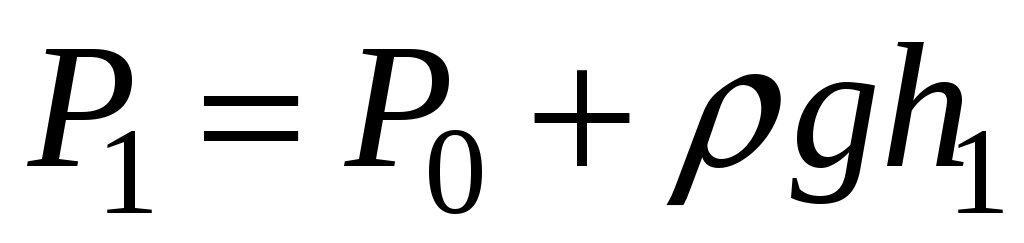 , где , где 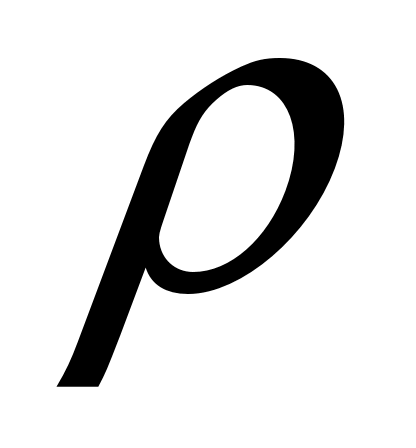 – плотность жидкости в манометре, – плотность жидкости в манометре, 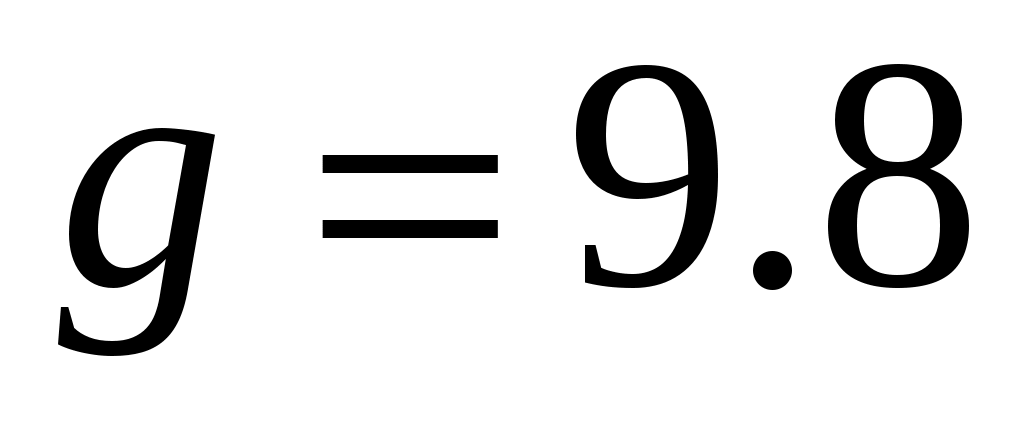 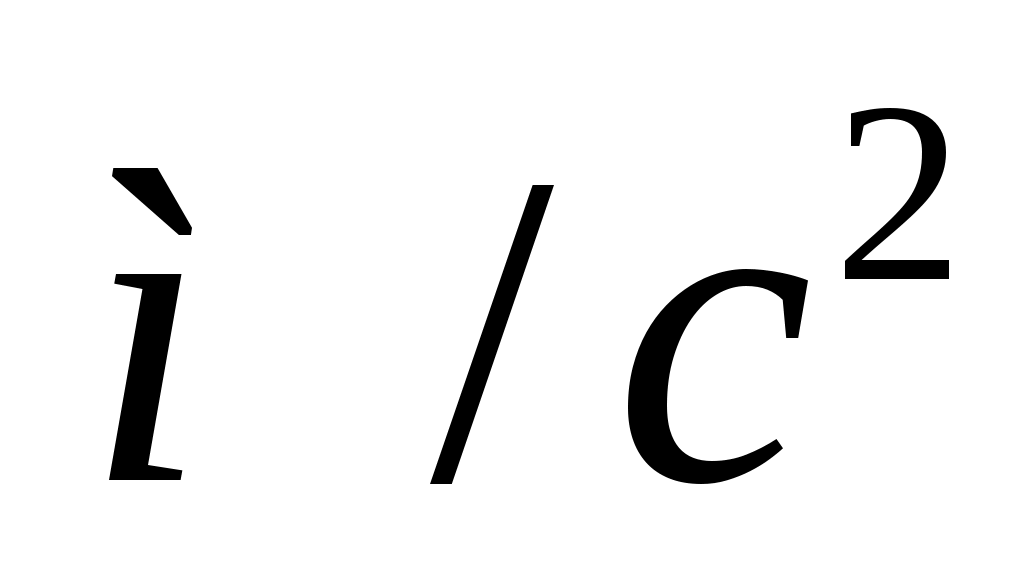 – ускорение свободного падения ( – ускорение свободного падения (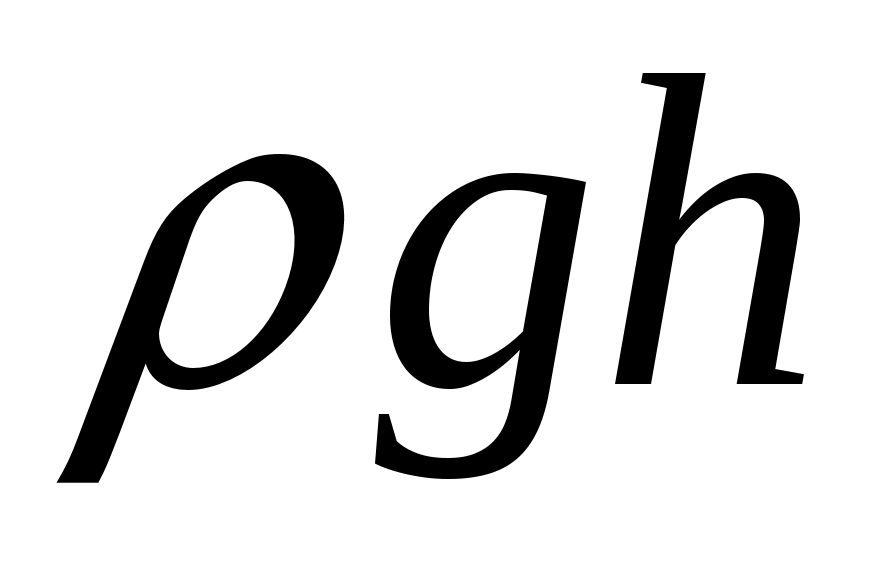 – избыточное давление, равное давлению столба воды). Запишем значение h1. – избыточное давление, равное давлению столба воды). Запишем значение h1.
Эксперимент далее состоит в том, что кран К2 открывают на короткий промежуток времени (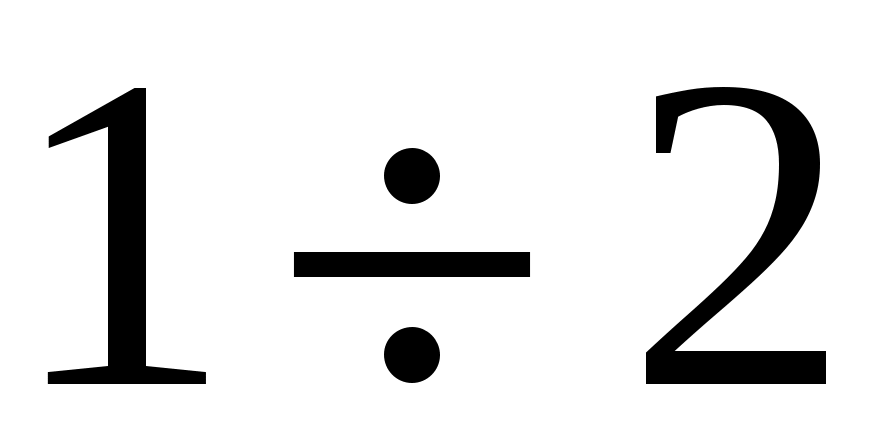 секунды) и снова его закрывают. секунды) и снова его закрывают.
Пока кран К2 открыт, происходит резкий выхлоп избыточного воздуха и давление сравнивается с наружным 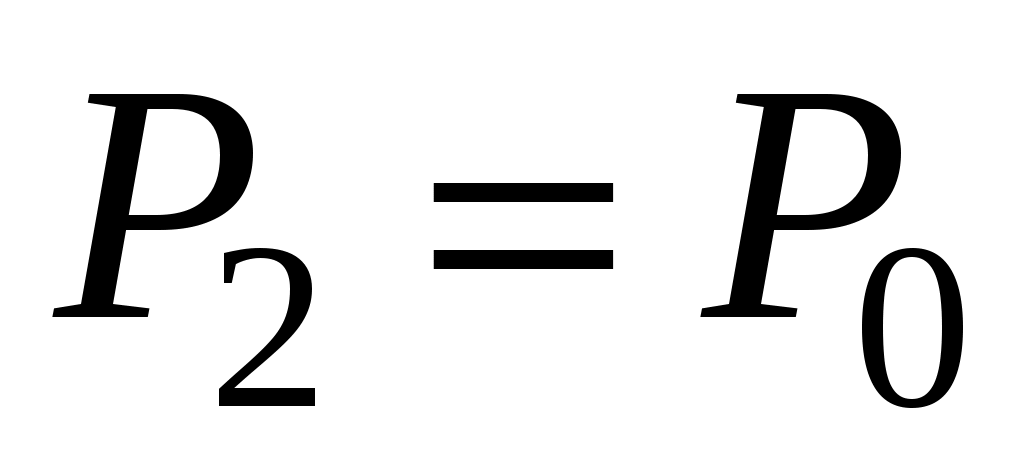 . Поскольку этот процесс происходит очень быстро, то теплообмен между воздухом в баллоне и окружающей комнатной средой не успевает произойти ( . Поскольку этот процесс происходит очень быстро, то теплообмен между воздухом в баллоне и окружающей комнатной средой не успевает произойти (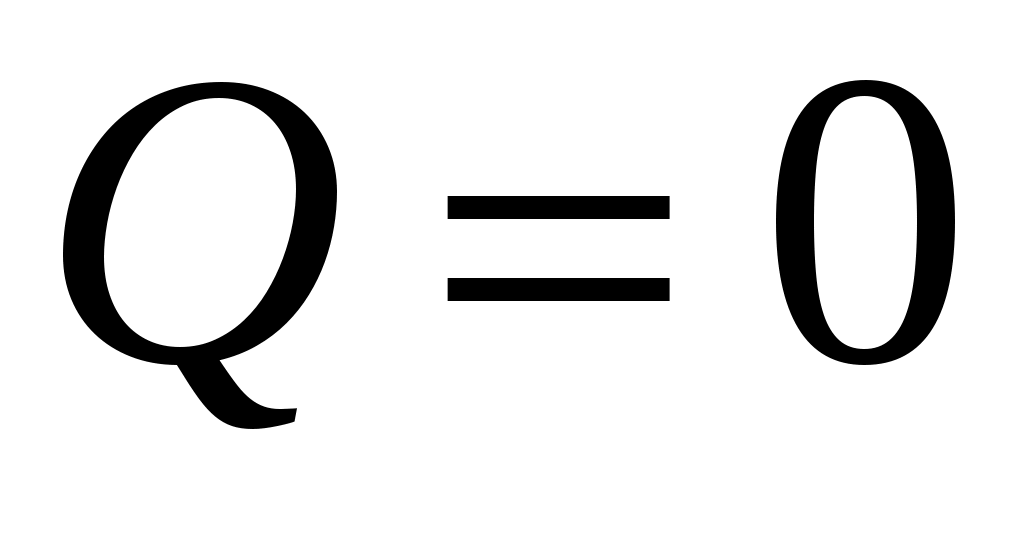 ), и такой процесс быстрого расширения газа можно считать адиабатным. Он подчиняется уравнению Пуассона (5): ), и такой процесс быстрого расширения газа можно считать адиабатным. Он подчиняется уравнению Пуассона (5): 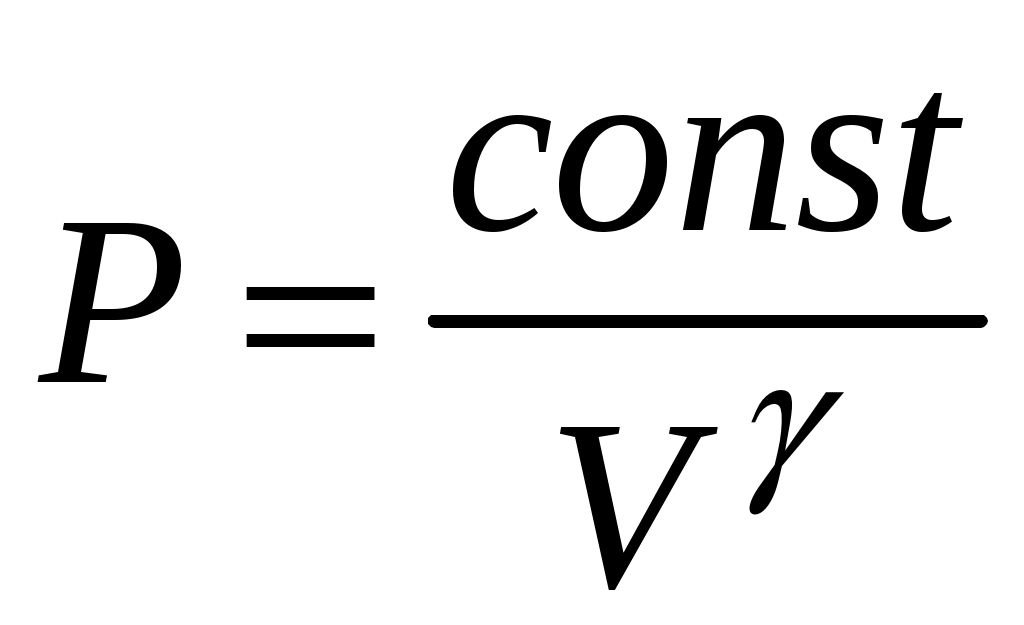 - эта зависимость на рис.2 изображена падающей кривой 1→2. В процессе резкого адиабатного расширения воздух охлаждается (работа расширения совершается за счет убыли внутренней энергии по формуле (3) - эта зависимость на рис.2 изображена падающей кривой 1→2. В процессе резкого адиабатного расширения воздух охлаждается (работа расширения совершается за счет убыли внутренней энергии по формуле (3) 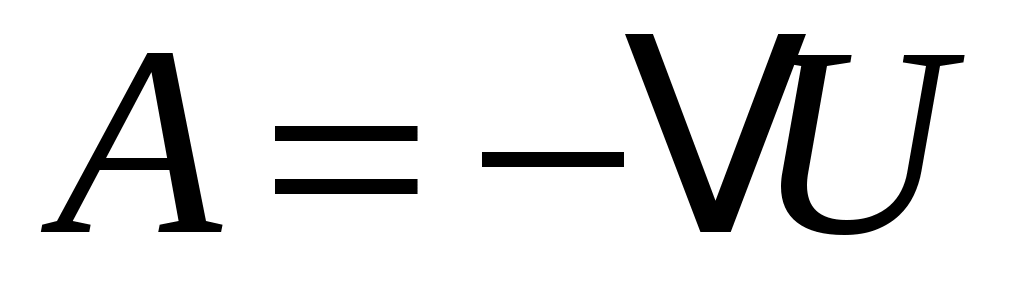 , так как , так как 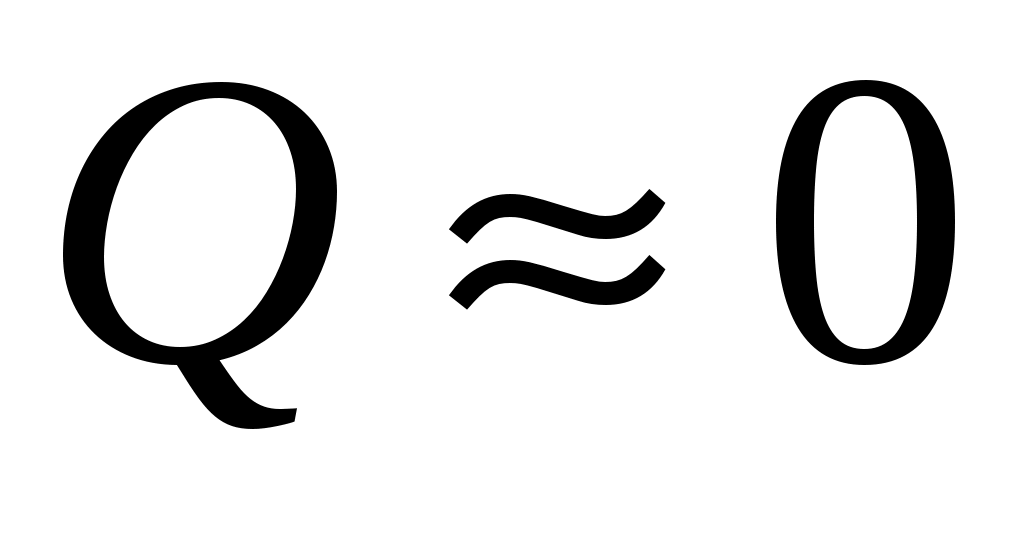 ). В конце адиабатного расширения (в точке 2, в которой кран К2 перекрывается) температура газа T2 становится, таким образом, ниже комнатной ). В конце адиабатного расширения (в точке 2, в которой кран К2 перекрывается) температура газа T2 становится, таким образом, ниже комнатной 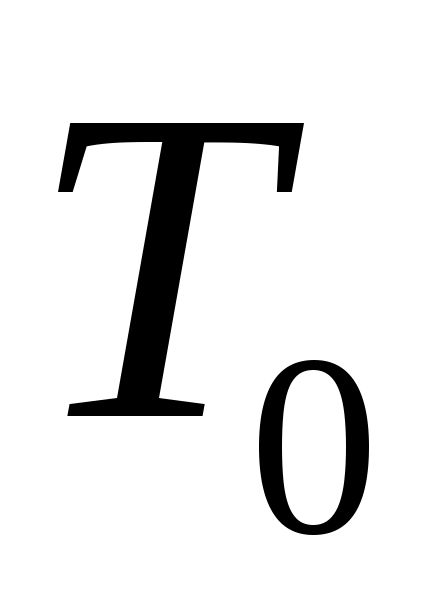 , а давление выравнивается с атмосферным , а давление выравнивается с атмосферным 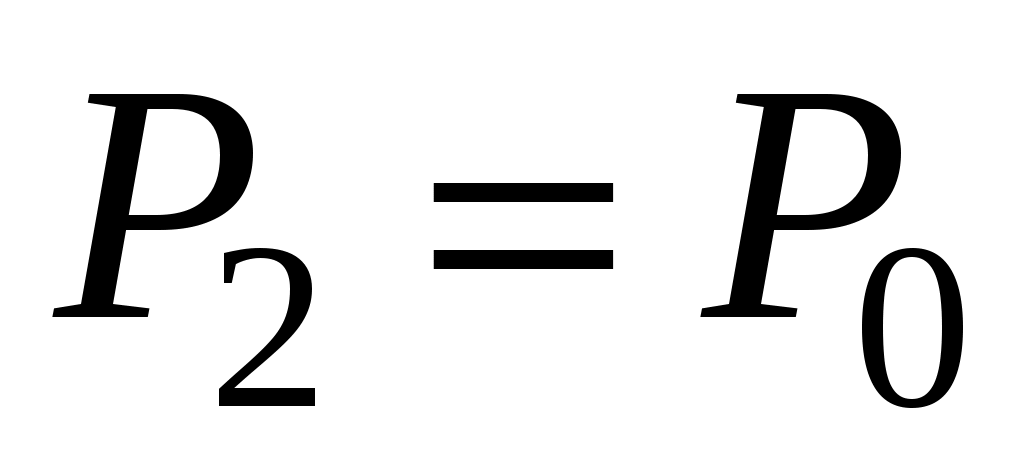 , что фиксируется манометром, который в этот момент показывает h=0. , что фиксируется манометром, который в этот момент показывает h=0.
Далее после перекрытия К2 охлажденный в баллоне воздух благодаря теплопроводности стенок постепенно нагревается до комнатной температуры. Это изохорный нагрев (участок 2-3 на рис.2), в результате которого давление также постепенно возрастает. В точке 3 температура сравнивается с комнатной 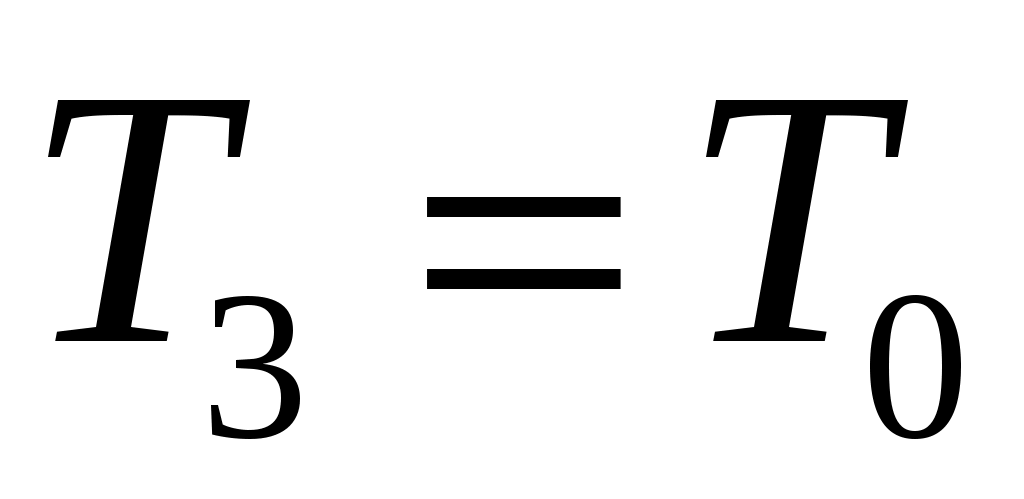 , и давление достигает значения , и давление достигает значения 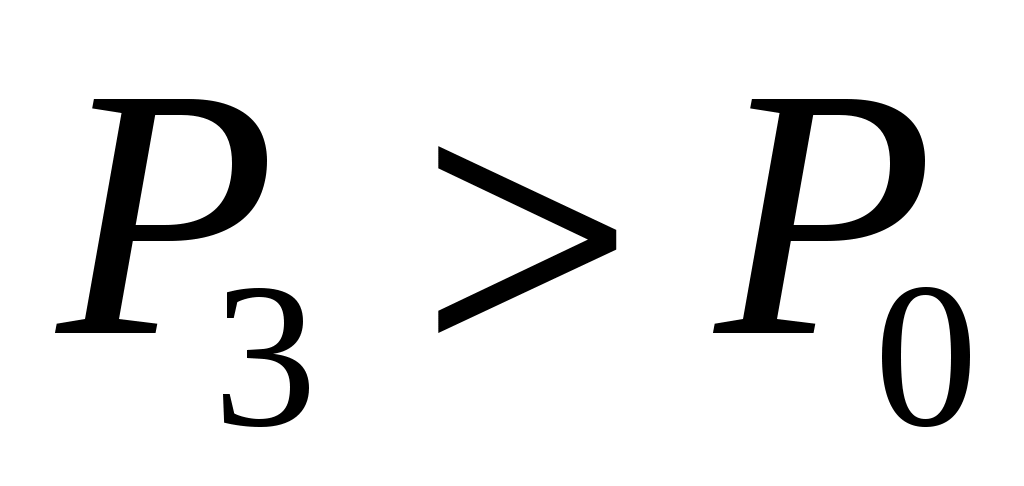 . Это давление также фиксируется манометром: . Это давление также фиксируется манометром: 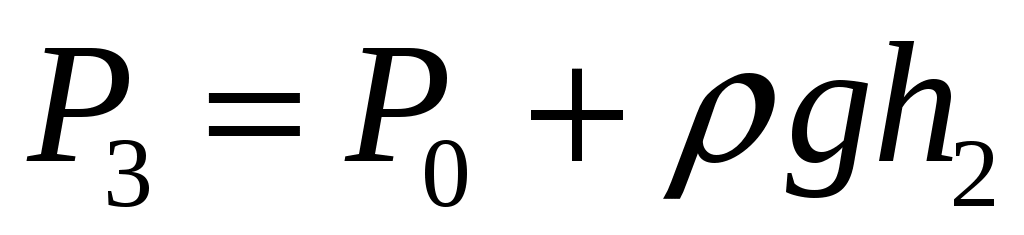 , где h2 – конечный перепад уровней воды в манометре, который также следует записать. , где h2 – конечный перепад уровней воды в манометре, который также следует записать.
Оказывается, по начальному перепаду уровней h1 и конечному h2 можно легко вычислить искомое отношение 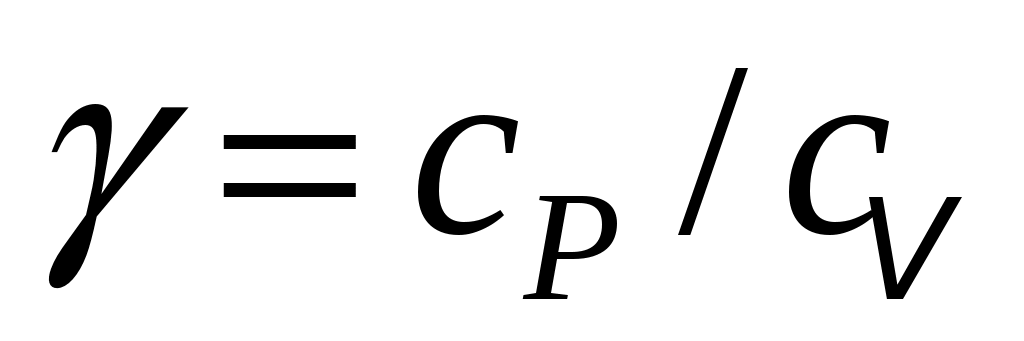 для данного газа (воздуха): для данного газа (воздуха):
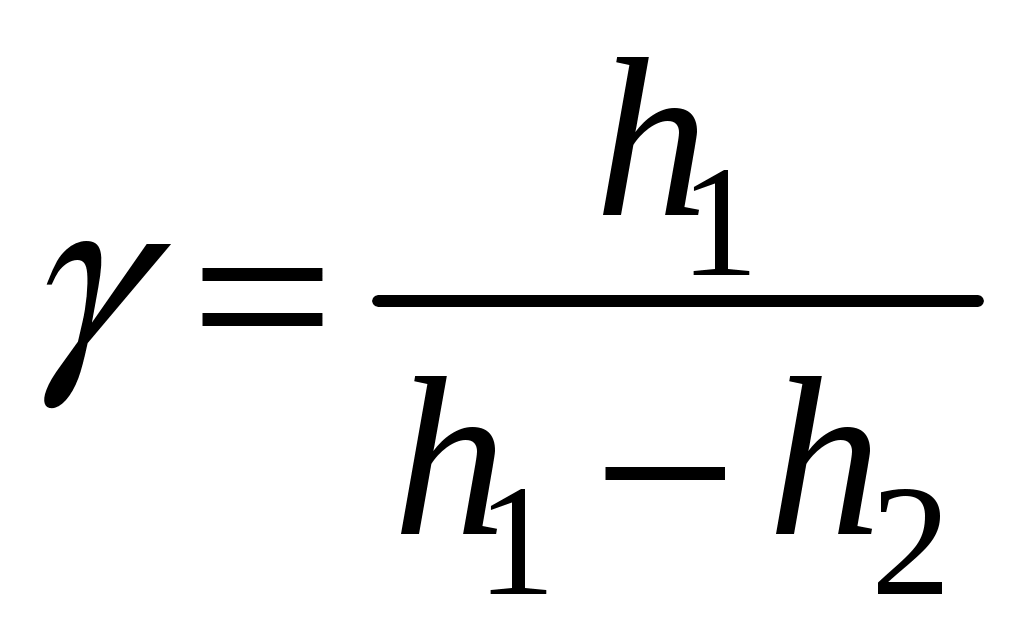 (6) (6)
Обоснуем эту простую формулу, рассматривая рабочие этапы графика 1-2-3 с помощью известных газовых законов. Между состояниями 1 и 2 (рис.2) идёт адиабатный процесс. По уравнению Пуассона (5) запишем:
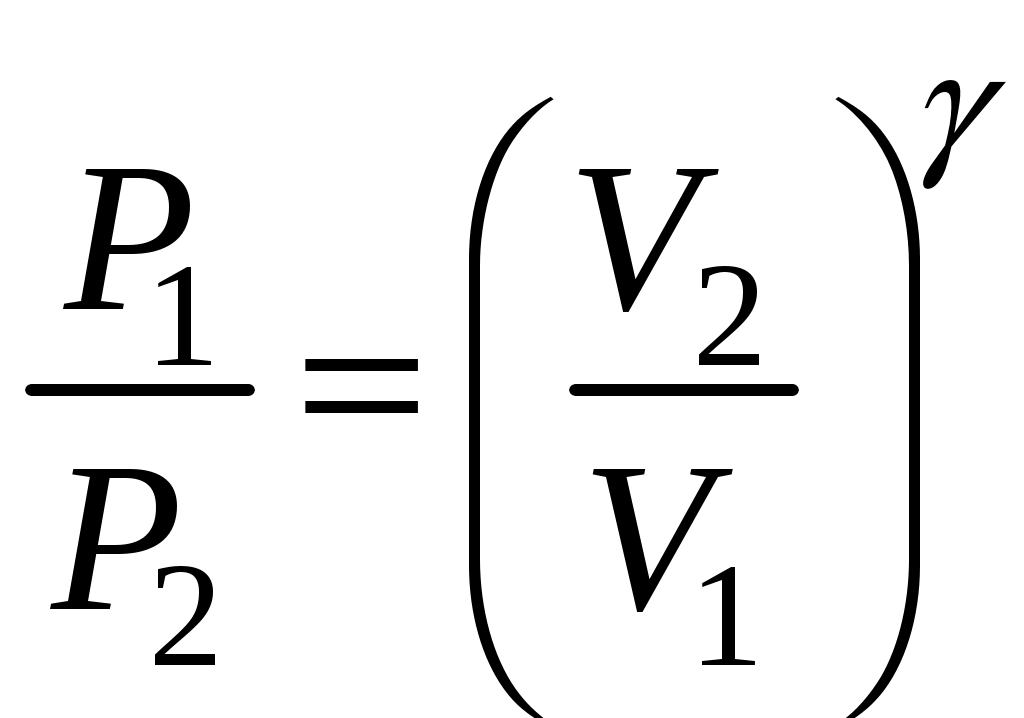 (7) (7)
Состояние 1 и 3 оказываются при одинаковой температуре Т1= Т3= Т0, и следовательно, связаны законом Бойля-Мариотта
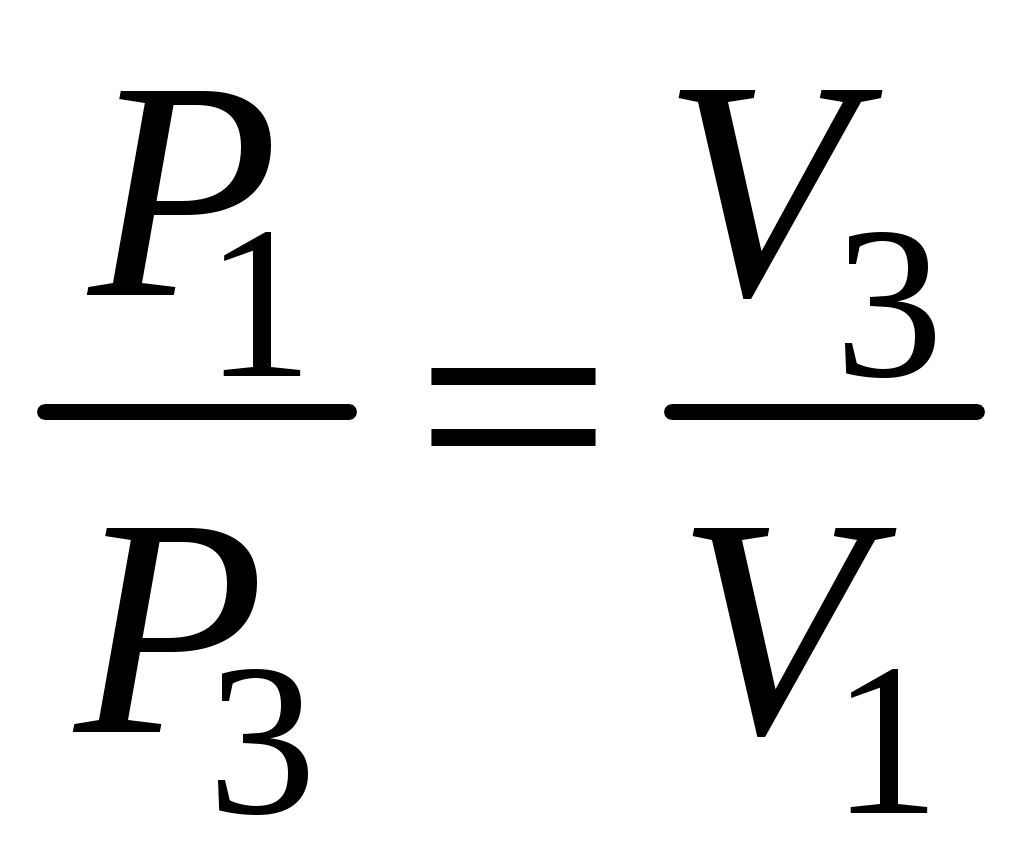 (8) (8)
Заметим, что в этом эксперименте изотермического процесса нет, но точки 1 и 3 лежат на краях мысленной изотермы, которая для наглядности проведена на рис.2 пунктиром.
Поскольку V3=V2, то возведя (8) в степень 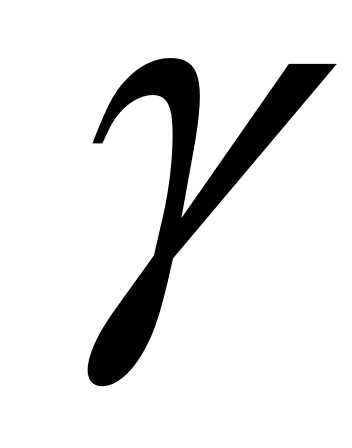 , мы получим равенство правых частей (8) и (7). Приравняв левые части, получим: , мы получим равенство правых частей (8) и (7). Приравняв левые части, получим:
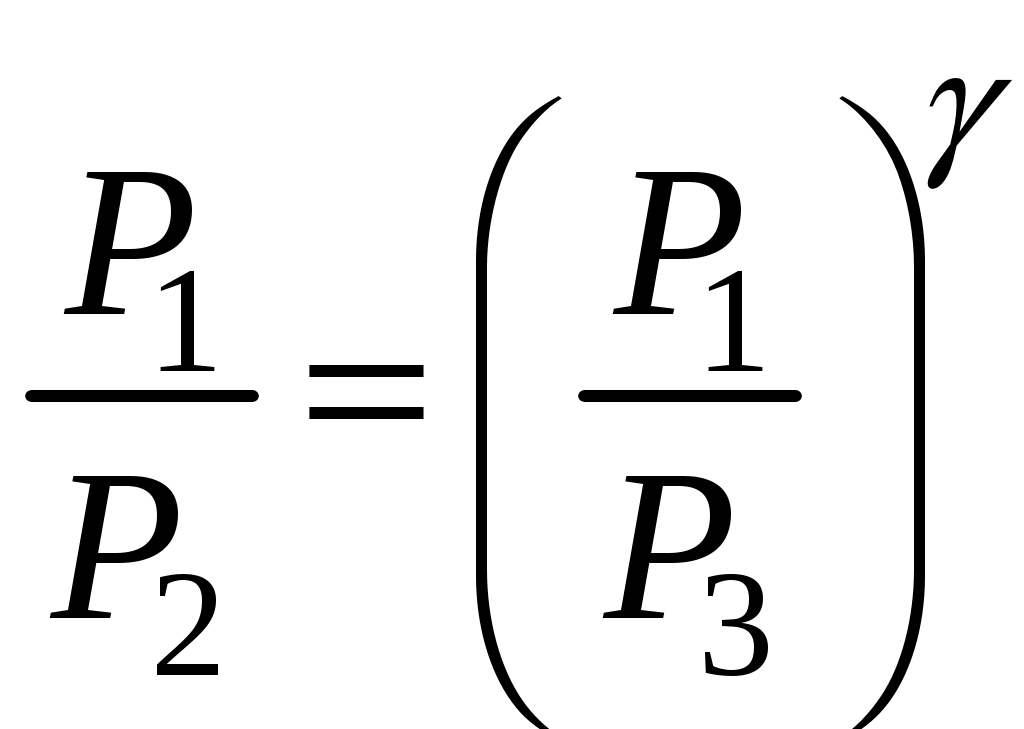 (9) (9)
Отсюда, измеряя только давления, можно определить γ. Приведём формулу (9) к виду (6). Для этого прологарифмируем (9): 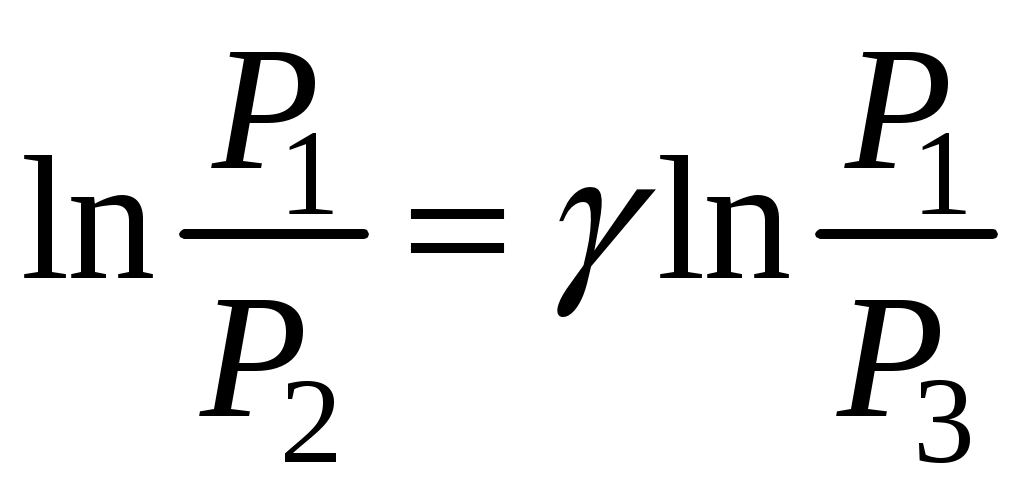
и найдём 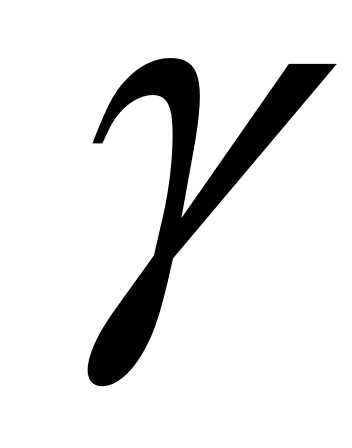 , выражая P1, P2, P3 через P0, h1, h2, , выражая P1, P2, P3 через P0, h1, h2,
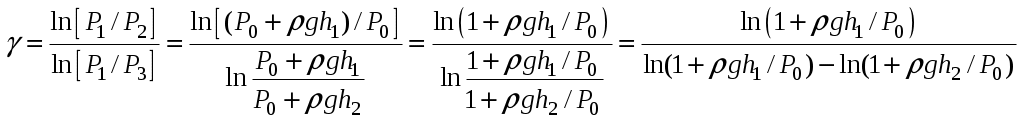 В математике есть простое правило: если х << 1, то ln(1+x) В математике есть простое правило: если х << 1, то ln(1+x) x. В этом можно убедиться с помощью калькулятора. Например, ln 1.02 x. В этом можно убедиться с помощью калькулятора. Например, ln 1.02  0.02 и т.п. 0.02 и т.п.
В нашем случае все дроби вида 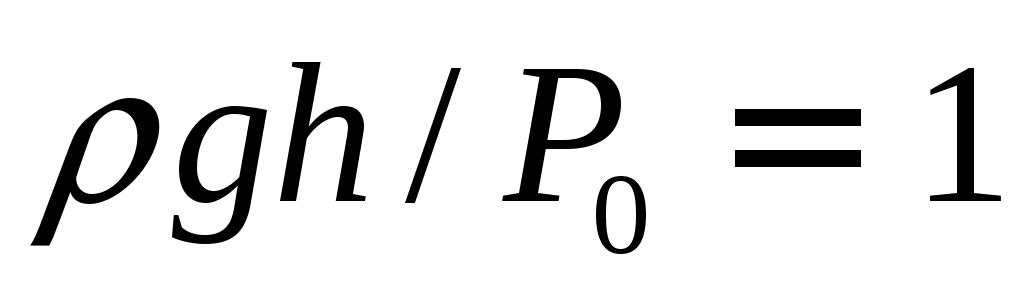 , т.к. давление ρgh – это давление порядка 0.2 м водяного столба, а P0 – атмосферное давление порядка 10 м водяного столба, как известно из начального курса школьной физики. , т.к. давление ρgh – это давление порядка 0.2 м водяного столба, а P0 – атмосферное давление порядка 10 м водяного столба, как известно из начального курса школьной физики.
Поэтому с хорошей точностью можно записать
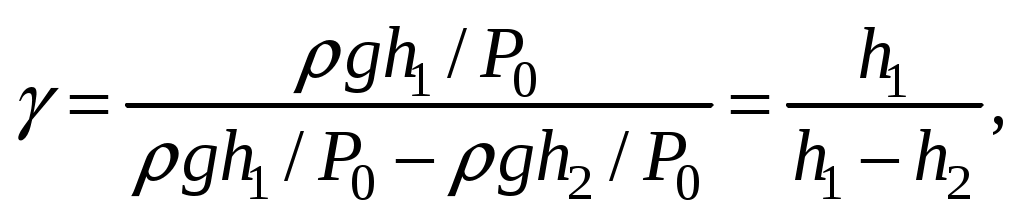
что и требовалось доказать. Мы получили рабочую формулу (6).
Порядок выполнения работы.
1. Открыть кран К1 и с помощью насоса (компрессора) накачать в баллон воздух до избыточного давления в пределах 25см водяного столба, контролируемого манометром.
2. Закрыть кран К1 и следить за понижением уровня в манометре (идёт изохорное охлаждение газа до комнатной температуры).
3. Когда уровень перестанет понижаться, записать величину h1.
4. Открыть кран К2 на 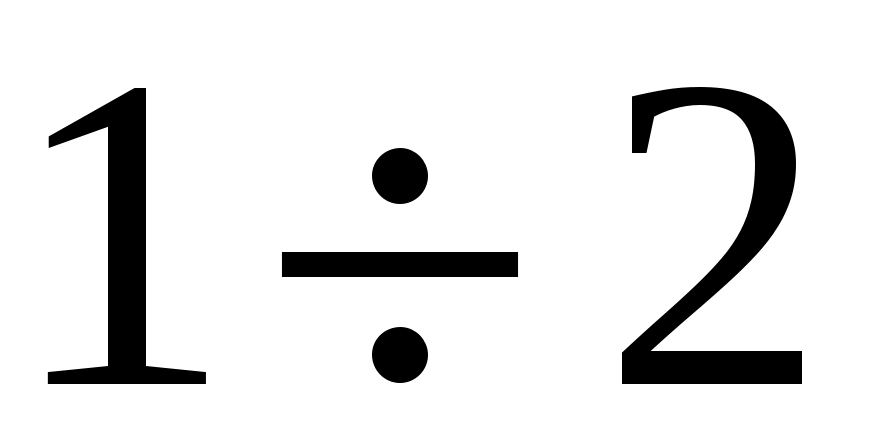 секунды, чтобы произошел адиабатный выхлоп избыточного воздуха, и снова закрыть кран К2 (обратить внимание, что во время выхлопа, избыточное давление падало до нуля, h=0). секунды, чтобы произошел адиабатный выхлоп избыточного воздуха, и снова закрыть кран К2 (обратить внимание, что во время выхлопа, избыточное давление падало до нуля, h=0).
5. Наблюдать за повышением давления после закрытия крана К2 (идёт изохорный нагрев охлаждённого газа до комнатной температуры). Записать максимальный подъём уровня жидкости в манометре h2.
6. По формуле (6) вычислить отношение 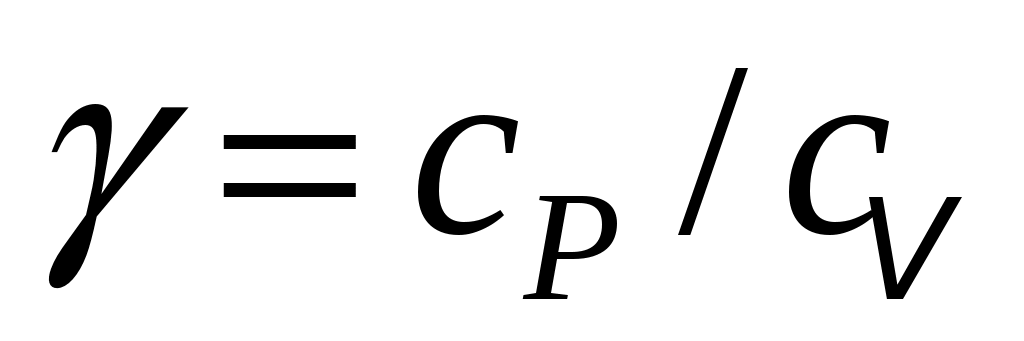 для воздуха. для воздуха.
7. Повторить опыт (пункты 1-6) не менее 5 раз. Все данные записать в таблицу.
Номер опыта
|
h1
|
h2
|
γi
|
∆γi
|
γ
|
∆γ
|
|
мм
|
мм
|
|
|
|
|
1


5
|
|
|
|
|
|
|
8. Усреднить результат
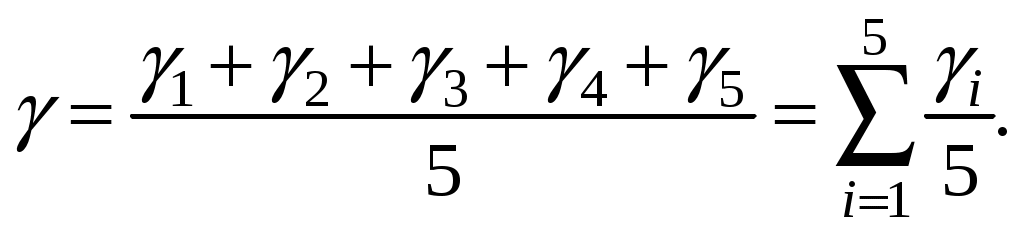 (10) (10)
9. Определить стандартную ошибку отдельных значений γi., по формуле
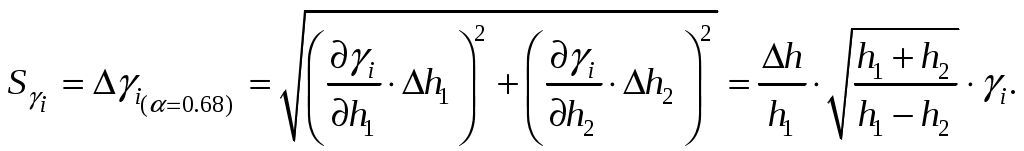
Здесь учтено, что 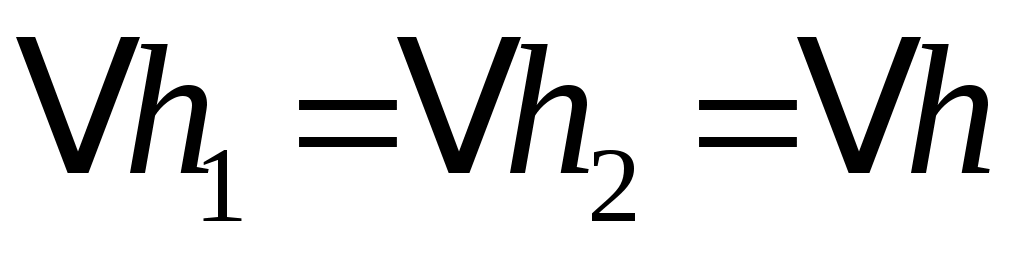 , так как в обоих случаях это есть ошибка миллиметровой шкалы манометра. , так как в обоих случаях это есть ошибка миллиметровой шкалы манометра.
10. Поскольку окончательно γ определяется по формуле (10), найдём стандартную ошибку усреднённого результата (с вероятностью 68%)
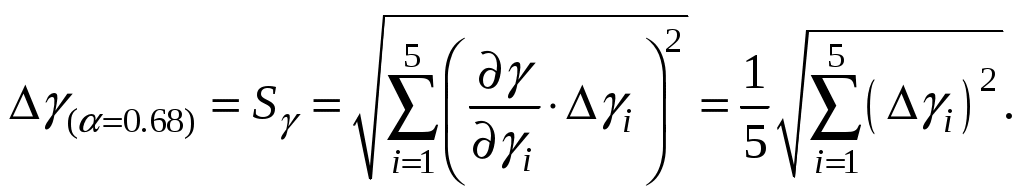
11. Записать окончательный результат и сделать выводы.
Контрольные вопросы.
1. Что называется теплоёмкостью тела? Удельной теплоёмкостью?
2. Сформулировать первое начало термодинамики
3. Какая теплоёмкость газа выше: 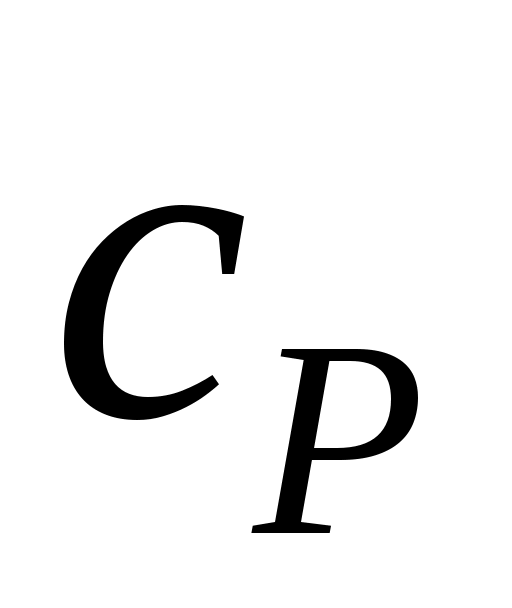 или или 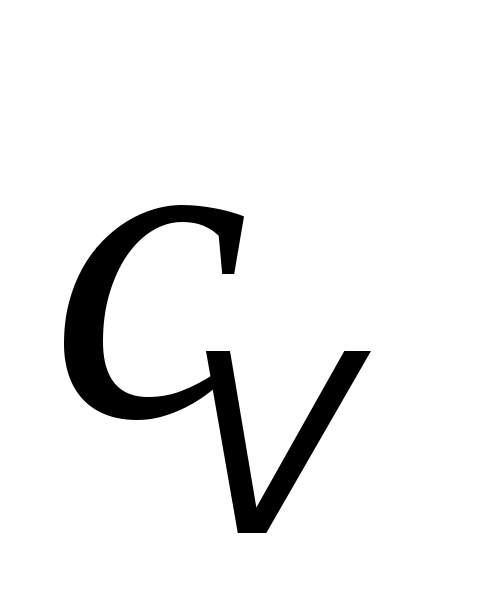 и почему? и почему?
4. Что такое адиабатный процесс? Написать уравнение Пуассона. Изобразить график адиабатного процесса.
5. Изобразить схему установки Клемана-Дезорма для определения отношения теплоёмкостей газа 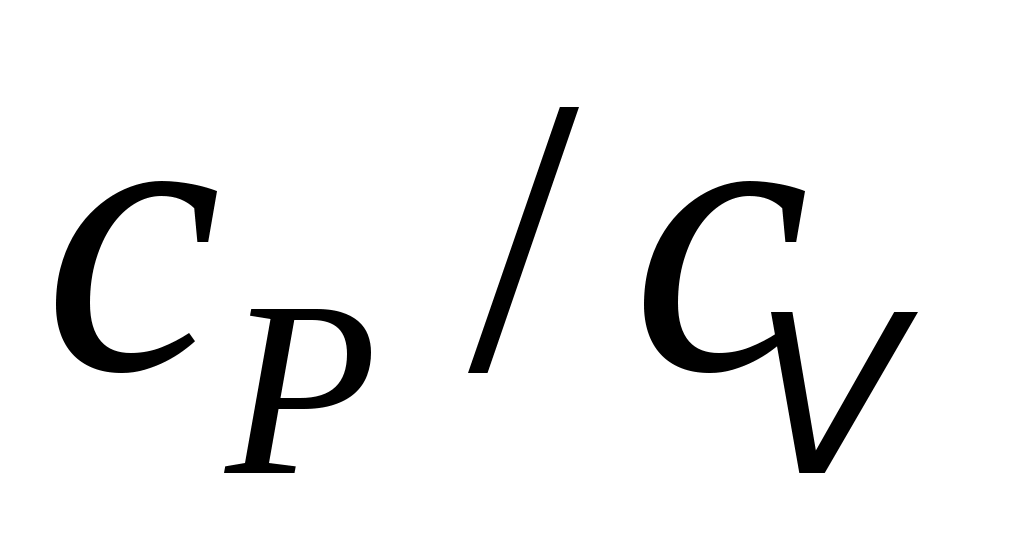 . Перечислить последовательно все операции одного цикла опыта с указанием типов термодинамических процессов газа на каждом этапе. . Перечислить последовательно все операции одного цикла опыта с указанием типов термодинамических процессов газа на каждом этапе.
6. Изобразить все процессы одного цикла на диаграмме P-V.
7. Вывести расчетную формулу для определения величины 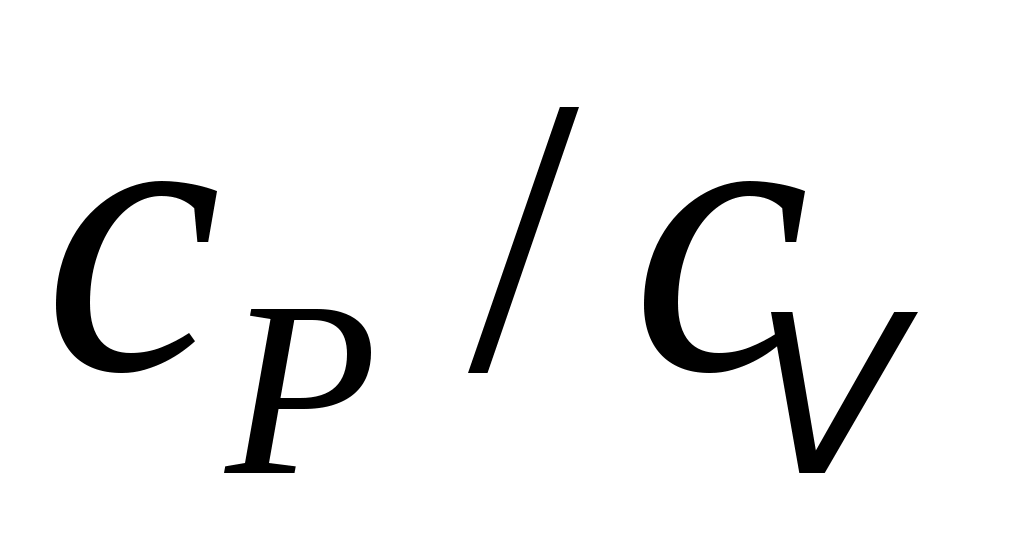 . .
8. Почему состояния в начале адиабатного процесса и в конце изохорного нагрева связаны законом Бойля-Мариотта?
9. Вывести формулу для расчета погрешности величины 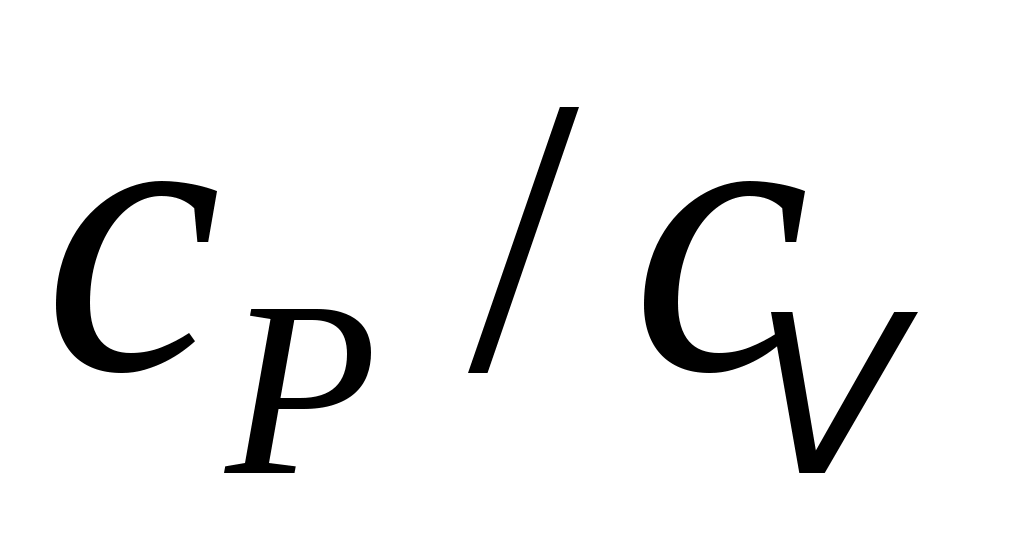 . .
Литература
1. Трофимова Т.И. Курс физики. М.: Высш. шк., 2008.
2. Руководство к лабораторным работам по физике (под редакцией Гольдина Л.Л). М.: Наука, 1973.
|
|
|
 Скачать 0.5 Mb.
Скачать 0.5 Mb.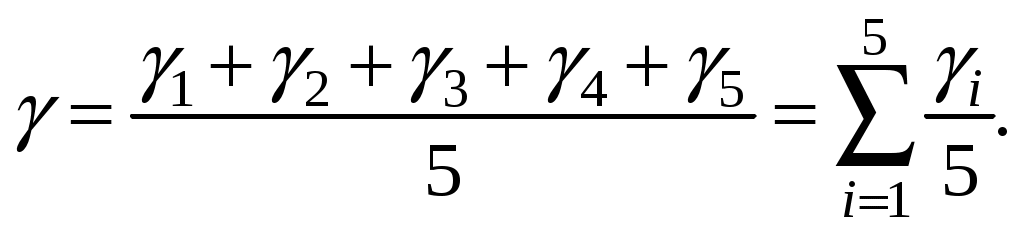 (10)
(10)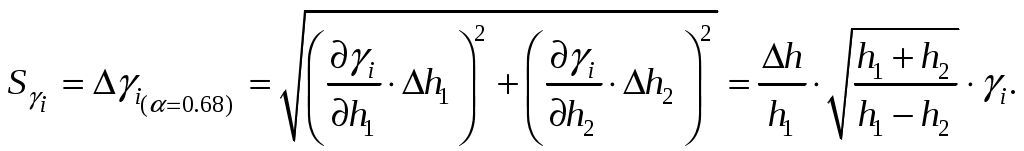
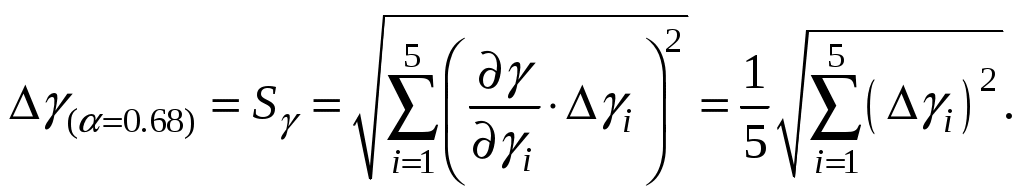


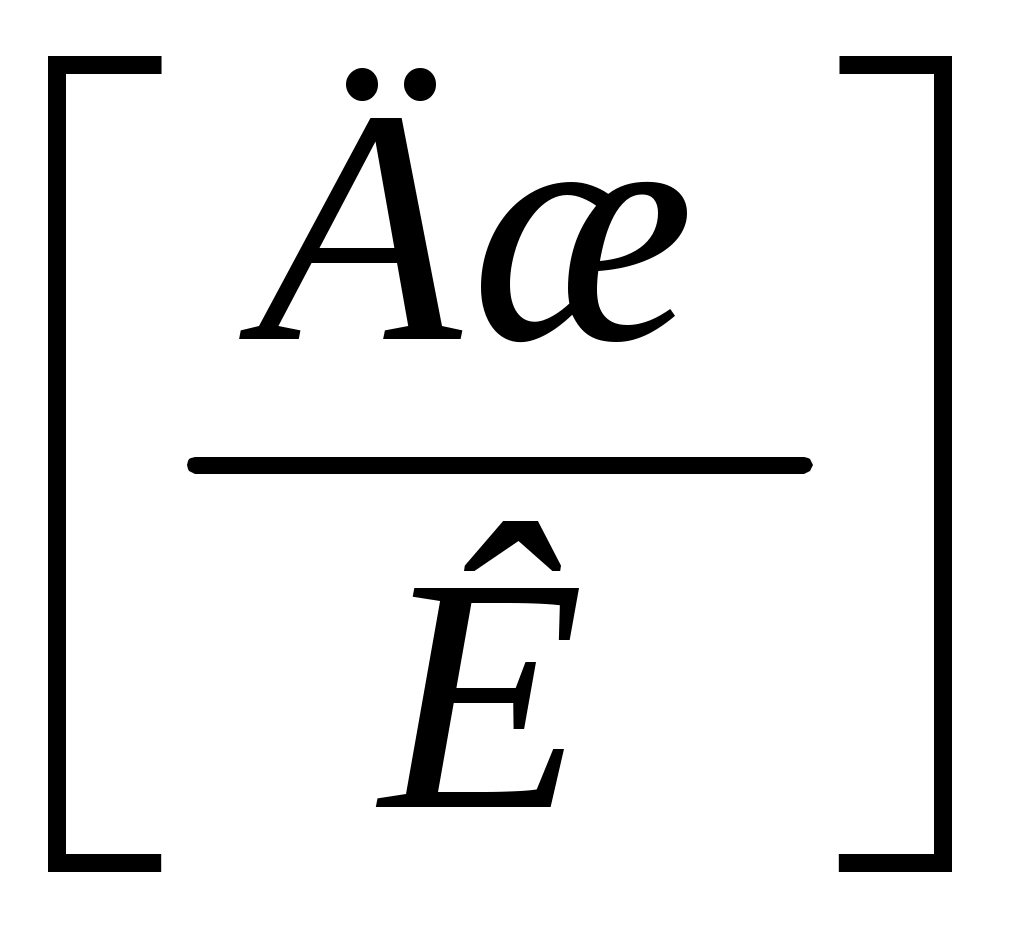 (1)
(1)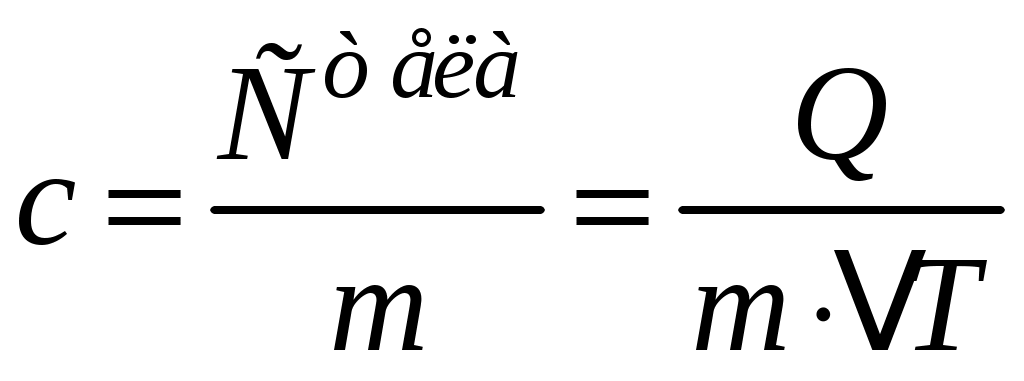
 . (2)
. (2)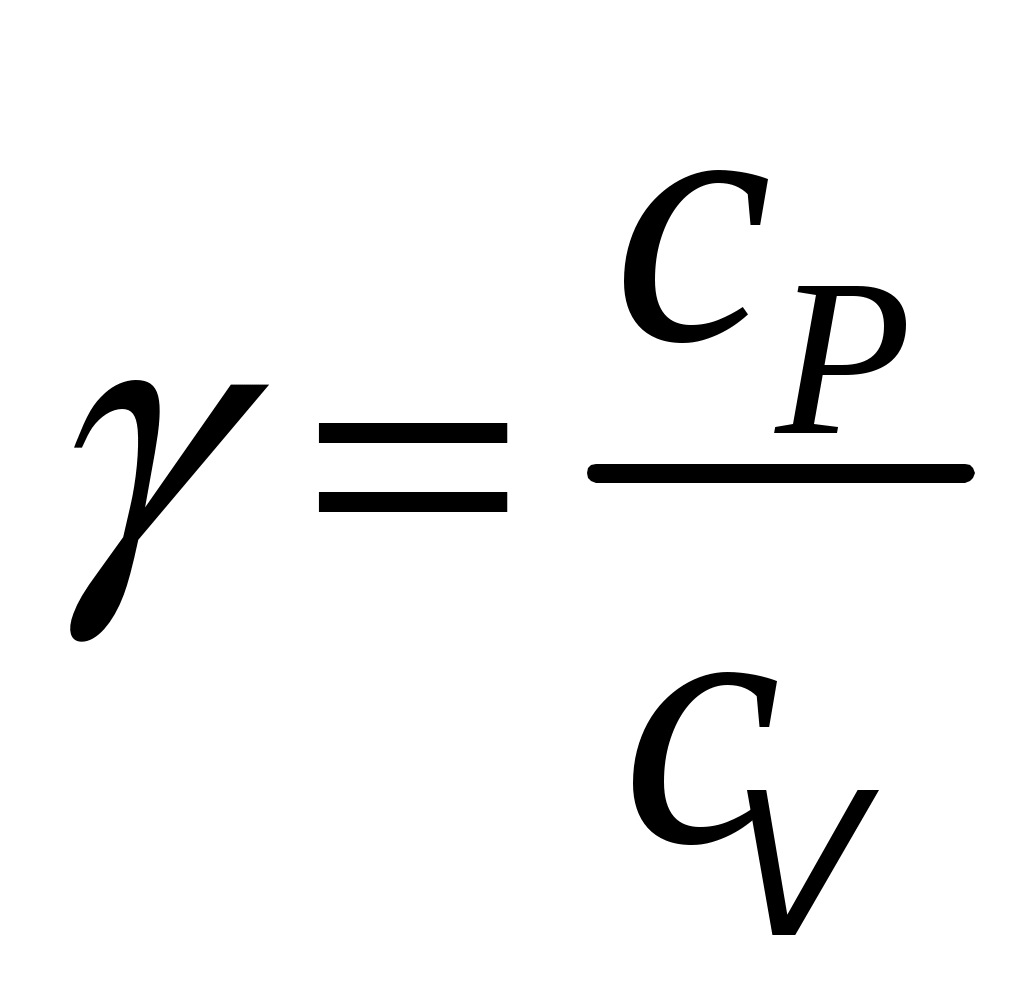 (4)
(4)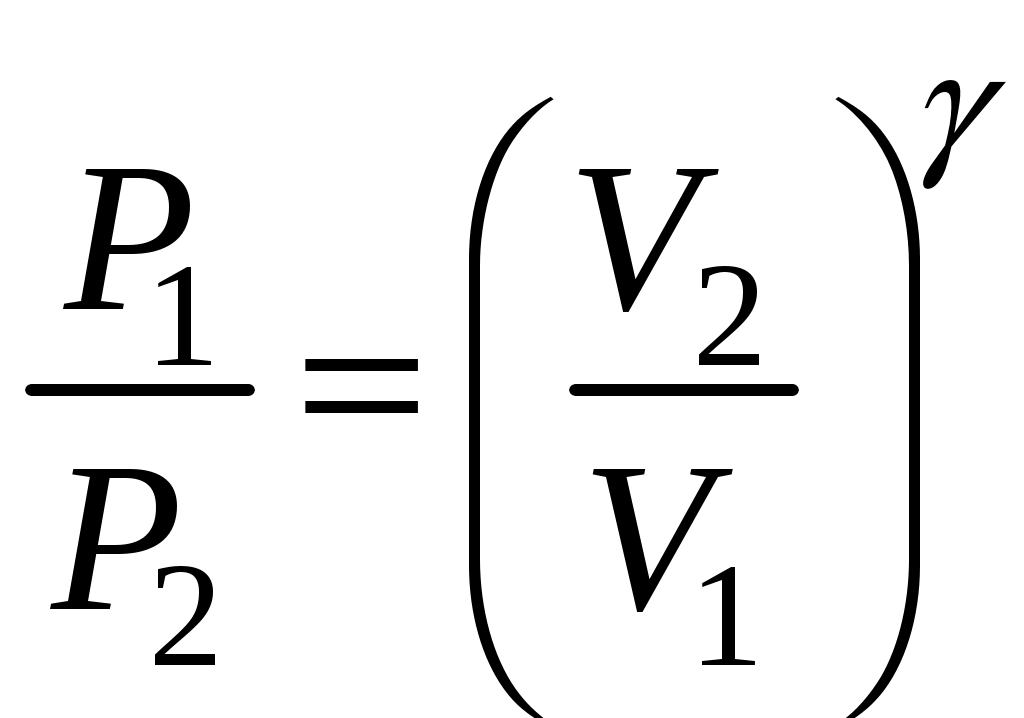 – (5)
– (5)

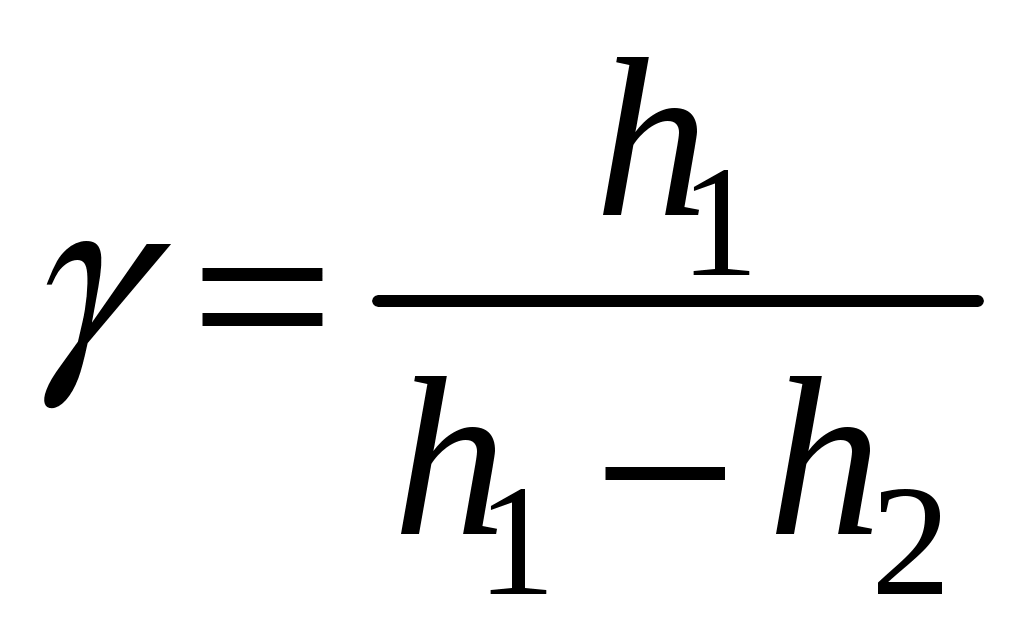 (6)
(6)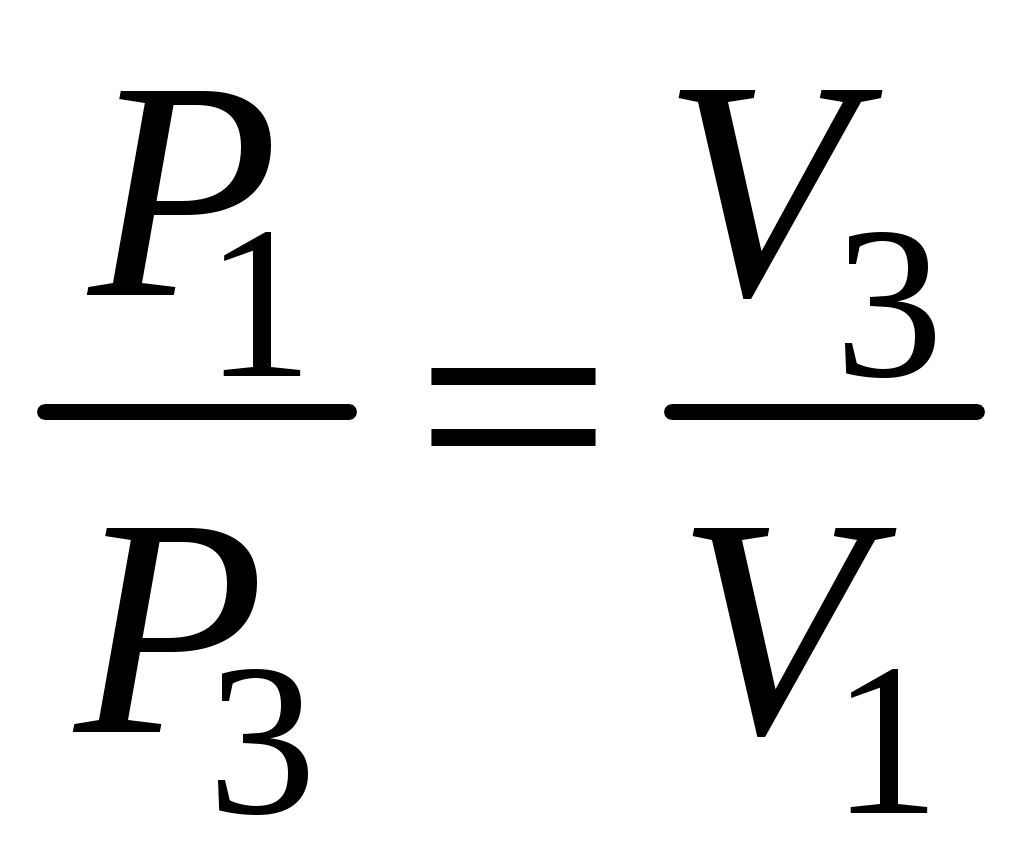 (8)
(8)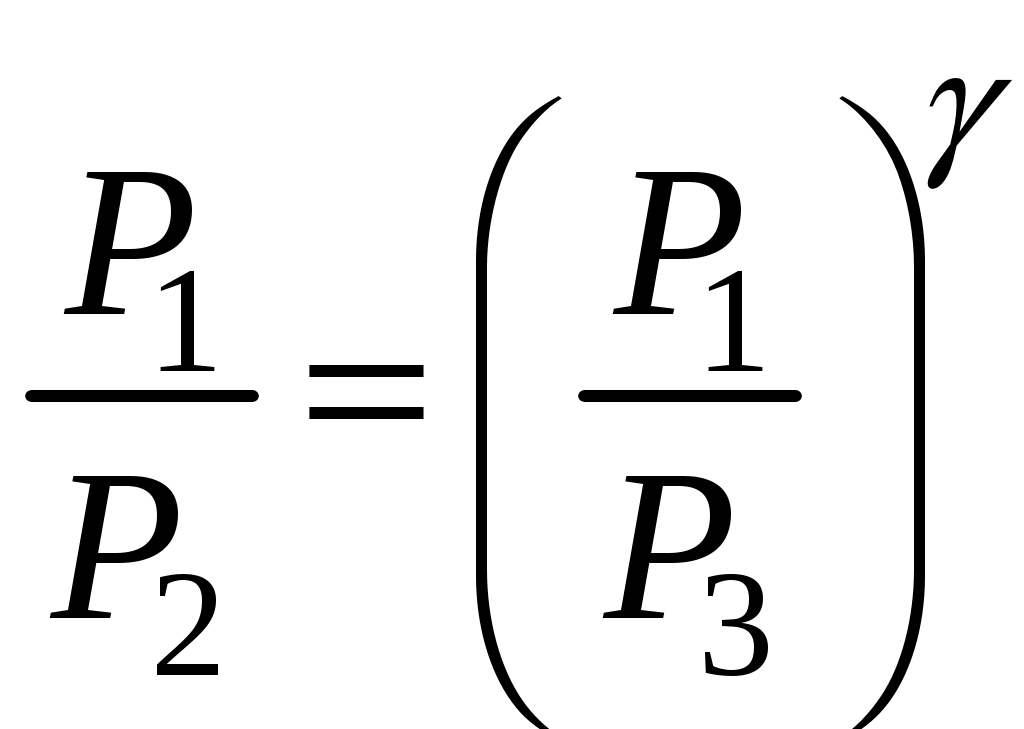 (9)
(9)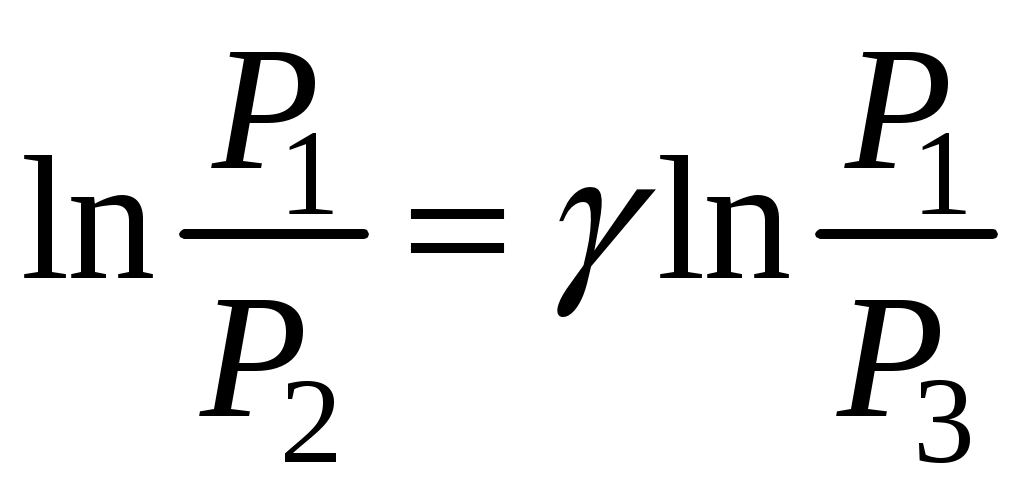
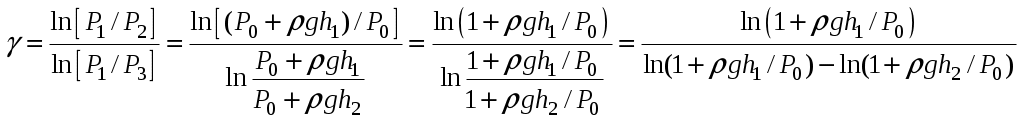 В математике есть простое правило: если х << 1, то ln(1+x)
В математике есть простое правило: если х << 1, то ln(1+x)