Газовые циклы. Методические указания к расчетнографическим работам для студентов iiiii курсов фла
 Скачать 1.94 Mb. Скачать 1.94 Mb.
|
1 2 Министерство образования и науки Российской Федерации НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ 53 № 3319 Г 135 ГАЗОВЫЕ ЦИКЛЫМетодические указания к расчетно-графическим работам для студентов II–III курсов ФЛА (специальности 160201, 160202, 150300) дневного отделения НОВОСИБИРСК 2007 УДК 533.6(07) Г 135 Составители: д-р техн. наук, проф. Ю.В. Дьяченко, канд. техн. наук, доц. А.С. Захаров Рецензент канд. техн. наук, доц. В.А. Спарин Работа подготовлена на кафедре технической теплофизики Новосибирский государственный т  ехнический университет, 2007 ехнический университет, 2007 1. Параметры состояния Для определения конкретных физических условий, характеризующих состояние вещества, используют так называемые параметры состояния. Состояние любого вещества можно охарактеризовать тремя внутренними параметрами состояния: Уравнение, связывающее между собой параметры состояния, называется уравнением состояния вещества. Для идеального газа уравнение состояния (уравнение Клапейрона) может быть представлено в следующих видах: для 1 кг газа для где Изменение всех трех параметров состояния Изменение хотя бы одного параметра состояния приведет к изменению двух остальных параметров состояния в соответствии с уравнением состояния (2). Совокупность изменяющихся параметров состояния вещества называется термодинамическим процессом. Термодинамические процессы подразделяются на равновесные и неравновесные. Равновесными называются процессы, представляющие непрерывную последовательность равновесных состояний вещества, когда все части вещества имеют одинаковые параметры состояния. Любой реальный процесс в той или иной степени является неравновесным, но степень неравновесности будет тем меньше, чем меньше скорость протекания процесса. Поэтому равновесный процесс является предельным случаем неравновесного процесса, когда скорость протекания процесса стремится к нулю. В дальнейшем под понятием «процесс» будем понимать только равновесный процесс. Термодинамическая поверхность (рис. 1, а) характеризует поле всех возможных состояний вещества. Процесс перехода от состояния 1 до состояния 2 будет графически изображаться кривой 1-2 на термодинамической поверхности. В трехмерных координатах графическое представление процессов затруднено, поэтому чаще используют плоские диаграммы состояния. На рис. 1, б представлена проекция процесса 1-2 на плоскость  Рис. 1. Графическая интерпретация термодинамических процессов 2. Энергетические характеристики Полная энергия тела или системы макротел в термодинамике определяется как сумма кинетической, потенциальной и внутренней энергии Кинетическая энергия определяется как где Потенциальная энергия определяется положением системы в силовом поле. Внутренняя энергия заключена в самой системе и представляет сумму всех видов движения и взаимодействия частиц, составляющих систему. Внутренняя энергия складывается из энергии поступательного и вращательного движения молекул, энергии сил сцепления между молекулами, внутримолекулярной, внутриатомной энергии (энергии электронных оболочек) и внутриядерной энергии. Внутренняя энергия является функцией параметров состояния, в общем виде Изменение внутренней энергии не зависит от процесса изменения состояния, а определяется ее значениями в конечном и начальном состояниях. Изменение внутренней энергии в термодинамическом процессе 1-2 Внутренняя энергия является экстенсивной характеристикой вещества, т. е. пропорциональна количеству вещества В системе СИ внутренняя энергия измеряется в джоулях (Дж), удельная внутренняя энергия – джоулях на килограмм Термодинамическая система обменивается энергией с окружающей средой в виде работы и теплоты. В общем случае в результате подвода теплоты к телу (или телам, составляющим термодинамическую систему) происходит повышение внутренней энергии тела и при увеличении объема тела совершается работа над окружающей средой. Это положение называется первым законом термодинамики. В дифференциальной форме через удельные характеристики где Теплота, подводимая к телу, принимается положительной, отводимая – отрицательной. Работа, совершаемая телом над окружающей средой, принимается положительной, работа, совершаемая окружающей средой над телом – отрицательной. В отличие от внутренней энергии работа и теплота являются функциями процесса. Работа процесса 1-2 для 1  . (10) . (10)Графически работа равна площади под процессом в ( Количество теплоты в процессе 1-2 для 1 кг вещества определяется как аналогично для где Теплоемкостью называется отношение количества теплоты, поглощенной телом в процессе, к изменению его температуры где  
Численно удельная теплоемкость равна количеству теплоты, которое нужно подвести к единице количества вещества для нагрева на 1 градус. Массовой теплоемкостью вещества ( Объемной теплоемкостью вещества называется количество тепла, необходимое для нагрева 1 единицы объема на Мольной теплоемкостью вещества называется количество тепла, необходимое для нагрева 1 моля на Количество теплоты, отводимой или подводимой к телу, зависит еще от вида процесса. На рис. 3 количество теплоты для нагрева 1 кг вещества от Следовательно, теплоемкость вещества также будет зависеть от вида процесса и для 1 кг вещества где Для изобарного процесса Применительно к идеальному газу эти теплоемкости связаны формулой Майера Теплоемкость зависит от температуры и в ряде случаев очень значительно. Поэтому теплоемкость в соотношении (11) называется средней теплоемкостью в интервале температур Тогда количество теплоты в процессе 1-2 на основании выражения (13) 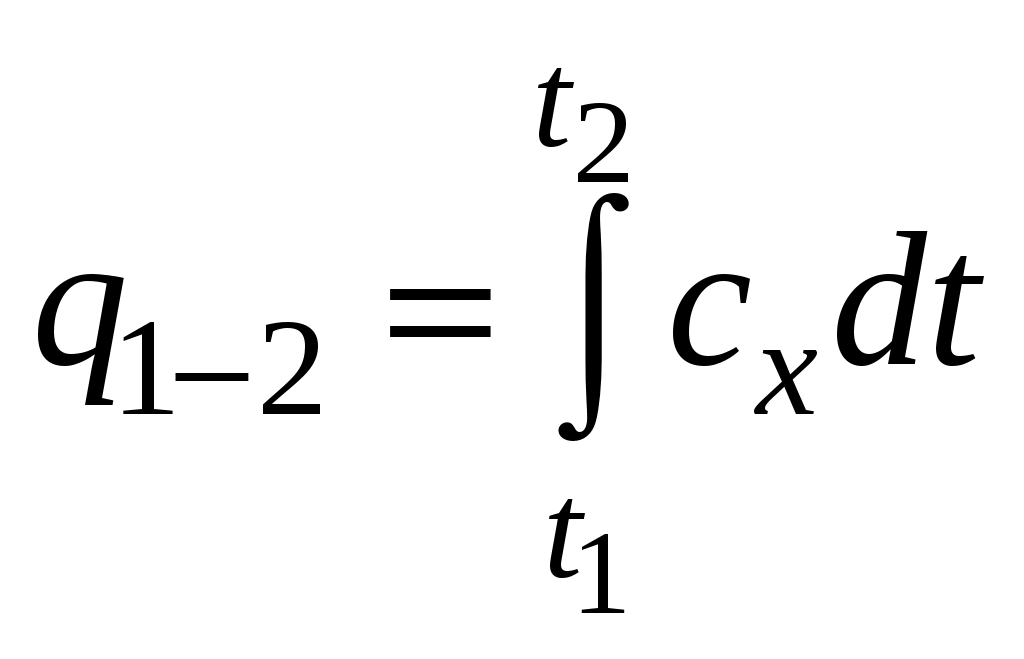 . (15) . (15)Если вместо истинной теплоемкости использовать среднюю теплоемкость в интервале температур ( В термодинамических расчетах очень важную роль играет энтальпия (теплосодержание). Энтальпией называют сумму внутренней энергии системы, и произведение давления на объем системы Как и внутренняя энергия, энтальпия является экстенсивной характеристикой. Для 1 единицы количества вещества где В соответствии с (16) удельная энтальпия Энтальпия связана с внутренней энергией, поэтому начало отсчета энтальпии связано с началом отсчета внутренней энергии. В точке начала отсчета внутренней энергии Изменение энтальпии, как и внутренней энергии, не зависит от процесса, а определяется начальными и конечными значениями В математическом анализе доказывается, что если значение криволинейного интеграла не зависит от пути интегрирования, а определяется лишь начальной и конечной точкой интегрирования, то подынтегральное выражение представляет собой полный дифференциал. Так как изменение внутренней энергии и энтальпии не зависит от процесса, а определяется лишь начальными и конечными значениями, то Индексы, стоящие у каждой частной производной, показывают, что она взята при постоянном значении величины, обозначенной индексом. Для внутренней энергии Рассмотрим изохорный процесс т.е. в изохорном процессе теплота, подводимая к системе, расходуется только на изменение внутренней энергии. Теплоемкость вещества в этом процессе в соответствии с (13) так как мы рассматриваем частный процесс при Теплоемкость На основании закона Джоуля, для идеального газа Тогда из (24) для идеального газа т.е. внутренняя энергия зависит только от температуры. Для реального газа внутренняя энергия зависит еще и от объема. Рассмотрим процесс с уравнение На основании преобразования Лежандра тогда или Сумма а так как процесс изобарный т.е. в этом процессе все подводимое тепло расходуется только на изменение энтальпии системы. Теплоемкость вещества в изобарном процессе На основании (34) теплоемкость при постоянном давлении Для идеального газа частная производная поэтому энтальпия идеального газа не зависит от давления, а так же, как и внутренняя энергия, определяется только температурой Теплота и работа 1 2 |
