Раздел
|
|
ФИО педагога
|
Михайловская З.И.
|
Дата
|
22.02.2023
|
Класс 9б,9в,9г
|
Количество присутствующих:
|
отсутствующих:
|
Тема урока
|
Минеральные удобрения Демонстрация коллекции№9 «Минеральные удобрения»
|
Цели обучения, которые достигаются на данном уроке
|
9.4.2.4 знать классификацию минеральных удобрений и питательные элементы, входящие в состав минеральных удобрений
9.4.2.5 знать месторождения соединений фосфора в Казахстане
9.4.2.6 давать оценку воздействию азотных и фосфорных удобрений на окружающую среду
|
Цель урока
|
научиться практически, распознавать минеральные удобрения, используя качественные реакции на катионы и анионы, входящие в их состав;
писать уравнения реакций в молекулярном, ионном виде
|
Критерии успеха
|
Знает кклассификацию минеральных удобрений и питательные элементы, входящие в состав минеральных удобрений
Знает месторождения соединений фосфора в Казахстане
Умеет давать оценку воздействию азотных и фосфорных удобрений на окружающую среду
|
Ход урока
|
Этапы урока
|
Деятельность учителя
|
Деятельность обучающихся
|
Оценивание
|
Ресурсы
|
Организационный этап
|
Приветствует учащихся, проверяет готовность к уроку, желает успеха. Для создания психологической атмосферы проводит игру «Расскажи мне обо мне», а также делятся на группы.
Проверка пройденного материала. С помощью приема «Карта бита» осуществляет проверку знаний учащихся:
Какие вещества входят в состав растений?
- Какие органические вещества вам известны?
- Какие неорганические вещества вам известны?
- Что необходимо для полноценного роста и развития растений?
- Как растения усваивают питательные элементы?
- Что повышают питательные элементы?
- Какое определение можно дать терминологии «удобрения»?
- Зная многообразие химических соединений, определите, на какие виды можно разделить удобрения в зависимости от происхождения?
- Как можно распределить удобрения в группы с учетом их признаков?
|
Показывают решения задач, при возникновении вопросов разбирают с учителем
|
Интерактивное обучение
|
Диалогическое обучение
Саморегулируемое обучение
Критическое мышление
|
Изучение нового материала
|
. Учащиеся работают по группам. Каждая группа получает карту с заданиями и отчетом по этим заданиям. Деление на группы мозаика
группа «Азотные удобрения».
группа «Фосфорные удобрения».
группа «Калийные удобрения».
группа «Микроудобрения»
работа с учащимися повышенной мотивации – задание 2 для групп.
В результате отчета групп на интерактивной доске в презентации заполняется общая таблица «Минеральные удобрения», которую ученики заносят в свою тетрадь.
Задача
Рассчитать, сколько удобрения и воды потребуется для приготовления 10-литрового ведра 1%-ного раствора нитрофоски для подкормки кустов черной смородины. Подумайте, в какой период развития растения применяют такую подкормку.
|
Анализируют правило 1-3
Ознакамливаются с методами решения
Разбирают совместно с учителем понятие
|
Словесная оценка учителя
Взаимооценивание
Стратегия «Стикер
|
Критическое мышление.
Саморегулируемое обучение (самонаправленность в процессе работы над заданиями).
|
Рефлексия
|
Я узнал (а) много нового.
Мне это пригодится в жизни.
На уроке было над, чем подумать.
На все возникающие у меня вопросы я получил (а) ответы.
На уроке я поработал (а) добросовестно.
|
Учащиеся подытоживают свои знания по изучаемой теме.
|
|
|
Раздел
|
|
ФИО педагога
|
Михайловская З.И.
|
Дата
|
27.02.2023-9в,9г
28.02.2023-9б
|
Класс 9б,9в,9г
|
Количество присутствующих:
|
отсутствующих:
|
Тема урока
|
Кремний и его соединения Демонстрация №10 «Модели кристаллических решеток алмаза, кремния, диоксида кремния и карбида кремния»
|
Цели обучения, которые достигаются на данном уроке
|
9.2.1.54 знать общую характеристику элементов 14 группы
9.1.4.8 объяснять, что кремний образует различные макромолекулярные структуры
9.2.1.55 знать области применения кремния и его значение в качестве полупроводника
9.1.4.9 знать тип кристаллической решетки и вид химической связи кремния, диоксида и карбида кремния
9.2.1.56 знать основные химические свойства кремния и его соединений, составлять уравнения реакций
|
Цель урока
|
сформировать представление о растворении как физико-химического процесса, классификации растворов, изучить зависимость растворимости веществ от различных условий.
|
Критерии успеха
|
Знает общую характеристику элементов 14 группы
Умеет объяснять, что кремний образует различные макромолекулярные структуры
Знает области применения кремния и его значение в качестве полупроводника
|
Ход урока
|
Этапы урока
|
Деятельность учителя
|
Деятельность обучающихся
|
Оценивание
|
Ресурсы
|
|
Приветствие. Отметка отсутствующих. Активизация класса на усвоение новой темы.
Задание: определите, атомы каких элементов представлены на рисунке:
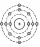 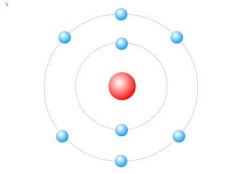 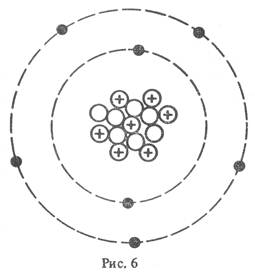
Учащимся предлагается вспомнить, какие классификации химических элементов существовали до периодической таблицы Д.И. Менделеева.
Задание: определите третий элемент в данных триадах. Каким принципом Вы руководствовались?
Li 6.9
|
|
K 39.1
|
Ca 40.0
|
|
Ba 137.3
|
P 31.0
|
|
Sb 121.8
|
Cl 35.5
|
|
I 126.9
|
|
Учащиеся рассаживаются по местам. Проверяют наличие принадлежностей.
|
|
видеоролик
Картинки-пазлы
|
Изучение нового материала
|
Задание для группам
1 группа.
Растворы имеют огромное значение в природе, технике, быту, жизни растений, животных, людей. Растения усваивают питательные вещества, необходимые для их роста и развития в виде растворов из почвы с помощью корневых волосков. Усвоение пищи человеком и животными тоже связано с переводом питательных веществ в раствор.
Все природные воды, а также важнейшие физиологические жидкости-
кровь, плазма - являются растворами. Крови в нашем организме содержится около 5 литров, что составляет 1/10части всей жидкости.
Основная её функция – транспортная - перенос кислорода и питательных веществ по всему организму. Многие реакции также протекают в растворах.
-Что же такое растворы? Из чего они состоят?
(Беседа по плакату «Растворы»)
Растворы - однородные системы, состоящие из частиц растворённого вещества, растворителя.
РАСТВОР = РАСТВОРИТЕЛЬ + РАСТВОРЁННОЕ ВЕЩЕСТВО.
(ВОДА) (ТВЁРДОЕ ВЕЩЕСТВО, ГАЗ,
ЖИДКОСТЬ.)
Перед вами представлены различные растворы (минеральная вода, стакан с водопроводной водой, йодная настойка, нашатырный спирт, туалетная вода, лекарственные препараты).
-Какие ещё вещества, кроме воды, могут выступать в качестве растворителей?
(Спирт, ацетон, бензин).
Все эти примеры жидких растворов.
Существуют растворы и газообразные (воздух), и твёрдые (золотые украшения представляют собой растворы, например, золотые изделия
583 - ой пробы содержат: 58,3% золота, 23,5% меди, 12,2% никеля, 6% цинка; 750 – ой пробы содержат 75% золота, 15% меди, 7,5% никеля, 2,5% цинка). А также всевозможные сплавы.
Но любой раствор состоит из растворённого вещества (одного или нескольких) и растворителя.
Сделайте вывод: какие бывают растворы? (Жидкие, газообразные, твёрдые)
Мы будем рассматривать только водные растворы:
РАСТВОР= Н2О + РАСТВОРЁННОЕ ВЕЩЕСТВО.
(Сообщение ученика о природных водных растворах – Приложение №1).
Проблемный вопрос: А ещё, какие бывают растворы? Работа с учебником - стр.189-190
 насыщенные насыщенные
  РАСТВОРЫ ненасыщенные РАСТВОРЫ ненасыщенные
пересыщенные.
2 группа
Проблемный вопрос:
- Как вы думаете, к каким явлениям - физическим или химическим - относится процесс растворения?
ФИЗИЧЕСКОЕ ЯВЛЕНИЕ
|
ХИМИЧЕСКОЕ ЯВЛЕНИЕ
|
1. Демонстрация растворения КМпО4 в воде.
- За счёт кого процесса происходит
растворение? (диффузии).
Вещество из области более высокой
его концентрации переходит в область
более низкой концентрации.
Процесс завершается выравниванием концентрации.
- К каким явлениям относится диффузия?
(физическим).
- Какие выводы можно сделать по данному эксперименту?
|
2) Мы уже вспоминали о признаках химических реакций. Подумайте, можем ли мы пронаблюдать хотя бы один из этих признаков при растворении? (выдвижение версий).
Демонстрация растворения
Н2SО4(конц.) и NН4NО3 в воде.
(Наблюдается выделение и поглощение теплоты). Как называются подобные реакции (экзотермические и эндотермические).
3) Демонстрация растворения безводных СuСl2 или СuSО4 в воде. (Происходит изменение цвета).
- Какие выводы можно сделать по данным экспериментам?
|
Выводы:
1.Растворение результат диффузии.
2.Растворы - это однородные
смеси.
Значит, растворение - это физическое явление.
|
Выводы:
1.Растворение- это химическое взаимодействие растворённого вещества с водой, называемое гидратацией.
2.Растворы - химические соединения.
Значит, растворение - это химическое явление.
|
Растворение, как и любой химический процесс, можно выразить уравнением реакции. Поэтому более правильно:
РАСТВОР = Н2О + Р.В. + ГИДРАТЫ (продукты взаимодействия Н2О с
растворёнными веществами).
- Ребята, сделайте вывод, к каким же явлениям относится растворение?
Растворение- это физико - химический процесс.
3 группа.
Как вы уже знаете, солёность морской и океанской воды равна 35% . Эта вода непригодна для нужд человека. Пресной же водой, пригодной для питья человеку и животным, считается вода с солёностью менее 1%.
(Стакан с водопроводной водой).
- Какие вещества могут быть растворены в этой воде?
(различные соли, О2, СО2 и другие газы и т. д.)
Рассказ по таблице « Растворы».
- Подберите характеристику воды как растворителю. Это какой растворитель? (Универсальный).
Н2О - универсальный растворитель + твёрдые вещества (соль, сахар…)
+ жидкости (спирт, кислоты…)
+ газы (О2, СО2, аммиак, Н2).
( Демонстрация опытов по растворимости различных веществ).
- Как узнать о растворимости различных веществ в воде? Какие вещества растворимы в воде, а какие – нет?
(По таблице растворимости).
Таблица 9 «Растворимость некоторых солей в воде» стр191, «Таблица растворимости».
- Что можно сказать о растворимости веществ в воде?
( Растворимость веществ в воде разная).
- А что вы можете сказать о веществах, практически нерастворимых в воде? (Практически нерастворимых веществ в воде нет).
Сообщение ученика о практически нерастворимых веществах – Приложение №2.
Вы знаете, что стекло в воде не растворяется, и спокойно пьёте воду из стеклянного стакана. Растолчём в ступке кусок стекла, поместим в пробирку с водой, прибавим несколько капель фенолфталеина. Появление окраски укажет, что некоторое количество вещества перешло в раствор.
(Если окраска сразу не появится, то проводим нагревание).
Обычно мы этого просто не замечаем из-за очень малой величины растворимости стекла в воде и медленности процесса растворения.
Теперь ответьте вопросы:
1.Зачем в опыте по растворимости стекла, мы его измельчали?
2.Зачем нагревали вещества?
Задача 1. Вычислите массовую долю раствора в %, который получится, если 50 г. вещества растворили в 450 г. воды.
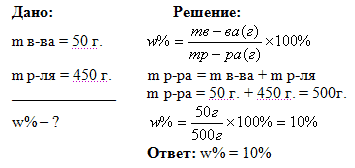
Задача 2. Вычислите массу воды и массу соли, которые необходимо взять, чтобы приготовить 300г раствора с массовой долей 15%.

Индвидуальное работа
Задача 1. Для того, чтобы обработать цветы, Винни-Пуху нужно приготовить 2 кг.2%-ного раствора нитрата натрия. Помогите ему вычислить массу воды и массу соли, которые ему нужно взять?
Задача 2. Героям этого мультфильма нужно обработать музыкальные инструменты некоторым 20%-ным секретным раствором. У них есть 700 г. этого раствора с концентрацией 45%. Сколько воды им нужно долить, чтобы получить то, что нужно?
Задача 3. Выполните задание тетушки Совы. Вычислите массовую долю раствора, который получится, если 120 г. соли растворить в 1,4 кг. воды.
Задача 4. Знахарь смешал два раствора: 150 г. 25% -ного раствора и 400 г. 42%-ного раствора. Помогите ему вычислить массовую долю полученного раствора.
Задача 5. Машенька для бульона взяла 700 г. воды, добавила 1,5 чайных ложки соли (15 г.), попробовала – раствор показался ей слишком соленым, и она добавила 500 г. воды. Раствор с какой массовой долей соли получился у Машеньки в итоге?
Задача 6. Мыши помогли Золушке приготовить волшебный раствор. Они взяли два раствора: 200 г. 10%-ного раствора секретного вещества и 250 г. 25%-ного раствора этого же вещества. Затем они добавили к полученному раствору 30 г вещества. Сколько воды нужно долить Золушке, чтобы массовая доля раствора была равна 15%?
|
Устно отвечают на вопросы, с объяснением.
Находит ошибки в примерах
Каждая группа читает свой параграф, выбирает и предоставляет ключевую информацию из изученного материала.
|
Стратегия
«Верно - не верно»
Словесная оценка учителя.
Взаимооценивание
Стратегия «Стикер»
|
|
Подведение итогов урока (5 мин)
|
Беседа. Рефлексия. «Рефлексивный ринг»
Сегодня я узнал… Я научился…
Меня удивило…
У меня получилось… Было трудно…
Я смог … Я понял, что…
Я теперь могу…
Меня удивило… Мне захотелось…
|
Ученики показывают умение обосновывать свое понимание
Записывают д.з. в дневники
|
Самооценивание
|
Рефлексивный лист, стикеры
| |
 Скачать 106.9 Kb.
Скачать 106.9 Kb.