Обратимые и необратимые реакции. Обратимые и необратимые реакции. Химическое равновесие. Смещение равновесия. Темы кодификатора
 Скачать 49.1 Kb. Скачать 49.1 Kb.
|
|
Обратимые и необратимые реакции. Химическое равновесие. Смещение равновесия. Темы кодификатора: обратимые и необратимые реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. По возможности протекания обратной реакции химические реакции делят на обратимые и необратимые. Обратимые химические реакции – это реакции, продукты которых при данных условиях могут взаимодействовать друг с другом. Например, синтез аммиака — реакция обратимая: N2 + 3H2 = 2NH3 Процесс протекает при высокой температуре, под давлением и в присутствии катализатора (железо). Такие процессы, как правило, обратимые. Необратимые реакции – это реакции, продукты которых при данных условиях взаимодействовать друг с другом не могут. Например, реакции горения или реакции, протекающие со взрывом — чаще всего, необратимые. Горение углерода протекает необратимо: C + O2 = CO2 Более подробно про классификацию химических реакций можно прочитать . Вероятность взаимодействия продуктов зависит от условий проведения процесса. Так, если система открытая, т.е. обменивается с окружающей средой и веществом, и энергией, то химические реакции, в которых, например, образуются газы, будут необратимыми. Например, при прокаливании твердого гидрокарбоната натрия: 2NaHCO3 → Na2CO3 + CO2↑+ H2O выделяется газообразный углекислый газ и улетучиватся из зоны проведения реакции. Следовательно, такая реакция будет необратимой при данных условиях. Если же рассмотреть замкнутую систему, которая не может обмениваться веществом с окружающей средой (например, закрытый ящик, в котором происходит реакция), то углекислый газ не сможет улететь из зоны проведения реакции, и будет взаимодействовать с водой и карбонатом натрия, то реакция будет обратимой при данных условиях: 2NaHCO3⇔ Na2CO3 + CO2 + H2O Рассмотрим обратимые реакции. Пусть обратимая реакция протекает по схеме: aA + bB ⇔ cC + dD Скорость прямой реакции по закону действующих масс определяется выражением: v1=k1·CAa·CBb Скорость обратной реакции: v2=k2·CСс·CDd Здесь k1 и k2 – константы скорости прямой и обратной реакции соответственно, СA, CB, CC, CD – концентрации веществ А, В, С и D соответственно. Если в начальный момент реакции в системе нет веществ C и D, то сталкиваются и взаимодействуют преимущественно частицы A и B, и протекает преимущественно прямая реакция. Постепенно концентрация частиц C и D также начнет повышаться, следовательно, скорость обратной реакции будет увеличиваться. В какой-то момент скорость прямой реакции станет равна скорости обратной реакции. Это состояние и называют химическим равновесием.  Таким образом, химическое равновесие — это такое состояние системы, при котором скорости прямой и обратной реакции равны. Так как скорости прямой и обратной реакции равны, скорость образования реагентов равна скорости их расходования, и текущие концентрации веществ не изменяются. Такие концентрации называют равновесными. 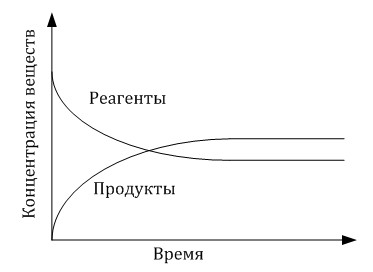 Обратите внимание, при равновесии протекает и прямая, и обратная реакции, то есть реагенты взаимодействуют друг с другом, но и продукты взаимодействуют друг с другом с такой же скоростью. При этом внешние факторы могут воздействовать и смещать химическое равновесие в ту или иную сторону. Поэтому химическое равновесие называют подвижным, или динамическим. Исследования в области подвижного равновесия начались еще в XIX веке. В трудах Анри Ле-Шателье были заложены основы теории, которые позже обобщил ученый Карл Браун. Принцип подвижного равновесия, или принцип Ле-Шателье-Брауна, гласит: Если на систему, находящуюся в состоянии равновесия, воздействовать внешним фактором, который изменяет какое-либо из условий равновесия, то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия. Иными словами: при внешнем воздействии на систему равновесие сместится так, чтобы компенсировать это внешнее воздействие. Этот принцип, что очень важно, работает для любых равновесных явлений (не только химических реакций). Однако мы сейчас рассмотрим его применительно к химическим взаимодействиям. В случае химических реакций внешнее воздействие приводит к изменению равновесных концентраций веществ. На химические реакции в состоянии равновесия могут воздействовать три основных фактора – температура, давление и концентрации реагентов или продуктов. 1. Как известно, химические реакции сопровождаются тепловым эффектом. Если прямая реакция идет с выделением теплоты (экзотермическая, или +Q), то обратная — с поглощением теплоты (эндотермическая, или -Q), и наоборот. Если повышать температуру в системе, равновесие сместится так, чтобы это повышение компенсировать. Логично, что при экзотермической реакции повышение температуры компенсировать не получится. Таким образом, при повышении температуры равновесие в системе смещается в сторону поглощения теплоты, т.е. в сторону эндотермических реакций (-Q); при понижении температуры — в сторону экзотермической реакции (+Q). 2. В случае равновесных реакций, когда хотя бы одно из веществ находится в газовой фазе, на равновесие также существенно влияет изменение давления в системе. При повышении давления химическая система пытается компенсировать это воздействие, и увеличивает скорость реакции, в которой количество газообразных веществ уменьшается. При понижении давления система увеличивает скорость реакции, в которой образуется больше молекул газообразных веществ. Таким образом: при увеличении давления равновесие смещается в сторону уменьшения числа молекул газов, при уменьшении давления — в сторону увеличения числа молекул газов. Обратите внимание! На системы, где число молекул газов-реагентов и продуктов одинаково, давление не оказывает воздействие! Также изменение давления практически не влияет на равновесие в растворах, т.е. на реакции, где газов нет. 3.Также на равновесие в химических системах влияет изменение концентрацииреагирующих веществ и продуктов. При повышении концентрации реагентов система пытается их израсходовать, и увеличивает скорость прямой реакции. При понижении концентрации реагентов система пытается их наработать, и увеличивается скорость обратной реакции. При повышении концентрации продуктов система пытается их также израсходовать, и увеличивает скорость обратной реакции. При понижении концентрации продуктов химическая система увеличивает скорость их образования, т.е. скорость прямой реакции. Если в химической системе увеличивается скорость прямой реакции, мы говорим, что равновесие сместилось вправо, в сторону образования продуктов и расходования реагентов. Если увеличивается скорость обратной реакции, мы говорим, что равновесие сместилось влево, в сторону расходования продуктов и увеличения концентрации реагентов. Например, в реакции синтеза аммиака: N2 + 3H2 = 2NH3 + Q повышение давления приводит к увеличению скорости реакции, в которой образуется меньшее число молекул газов, т.е. прямой реакции (число молекул газов-реагентов равно 4, число молекул газов в продуктах равно 2). При повышении давления равновесие смещается вправо, в сторону продуктов. При повышении температуры равновесие сместится в сторону эндотермической реакции, т.е. влево, в сторону реагентов. Увеличение концентрации азота или водорода сместит равновесие в сторону их расходования, т.е. вправо, в сторону продуктов. Катализатор не влияет на равновесие, т.к. ускоряет и прямую, и обратную реакции. Государственное бюджетное профессиональное образовательное учреждение «Пожарно – спасательный колледж» РЕФЕРАТ на тему : «Обратимость химических реакций» Выполнил: студент 1 курса ЗЧС 1/1 Шаухалов Дж.А. Проверила : преподаватель химии Часыгова Х.Б. 2021 год. |
