производство органических соединений. производство.. Описание производства
 Скачать 461.14 Kb. Скачать 461.14 Kb.
|
Описание производства Промышленность органического синтеза каждым годом увеличивает выпуск и ассортимент химических продуктов. Среди них можно указать разнообразные мономеры и на их основе синтетические смолы, каучуки, волокна, пластмассы, клеи, красители и большое количество различных лакокрасочных и смазочных материалов, растворителей, поверхностноактивных веществ, ядохимикатов, флотореагентов, антитфризов и антидетонаторов, взрывчатых и лекарственных препаратов, фотореактивов, душистых соединений и т.п. В синтезах сложных органических соединений различают исходные вещества; промежуточные продукты (полупродукты) и готовый продукт. Исходные вещества — простые углеводороды: метан, этилен. пропилен, бутилен, ацетилен, бензол толуол и др., являются основным сырьем органического синтеза, получаются при химической переработке газообразных, жидких и твердых видов топлива. Раньше основным источником сырья органического синтеза была смола коксования и полукоксования. Широко использовалось сырье растительного и животного происхождения. В последние годы преобладающее значение приобрели жидкие углеводороды нефти, природный и попутные газы, а также газы нефтепереработки. В настоящее время многие из перечисленных исходных веществ выпускаются десятками и сотнями тысяч тонн. Полупродукты: окись этилена, ацетальдегид, фенол, нитробензол и другие — образуются в результате предварительной химической переработки исходных веществ и в свою очередь могут служить сырьем для получения более сложных органических веществ (пластмасс, волокон, красителей, лекарственных препаратов, физиологически активных веществ и д.р.). Связь исходного сырья готовым продуктом можно представить схемой  Например, продукт нефтехимической и коксо-бензольной промышленности бензол служит хорошим растворителем жиров, смол, каучука, серы и других соединений. В то же время он представляет собой исходное сырье для получения нитробензола, анилина, хлорбензола, фенола, этилбензола, изопропилбензола стирола, ДДТ, малеинового ангидрида, фенилэтилового спирта, моносульфокислоты и других химических продуктов и полупродуктов, используемых для изготовления красителей синтетического каучука, пластмасс, лаков, инсектицидов, фармацевтических и дезинфицирующих препаратов, взрывчатых веществ и др. В настоящее время промышленность органического синтеза пользует следующие основные виды сырья: природные и попутные газы; газообразные и жидкие углеводороды получаемые при перегонке нефти, крекинге и пиролизе нефтепродуктов, твердые парафиновые углеводороды и тяжелые нефтяные остатки; коксовый и сланцевый газы; смолу коксования, а также сланцевую и древесную смолы и торфяной деготь. Кроме того, в органической технологии в больших количествах используются и неорганические соединения: кислоты, щелочи, сода, хлор и т.п., без которых невозможно осуществление многих процессов. Как правило, любое сырье необходимо предварительно очистить от влаги, механических примесей, сернистых соединений и других примесей и разделить, выделив индивидуальные углеводороды. Так получают очищенное сырье, из которого дальнейшей переработкой можно получить те или иные полупродукты и чистые продукты. ПРОЦЕССЫ ОРГАНИЧЕСКОГО СИНТЕЗА Способы переработки любого вида сырья определяются характером продуктов, которые предполагается получить, а также составом и свойствами исходных углеводородов. Для производства продуктов органического синтеза используются типичные реакции органической химии: галогенирование, сульфирование, окисление и восстановление, гидрирование и дегидрирование, гидратация и дегидратация, нитрование, алкилирование, циклизация, изомеризация, конденсация, полимеризация, этерификация и т. п. Промышленность органического синтеза базируется в основном на реакциях синтеза т. е. получение сложных веществ из простых, но в производствах органического синтеза используются и реакции разложения. Для выделения газообразных углеводородов применяют методы: сжатие (компрессия) с охлаждением, абсорбционно-десорбционный и адсорбционно-десорбционный. Жидкости чаще всего разделяют перегонкой и ректификацией. Очень часто в промышленности практикуется комбинирование двух или более перечисленных методов. Используя разнообразные методы разделения исходных материалов, а также наиболее современные процессы их переработки, получают важнейшие соединения, являющиеся непосредственным сырьем органического синтеза: синтез-газ (смесь СО и Н2); насыщенные алифатические углеводороды (от метана до пентанов); индивидуальные моноолефины (от С2 и выше) и их смеси; диолефины - бутадиен, изопрен и др.) ацетилен; ароматические углеводороды - бензол, толуол, ксилолы и пр. СИНТЕЗ МЕТИЛОВОГО СПИРТА Метиловый спирт (метанол) — важное соединение для получения, главным образом, формальдегида а также - диметилсульфата, диметилтерефталата метилацетата, диметилформамида, аитидетонационных смесей (тетраметилсвинец), ингибиторов, антифризов, метиламина, метилового эфира акриловой кислоты, лаков, красителей и других продуктов. В чистом виде применяется в качестве растворителя и может быть использован как высокооктановая добавка к моторному топливу. Производство метилового спирта. В настоящее время метиловый спирт преимущественно получают из окиси углерода и водорода при соотношении СО : Н2=1 : 2 по реакции, которая обратима и протекает с выделением тепла и уменьшением объема. В связи с этим для сдвига равновесия реакции слева направо необходимо понижать температуру и повышать давление. Вместе с тем при обычных температурах синтез метанола протекает крайне медленно. Поэтому для его ускорения процесс проводят при высоких температурах (около 400° С) в присутствии цинк-хромового катализатора. Давление в промышленных установках поддерживают около 250 атм. Наряду с образованием метанола в процессе протекают параллельные и последовательные реакции:  Селективность процесса зависит от температуры, давления и свойств катализатора. Парогазовая смесь, выходящая из контактного аппарата, содержит от 5 до 20% метанола- После конденсации из нее метанола и других продуктов для увеличения степени использования сырья непрореагировавшие газы возвращаются в контактный аппарат, т. е. процесс проводится по циклической схеме. Кроме давления, температуры и катализатора на степень контактирования влияет также объемная скорость газовой смеси. С увеличением объемной скорости степень превращения за один проход газа через катализатор уменьшается. Однако при этом производительность катализатора возрастает. Синтез метанола на заводах проводят при объемных скоростях 10 000-30 000 ч-1. Чтобы сместить равновесие в сторону образования метанола, процесс проводят с избытком водорода против стехиометрического при соотношении СО : Н2, равном 1 : 4. 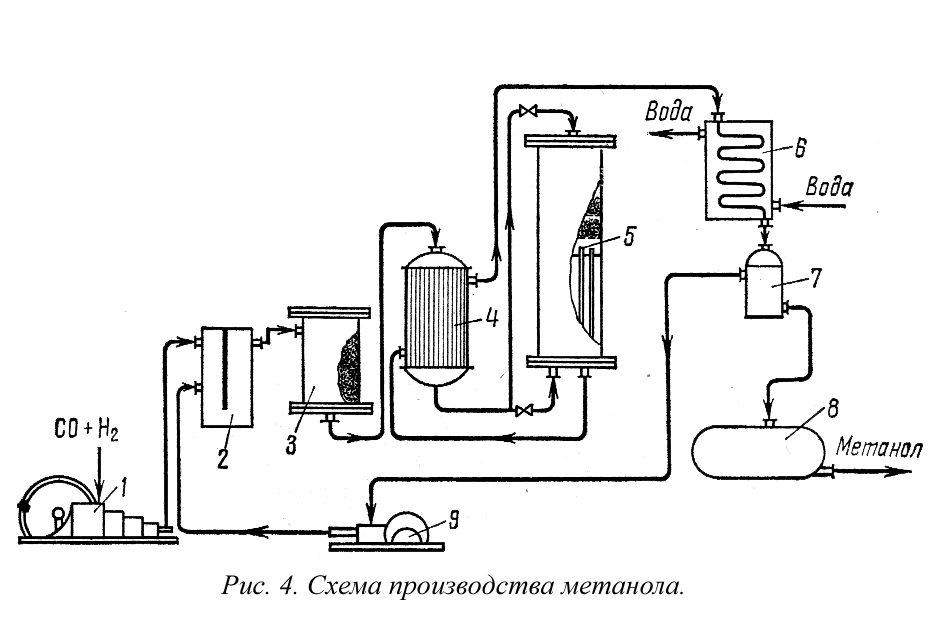 Схема синтеза метилового спирта (рис. 4) аналогична технологической схеме синтеза аммиака. Смесь окиси углерода и водорода очищают от механических примесей, от H2S и других соединений серы, отравляющих катализатор. Очищенный газ сжимается в многоступенчатом компрессоре 1 до давления 250 am (рис. 4). После третьей ступени компрессора газ очищается от двуокиси углерода промывкой водой, дожимается далее до рабочего давления синтеза и смешивается с непрореагировавшими газами в смесителе 2. В фильтре 3, заполненном активированным углем, газовая смесь очищается от пентакарбонила железа Fe(С0)3, образующегося при взаимодействии окиси углерода со стальной аппаратурой при высоких давлениях, и от машинного масла. Пентакарбонил железа в колонне синтеза разлагается; на катализаторе отлагается дисперсное железо, ускоряющее побочные реакции образования метана. Далее газ поступает в теплообменник 4, где он в трубках нагревается до 320° С горячими продуктами синтеза, проходящими в межтрубном пространстве аппарата. Нагретый газ поступает в колонну синтеза 5, где в слое катализатора образуется метанол. Колонна синтеза метанола представляет собой контактный аппарат полочного типа. В верхней части колонны находится катализаторная коробка с полками для катализатора и электроподогревателем для подогрева газа в период пуска, в нижней части - теплообменник. Основной поток газовой смеси, нагретый в теплообменнике 4, вводится в верхнюю часть колонны 5 и поступает в слой катализатора. Продукты реакции охлаждаются в трубках теплообменника и выводятся через нижнюю часть колонны. Продукты синтеза, выходящие из колонны, охлаждаются до 100° С в теплообменнике 4, а затем в холодильнике-конденсаторе 6 до 25-30° С, где пары метанола конденсируются. Образовавшийся жидкий метанол-сырец отделяется от непрореагировавших веществ в сепараторе 7 и собирается в сборнике 8, откуда направляется на ректификацию. Непрореагировавшие продукты, выходящие из сепаратора 7, дожимаются до рабочего давления 250 атм в циркуляционном компрессоре 9 и поступают в смеситель 2. Метанол-сырец подвергается многократной ректификации, которая в сочетании со специальной очисткой позволяет получить чистый продукт. Метанол получается также при сухой перегонке древесины и в процессе неполного окисления метана. Метиловый спирт используется как сырье для получения формальдегида, метилового эфира акриловой кислоты, антидетонационных смесей, лаков, красителей и других продуктов, а также в качестве растворителя, добавки к моторному топливу. Метиловый спирт - сильный яд с резко выраженным кумулятивным действием. При попадании внутрь он вызывает тяжелое поражение зрения и смерть. Этанол Этиловый спирт находит широкое применение в народном хозяйстве в качестве растворителя, также применяется в производстве дивинила, в пищевой и медицинской промышленности, в качестве горючего для ракетных двигателей, антифриза и т.д., является важным промежуточным продуктом органического синтеза (в производстве сложных эфиров, целлулоида, искусственного шелка, ацетальдегида, уксусной кислоты, хлороформа, хлораля, диэтилового эфира и других продуктов). Таким образом, этиловый спирт относится к числу многотоннажных продуктов основного органического синтеза, мировое производство этилового спирта составляет свыше 2,5 млн. т/г (по объему производства занимает первое место в мире среди всех органических продуктов). В качестве исходного сырья в производстве этилового спирта используется этилен. В настоящее время основным способом его получения является пиролиз (высокотемпературный крекинг) углеводородов. Пиролизу подвергают фракции прямой перегонки нефти, состоящие алканов, циклоалканов, аренов, природные и попутные нефтяные газы, содержащие алканы. Этилен образуется в результате реакций распада тяжелых алканов и дегидрирования низкомолекулярных алканов. Потенциальный выход этилена зависит от вида исходного сырья. Виды сырья, используемые в мировом производстве этилена, и их доля в общем балансе производства следующие:
Лучшим сырьем являются парафины, поскольку с повышением содержания водорода в исходных углеводородах выход алкенов возрастает. До недавнего времени производство этилового спирта основывалось на пищевом сырье – сбраживание крахмала из некоторых зерновых культур и картофеля с помощью ферментов, вырабатываемых дрожжевыми грибками. Этот способ сохранился и до сих пор, но он связан с большими затратами пищевого сырья и не может удовлетворить промышленность. Другой метод, также основанный на переработке растительного сырья, заключается в переработке древесины (гидролизный спирт). Синтетический этиловый спирт получают гидратацией этилена. Гидратация этилена осуществляется двумя методами: при помощи серной кислоты (сернокислая гидратация) и непосредственным взаимодействием этилена с водяным паром в присутствии катализатора (парофазная каталитическая гидратация). Сернокислотный способ, открытый А. М. Бутлеровым, получил промышленное осуществление только в послевоенные годы. Он состоит из следующих четырех стадий: 1) абсорбция этилена серной кислотой с образованием сернокислых эфиров; 2) гидролиз эфиров; 3) выделение спирта и его ректификация; 4) концентрирование серной кислоты. Взаимодействие меду этиленом серной кислотой состоит из двух этапов: первый — физическое растворение этилена в серной кислоте и второй — гомогенное взаимодействие обоих, компонентов (Ж-Ж) с образованием алкилсульфатов по уравнениям: C2H4 + H2SO4 = C2H5OSO3H (а) C2H5OSO3H + C2H4 = (C2H5O)2SO2 (б) Диэтилсульфат в условиях процесса может взаимодействовать с серной кислотой, образуя этилсульфат: (C2H5O)2SO2 + H2SO4 = 2C2H5OSO3H (в) Этилен поглощается серной кислотой медленнее, чем другие газообразные олефины (например в сотни раз медленнее, чем изобутилен). По мере образования этилсерной кислоты (этилсульфата), в которой этилен растворяется лучше, скорость поглощения этилена увеличивается. Но в связи с тем, что в то же время уменьшается концентрация серной кислоты, общая скорость реакции снижается. Нужная степень насыщения до 0,6 моля С2Н4 на 1 моль Н2SО4 в верхней части абсорбционной колонны достигается для 97,5% -ной кислоты за 1ч 15 мин, т. е. почти вдвое быстрее, чем для 95% -ной кислоты (2ч 15 мин). Следовательно, целесообразно применять 97-98%-ную кислоту. Оптимальная температура процесса 65-75 °С. С дальнейшим повышением температуры уменьшается количество образующейся этилсерной кислоты. С повышением давления возрастают скорость абсорбции и степень насыщения серной кислоты этиленом. Большое значение для процесса имеет интенсивность перемешивая. В производстве применяют барботажные колонны, обеспечивающие более сильное перемешивание, чем насадочные башни. В ходе второй стадии идет гидролиз этил- и диэтилсульфата по уравнениям: C2H5OSO3H + Н2О = C2H5OН + H2SO4 (г) (C2H5O)2SO2 + 2Н2О = 2C2H5OН + H2SO4 (д) Кроме основных реакций (г) и (д) идет образование диэтилового эфира: (C2H5O)2SO2 + C2H5OН = C2H5OC2H5 + C2H5OSO3H (е) (C2H5O)2SO2 + Н2О = C2H5OC2H5 + H2SO4 (ж) ацетальдегида, а также наблюдается полимеризация этилена. Для уменьшения выхода диэтилового эфир гидролиз ведут по возможности быстрее, сразу же отгоняя образующийся спирт с тем, чтобы его концентрация в растворе была небольшой.  Рис. 14.4. Принципиальная схема производства этилового спирта сернокислотной гидратацией этилена: 1 – абсорбер; 2 – теплообменник; 3 – гидролизер; 4 – отпарная колонна; 5 – нейтрализационная колонна. Принципиальная технологическая схема производства спирта сернокислотной гидратацей этилена приведена на рис. 14.4. Этиленовая фракция нефтепереработки, содержашая 60-75% этилена поступает в нижнюю часть тарельчатого абсорбера (около 20 тарелок с колпачками), футерованного кислотоупорными плитками, и барботирует через слой кислоты, имеющейся на каждой тарелке. Концентрированная кислота (97-98%-ная Н2SО4) подается для орошения в верхнюю часть абсорбера. При абсорбции этилена серной кислотой выделяется большое количество тепла (121 кДж на 1 моль этилена), которое непрерывно отводится водяными холодильниками, расположенными над каждой тарелкой таким образом, чтобы температура в абсорбере не превышала 80 °С. Непоглощенные газы, в основном этан и другие примеси, содержащие не более 2-5% этилена, промываются водой и 10%-ным раствором щелочи в специальных скрубберах. Сернокислотный раствор из абсорбера направляется в гидролизер с керамической насадкой, где разбавляется водой (до концентрации 50% Н2SО4). Температура в гидролизере поддерживается, в пределах 100-110 °С. Время гидролиза 30 мин. Выделившиеся растворенные газы, содержащие небольшое количество паров диэтилового эфира, выводятся из верхней части гидролизера, промываются и нейтрализуются. В растворе, выходящем из гидролизера, содержатся этиловый спирт, вода, 43-50%-ная серная кислота, диэтиловый эфир, растворенные газы и непрогидролизовавшиеся этилсульфаты. Вся эта смесь поступает в отпарную колонну (1,5?105 Н/м2, 95-125 °С), где происходит окончаельный гидролиз. Выходящая парогазовая смесь далее направляется на промывку, нейтрализацию и конденсацию. Полученный спирт-сырец поступает затем на ректификацию. Слабая серная кислота отводится на очистку от смолистых примесей и после концентрирования и добавки олеума снова подается в абсорбер. Для получения 1 т спирта на абсорбцию идет около 2 т концентрированной серной кислоты, а затем приходится упаривать уже 4 т кислоты. Такой кислотооборот осложняет производство в вызывает значительные трудности из-за сильной коррозии и тяжелых условий труда. По сернокислотному методу из 1 т этилена вырабатывается 1,2 т спирта-ректификата и около 100 кг этилового эфира. Превращение этилена в спирт достигает 90%. Технологическая схема прямой гидратации этилена (рис. 14.5) состоит из нескольких непрерывно протекающих операций: 1) приготовления исходной парогазовой смеси, 2) гидратации этилена, 3) нейтрализации паров продуктов, образующихся в результате реакции, 4) рекуперации тепла рециркулирующих потоков и 5) очистки циркулирующего газа.  Рис. 14.5. Принципиальная схема установки для производства этилового спирта каталитической гидратацией этилена в паровой фазе: 1 — трубчатый теплообменник 2 — печь; 3 — реактор; 4 — сборник; 5 — холодильник; 6 — промывная колонна с насадкой. Гидратация этилена проводится в контактном аппарате, который для защиты от коррозии выкладывается красной медью. Этилен, сжатый компрессором, смешивается с водяными парами и вся смесь направляется в теплообменник и затем в печь, откуда парогазовая смесь при 280 °С поступает в гидрататор, который заполнен твердым катализатором на высоту 8,5 м. Время контакта 18-20 с. Необходимую для процесса температуру исходной смеси можно получить смешением этилена с перегретым паром высокого давления (около 70?105 Н/м2). По режиму работы гидрататор приближается к адиабатическому реактору идеального вытеснения. Образовавшаяся в результате реакции смесь продуктов последовательно отдает тепло в теплообменнике, конденсируется водный раствор спирта в емкости и затем окончательно охлаждается в холодильнике. Полная отмывка газа от паров спирта идет в скруббере. Непрореагировавший этилен после сжатия вновь направляется в гидрататор, а спирт-сырец подвергается ректификации. На 1 т этилового спирта расходуется 0,685 т этилена, 5,6 кг фосфорной кислоты, 2 кг носителя и 16 кг едкого натра. Срок службы катализатора равен примерно 600 ч. Введением распыленной фосфорной кислоты в реактор в ходе процесса можно продлить службу катализатора, после чего его нужно заменять, так как на поверхности осаждаются смолистые соединения. Парофазная каталитическая гидратация этилена является более перспективной, чем сернокислотная. Производство уксусной кислоты с давних пор осуществляется сухой перегонкой дерева, брожением этилового спирта и с начала ХХ в. синтетически: окислением ацетальдегида или гидратацией кетена. При окислении ацетальдегида кислородом воздуха в присутствии солей марганца сначала образуется надуксусная кислота: СН3-СНО + О2 → СН3-СОООН которая при взаимодействии со второй молекулой ацетальдегида дает две молекулы уксусной кислоты: СН3-СОООН + СН3-СНО = 2СН3-СООН Накопление надуксусной кислоты в реакционном аппарате может вызвать взрыв. Для предотвращения этого разбавляют парогазовую смесь азотом и поддерживают температуру в пределах 60—75 °С. Применяемые в качестве катализатора соли марганца способствуют восстановлению надуксусной кислоты в уксусную. Процесс осуществляется в барботажной окислительной колонне подобно той, которая используется для получения ацетальдегида. Производство состоит из трех стадий: 1) окисление ацетальдегида; 2) абсорбция ацетальдегида из отходящих газов и 3) выделение ацетальдегида из уксусной кислоты. В нижнюю часть колонны (рис. 14.9) вводится раствор ацетальдегида и катализатор раствор ацетата марганца. Реакционная смесь занимает всю колонну, за исключением верхней части, в которую во избежание взрыва паров подается азот. В разных местах колонны по ее высоте вводится кислород. Окисление ведется при 60-70 °С и давлении 2?105 Н/м2. Выделяющееся тепло отводится циркуляцией жидкости и охлаждением колонны водяной рубашкой или водяными эмеевиками. Образующаяся уксусная кислота вместе с побочными продуктами реакции (уксусный ангидрид, муравьиная кислота, вода и др.) отводится на очистку и ректификацию. Смесь паров ацетальдегида, уксусной кислоты и других веществ из верхней части колонны направляется в холодильник — конденсатор, а затем в сепаратор, откуда непрореагировавший ацетальдегид направляется снова в реакционную колонну. А отходящий газ после промывки выпускается в атмосферу.
Производство анилина Анилин ―базовый химический продукт, который широко используют для производства строительных материалов, автомобильной резины, гербицидов, упаковки, красителей, лекарственных препаратов. В России по загадочным обстоятельствам, кажется, его синтез прекратился. Импорт анилина с каждым годом растет. Без него невозможно собственное производство MDI и ряда полезных приложений. Анилин как базовых химический продукт для строительной, лакокрасочной, фармацевтической отраслей, сельского хозяйства. Производство анилина в России фактически приостановлено. Динамика производства анилина на мировом рынке. В чистом виде анилин практически не используется. Это промежуточное сырье для получения более сложных соединений и конечных продуктов. Более полувека с начала появления первых методов промышленного синтеза вещества его в основном использовали для изготовления красителей. После Второй мировой войны увеличивалась доля анилина, идущего на производство добавок для резины (ускорителей вулканизации). К началу 1960-х почти ⅔ его объема расходовали на это направление. В эти же годы началось массовое производство полиуретанов, получаемых из полупродуктов на базе анилина. К настоящему моменту общемировое производство анилина составляет более 8.5 млн. тонн, сегодня более 80 % анилина идет на производство метилендифенилдиизоцианата (MDI) – крупнотоннажного компонента для получения полиуретанов. Анилин используют для производства средств для защиты растений (гербициды), строительных и конструкционных материалов, упаковки. Производство резины и красителей занимает в общем объеме уже не столь значимое место. Кроме того, анилин востребован в фармацевтическом секторе.  Для восстановления лучше всего использовать стружку серого чугуна — отход металлообрабатывающих заводов. Серый чугун по химической природе представляет собой железо, в котором растворен углерод, образующий обнаруживаемые в микроструктуре чугуна углеродсодержащие компоненты: феррит и перлит, а также графит. Кроме того, в чугуне в небольших количествах содержатся соединения других элементов: Mn, P, Si, S. Химическая неоднородность чугуна является причиной его активности в отношении окисления во влажной среде (влажная коррозия), т. к. обусловливает возможность возникновения элементарных гальванических пар, например, феррит—графит. Выделяющийся при этом на аноде кислород способствует окислению железа. Вследствие зернистого строения серого чугуна его стружка очень хрупка и легко ломается, поэтому при размешивании в процессе восстановления она распадается на мелкие частицы. При этом значительно увеличивается ее поверхность соприкосновения с жидкостью, что ведет к ускорению восстановления. Часто перед употреблением стружку специально измельчают и просеивают. Для восстановления нитробензола в анилин в промышленных масштабах были разработаны два способа: периодический и непрерывный. Периодический способ. Восстановление нитробензола в анилин в аппаратах периодического действия осуществляется в промышленном масштабе более 100 лет без существенных усовершенствований (рис. 4.2.1). Для восстановления нитробензола применяют цилиндрические реакционные аппараты (редукторы), стальные или чугунные, емкостью 10–20 м3, защищенные изнутри от коррозии и истирания кислотоупорной плиткой. Аппараты снабжены мощными тихоходными мешалками, необходимыми для размешивания тяжелого осадка, состоящего из чугунных стружек и оксидов железа. Через полый вал мешалки в аппарат подают острый пар для нагрева массы в начальный период восстановления. Редукторы некоторых конструкций имеют паровую рубашку для обогрева. Порядок загрузки реагентов может быть различным. Обычно сначала в аппарат загружают воду (или возвратную анилиновую воду) и часть чугунной стружки, нагревают острым паром и добавляют готовый электролит или кислоту для протравливания стружки. Затем постепенно порциями добавляют нитробензол и оставшееся количество чугунной стружки. Восстановление нитробензола в анилин сопровождается выделением большого количества тепла (548 кДж/моль), поэтому реакционная масса в редукторе находится постоянно в состоянии кипения, которое поддерживается за счет теплоты реакции. При этом испаряется большое количество воды и образующегося анилина. Пары воды и анилина конденсируются в обратном холодильнике и возвращаются в редуктор. Отгоняющийся анилин содержит некоторое количество непрореагировавшего нитробензола. После окончания загрузки нитробензола проводят небольшую выдержку до полного восстановления. Конец реакции определяют по исчезновению окраски конденсата, возвращающегося в редуктор, или по концентрации образовавшегося анилина, которую определяют с помощью титрования нитритом натрия. После нейтрализации реакционной массы анилин из смеси выделяют. Применяется несколько методов выделения: отгонка анилина из редуктора острым паром, вакуум-отгонка анилина из реакционной массы, сифонирование анилина из редуктора. Из-за сложности аппаратурного оформления первый и второй методы не нашли широкого применения. Наиболее распространенным является третий метод — сифонирование, основанный на том, что при комнатной температуре плотность анилина больше, чем воды, но уже при 71 °С его плотность меньше. Разность в плотностях еще больше увеличивается при добавлении в редуктор хлорида натрия. Анилин всплывает наверх и может быть отделен сифонированием. Около половины анилина остается в водном слое и железном шламе и отгоняется с острым паром. Так как анилин частично растворим в воде (3 %), водный слой после отделения анилина вновь возвращают в процесс или экстрагируют нитробензолом. Общий выход анилина 97 % от теоретического. Синтез ацетальдегида К настоящему времени данный метод получения ацетальдегида усовершенствован фирмой «Wacker» и широко применяется во многих странах мира. Он основан на более дешевом, чем ацетилен, сырье, протекает в одну стадию и дает выход альдегида свыше 95 %, не достигаемый при других способах. При этом процессе важно добиться соответствия между скоростями окисления этилена на PdCl2, окисления восстановленной формы палладия с помощью СuСl2 и окисления Сu2Сl2 кислородом. Самой медленной стадией является последняя, поэтому катализаторный раствор должен содержать избыток медных солей. Хорошие результаты получаются со слабым солянокислым раствором, содержащим 0,3–0,5 % PdCl2 и 10–25 % СuСl2, к которому для регулирования рН среды добавлено 2–3 % ацетата меди. С этим раствором все стадии протекают достаточно интенсивно при 100–130 °С, но для поддержания реакционной смеси в жидком состоянии требуется повышенное давление — 0,3–1,0 МПа, — которое одновременно способствует интенсификации процесса. Реакционными аппаратами являются барботажные колонны; для интенсификации массопереноса от газа к жидкости их иногда заполняют насадкой. Из-за сильной коррозии среды реакторы выполняют из титана или других кислотостойких материалов. Они не имеют теплообменных устройств, и реакционное тепло отводится за счет подогрева холодных реагентов и испарения. Процесс разработан в двух- и одностадийном вариантах. В двухстадийном методе окисление этилена катализаторным раствором и регенерацию последнего воздухом проводят в двух разных аппаратах (рис. 13.13).  Рис. 13.13. Схема двухстадийного синтеза ацетальдегида при окислении этилена воздухом: 1 — реактор; 2 — регенератор; 3 — отпарная коллонна В реактор 1 с кислотоупорной насадкой подают этилен и регенерированный катализаторный раствор, причем реакцию ведут до почти полной конверсии этилена при давлении 0,8–0,9 МПа и 100–115 °С. Полученный раствор ацетальдегида в восстановленном катализаторном растворе дросселируют и направляют в отпарную колонну 3, где отгоняют ацетальдегид и растворенные газы, поступающие на дальнейшее разделение. Катализаторный раствор с низа отпарной колонны подают насосом при 1 МПа в регенератор 2;туда же вводят воздух для окисления Cu+ в Cu2+. Регенерированный раствор возвращают в реактор 1. Достоинства этого варианта — его безопасность (ввиду разделения стадий, на которых присутствуют этилен и воздух) и использование воздуха в качестве окислителя. В одностадийном методе окисление этилена и регенерация катализатора совмещены в одном аппарате. Чтобы избежать образования взрывоопасных смесей, процесс ведут в избытке этилена, возвращаемого затем в реакцию. Вследствие этого в качестве окислителя необходимо применять не воздух, а технический кислород, конверсия которого в реакторе должна быть почти полной. Схема одностадийного процесса изображена на рис. 13.14. В реактор 1 типа пустотелой барботажной колонны, заполненной катализаторным раствором, подают кислород и этилен (свежий и рециркулирующий). Реактор работает с постоянным уровнем жидкости при 130 °С и давлении 0,3 МПа. Избыточный этилен выдувает из раствора образовавшийся ацетальдегид, чем предотвращаются побочные реакции его конденсации. Вместе с ацетальдегидом испаряется часть воды, которую конденсируют в холодильнике 3 и возвращают в реактор.  Рис. 13.14. Технологическая схема одностадийного синтеза ацетальдегида при окислении этилена кислородом: 1 — реактор; 2 — циркуляционный компрессор; 3 — холодильник; 4 — абсорбер; 5 — отпарная колонна; 6 — ректификационная колонна; 7 — холодильник Газопаровую смесь направляют в абсорбер 4, где ацетальдегид поглощают водой, орошающей насадку абсорбера. Главное количество остаточного газа, содержащего этилен, немного кислорода и инертные примеси, возвращают на окисление, дожимая его циркуляционным компрессором 2. Меньшую часть газа выводят с установки во избежание чрезмерного накопления в нем инертных примесей. Водный раствор ацетальдегида из куба абсорбера 4 поступает в отпарную колонну 5, где отгоняются растворенные газы и летучие примеси. Затем в колонне 6 в виде дистиллята получают ацетальдегид, а большую часть кубовой жидкости, содержащей менее летучие побочные продукты (кротоновый альдегид и др.), возвращают после охлаждения на абсорбцию. Часть этой жидкости выводят в систему очистки сточных вод. По сравнению с двухстадийным процессом одностадийный синтез ацетальдегида дает экономию в капиталовложениях и расходе энергии, но связан с применением более дорогостоящего окислителя — кислорода. Показатели этих методов в общем близки, и оба они успешно эксплуатируются в промышленности. Получение этилового спирта: https://www.youtube.com/watch?v=t4AWh7HyjsE Получение метилового спирта: https://www.youtube.com/watch?v=qHwcRVYVUXA |

