лб. Определение концентрации раствора растворов титрованием
 Скачать 42.86 Kb. Скачать 42.86 Kb.
|
|
Тема: определение концентрации раствора растворов титрованием. Цель работы: определить концентрацию растворов кислоты титрованием раствором щелочи. Теоретическая часть: 1. Титрование - метод объёмного анализа, заключающийся в постепенном прибавлении раствора известной концентрации (стандартного раствора) к анализируемому раствору с целью установления концентрации последнего. 2. Нормальная концентрация – число моль растворенного вещества в одном литре раствора. N = Сн = 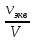 = =  [ [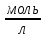 ]; где: ]; где: mв– масса растворенного вещества; М(Эв) – молярная масса эквивалента вещества. 3. Молярная концентрация – число моль растворенного вещества содержащегося в одном килограмме чистого растворителя. М = См =  = [ = [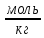 ]; где: ]; где:mа – масса растворителя; mв– масса растворенного вещества; Мв – молярная масса растворенного вещества. 4. На нейтрализацию 25 мл раствора НСl неизвестной концентрации пошло 30 мл 0,1 Н раствора NaOH. Вычислить нормальность и молярность раствора кислоты.
NK = 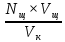 , тогда N (HCl) = , тогда N (HCl) = 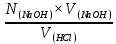 ; ;N (HCl) = 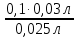 = 0,12 (моль/л). = 0,12 (моль/л).M (HCl) = 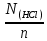 , M (HCl) = , M (HCl) = 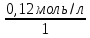 = 0,12 моль/л. = 0,12 моль/л.Ответ: N (HCl) = 0,12 (моль/л); M (HCl) = 0,12 моль/л. Определение концентрации соляной кислоты 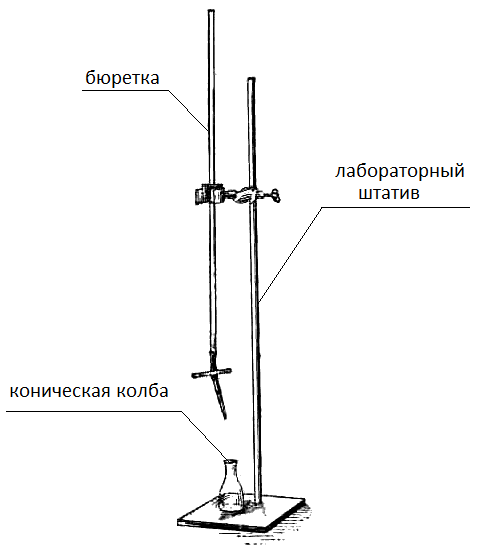 Прибор для титрования
Титруем (добавляем медленно по капле) 0,1 нормального раствора NaOH раствор HCl неизвестной концентрации до изменения окраски индикатора (метиловый оранжевый) с розовой до желтой с оранжевым оттенком. Уравнение реакции: HCl + NaOH = NaCl + H2O; H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O; Н + + OH- = H2O Расчеты проводим по уравнению закона эквивалентов: Сн (HCl) × V(HCl) = Сн (NaOH) × V(NaOH), отсюда: Сн (HCl) = 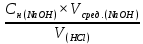 Сн (HCl) = 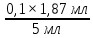 = 0,0374 мл = 0,0374 млВывод: определил концентрацию раствора соляной кислоты (HCl) титрованием раствором щелочи гидроксида натрия (NaOH). Она равна 0,0374 мл. | ||||||||||||||||||||||||
