Определение отношения теплоемкостей
 Скачать 224.5 Kb. Скачать 224.5 Kb.
|
|
ЛАБОРАТОРНАЯ РАБОТА 1-34 ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ГАЗОВ (Ср / СV) СПОСОБОМ ДЕЗОРМА И КЛЕМАНА Цель работы: определить отношение теплоемкостей (Ср/СV) для воздуха.Приборы и принадлежности: стеклянные баллоны, U-образный водяной манометр, ручной насос. КРАТКОЕ ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕТеплоемкостью называется количество теплоты, которое необходимо сообщить телу для изменения его температуры на 1 К. Теплоемкость, отнесенная к единице массы вещества, называется удельной теплоемкостью, а отношение к молю – молярной, или мольной теплоемкостью. По определению теплоемкость Газ, получая (или отдавая) тепло, изменяет свой объем и совершает работу, а также изменяет свою внутреннюю энергию. По первому началу термодинамики dQ = dU + dA, (2) dQ – теплота, переданная газу; dU – изменение внутренней энергии газа; dA – работа, совершаемая газом. Элементарная работа, совершаемая газом при изменении его объема, определяется dA = РdV, (3) Р – давление газа; dV – изменение объема. Теплоемкость газа найдем, используя уравнения (1) и (2). или Так как давление Р зависит от объема V по-разному в зависимости от процесса, то теплоемкость для различных процессов будет неодинакова. При изохорном процессе V =const, dV = 0 (dA = 0), а поэтому теплоемкость газа, сохраняющего неизменным объем, При изобарном процессе остается неизменным давление газа, т.е. Р = const. Величину PdV найдем, используя уравнение Менделеева–Клапейрона PV = RT. Продифференцируем уравнение (6) для случаяP = const (6)PdV = RdT. (7) Таким образом, теплоемкость газа при постоянном давлении определяется из уравнения (4, а) Из уравнения (8) видно, что всегда СР > СV. Непосредственное определение теплоемкостей довольно затруднительно, особенно СV. Однако во многих задачах определяют отношение теплоемкости при постоянном давлении (СР) к теплоемкости при постоянном объеме (СV) 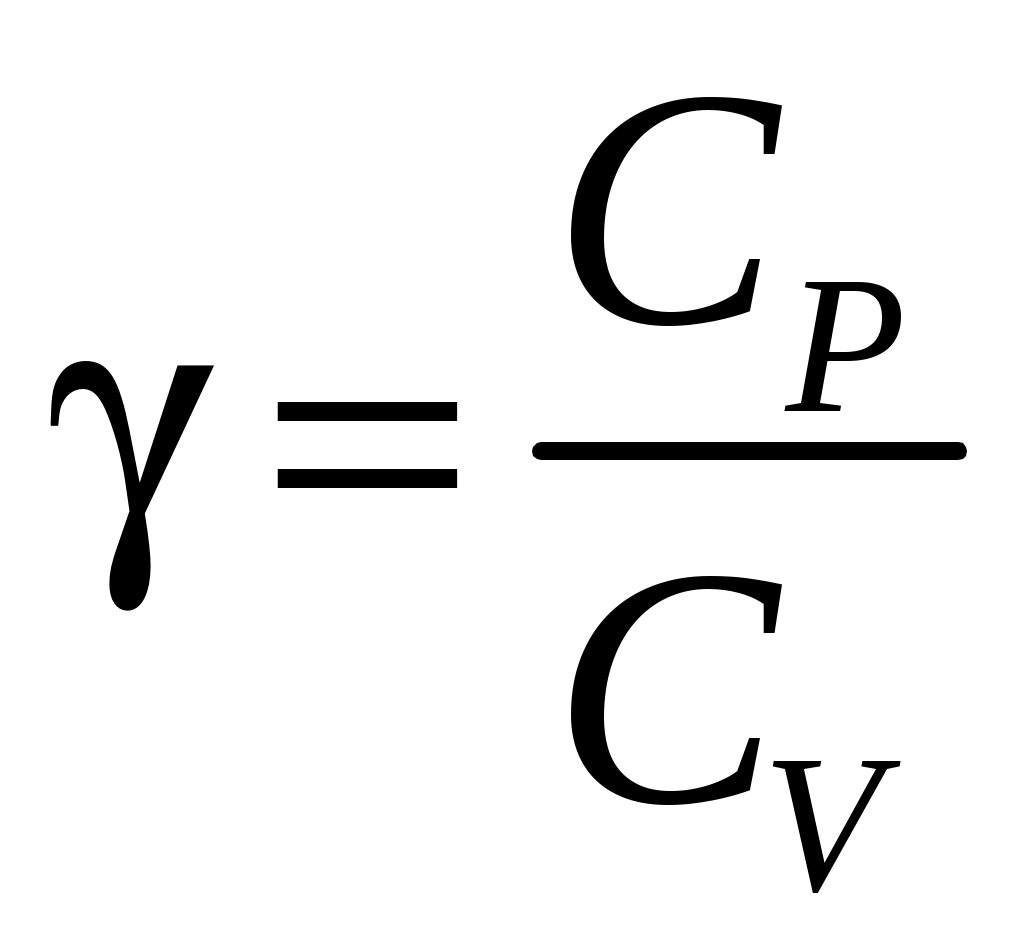 . (9) . (9)Величина этого отношения одинакова как для молярных, так и для удельных теплоемкостей, так как Отношение удельных теплоемкостей газов играет очень большую роль при адиабатических процессах и при процессах, близких к ним. Величиной определяется, например, скорость распространения звука в газах, от нее зависит течение газов по трубам со звуковыми скоростями и достижения сверхзвуковых скоростей в расширяющихся трубах. Адиабатический процесс – это процесс, протекающий без теплообмена с окружающей средой. Можно с достаточным приближением рассматривать всякое быстрое изменение объема как процесс адиабатный и чем быстрее он происходит, тем ближе к адиабатному. Применим первое начало термодинамики к адиабатному процессу dQ = 0, dA + dU = 0 или dA = dU, т.е. при адиабатном процессе работа совершается газом, только за счет изменения внутренней энергии. Выразим dU из уравнения (5), тогда работа газа при адиабатном расширении будет иметь вид dA = CVdT. (10) Используя уравнения (5), (7), (8) и (9), можно получить связь между давлением и объемом при адиабатном процессе PV =const (уравнение Пуассона), (11) где = СР/CV – показатель адиабаты. Показатель адиабаты для одноатомного, двухатомного и многоатомного газа будет разным. МЕТОДИКА ОПРЕДЕЛЕНИЯ ПОКАЗАТЕЛЯ АДИАБАТЫ Стеклянный баллон В соединен с открытым манометром М и через осушитель О и баллон С с насосом Н. Осушитель О и баллон С, на дно которого наливается концентрированная серная кислота, служат для осушения воздуха. Если исключить пары воды, то воздух можно рассматривать как двухатомный газ. Н 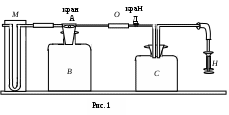 асосом Н закачивают воздух до тех пор, пока разность уровней жидкости в коленах манометра не станет равной h = 2030 см; так как в баллоне В воздух осушенный, а в баллоне С неосушенный, то желательно исключить влияние газа в баллоне С на процессы, происходящие с газом в баллоне В. Для этого закрывают кран Д. асосом Н закачивают воздух до тех пор, пока разность уровней жидкости в коленах манометра не станет равной h = 2030 см; так как в баллоне В воздух осушенный, а в баллоне С неосушенный, то желательно исключить влияние газа в баллоне С на процессы, происходящие с газом в баллоне В. Для этого закрывают кран Д.При накачивании воздуха температура его в баллоне В увеличивается за счет работы внешних сил, приложенных к поршню насоса. При истечении 34 мин температура воздуха в баллоне за счет теплообмена с окружающей средой станет равной температуре окружающей среды. Уровень жидкости в коленах манометра перестанет перемещаться, и установится разность уровней h1. П 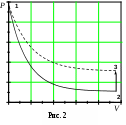 олученное состояние газа в баллоне В характеризуется следующими основными параметрами: V1 – молярный объем, Р1 – давление, Т1 – температура окружающего воздуха (состояние 1 на рис. 2). олученное состояние газа в баллоне В характеризуется следующими основными параметрами: V1 – молярный объем, Р1 – давление, Т1 – температура окружающего воздуха (состояние 1 на рис. 2). Затем нужно быстро открыть кран А, на некоторое время соединив баллон В с окружающим воздухом, и после того как давление в баллоне В станет равным атмосферному давлению, кран А закрыть. При достаточном сечении выпускного отверстия процесс расширения газа происходит быстро, и его можно считать адиабатным. Полученное при этом состояние газа в баллоне В характеризуется параметрами: V1 – молярный объем; Р2– давление (атмосферное); Т2– температура. Жидкость в коленах манометра находится на одном уровне. Из-за совершения работы газом против внешнего давления температура его уменьшается Т2 < Т1. Через 3–4 мин после закрытия крана воздух в баллоне нагреется изохорически до комнатной температуры Т1, давление повысится до величины Р3 (состояние 3) (появится разность уровней жидкости в коленах манометра h2). Состояния 1 и 2 связаны между собой следующим соотношением: Состояние же 1 и 3 принадлежат к одной и той же изотерме, поэтому они связаны законом Бойля–Мариотта P1V1= P3V2. (12) Из уравнений (11, а) и (12) определим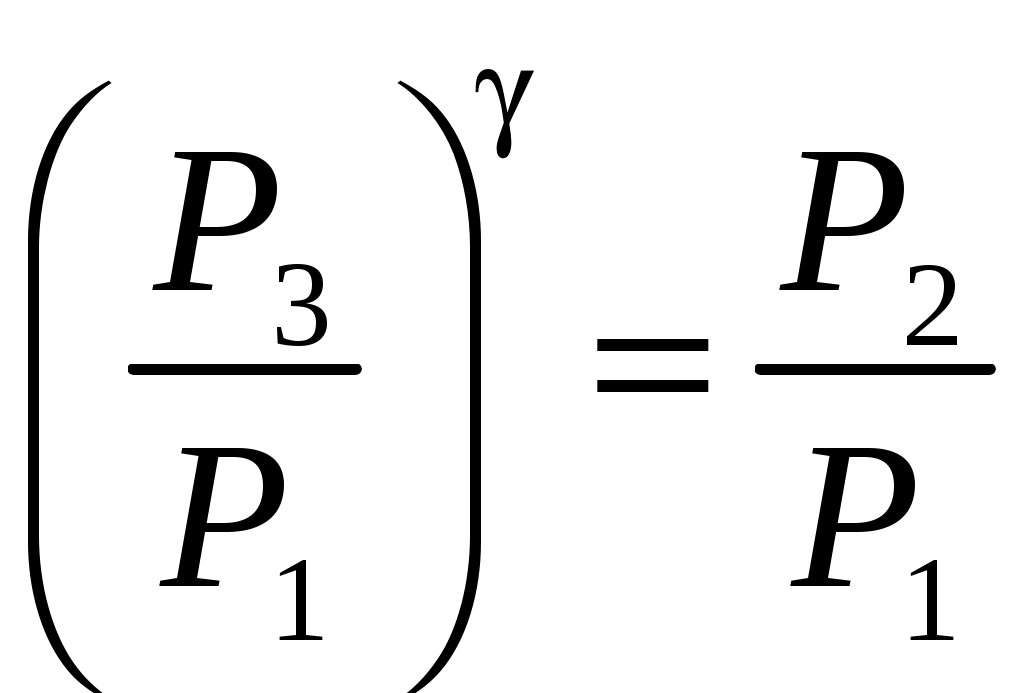 . (13) . (13)Чтобы найти , необходимо прологарифмировать выражение (13) 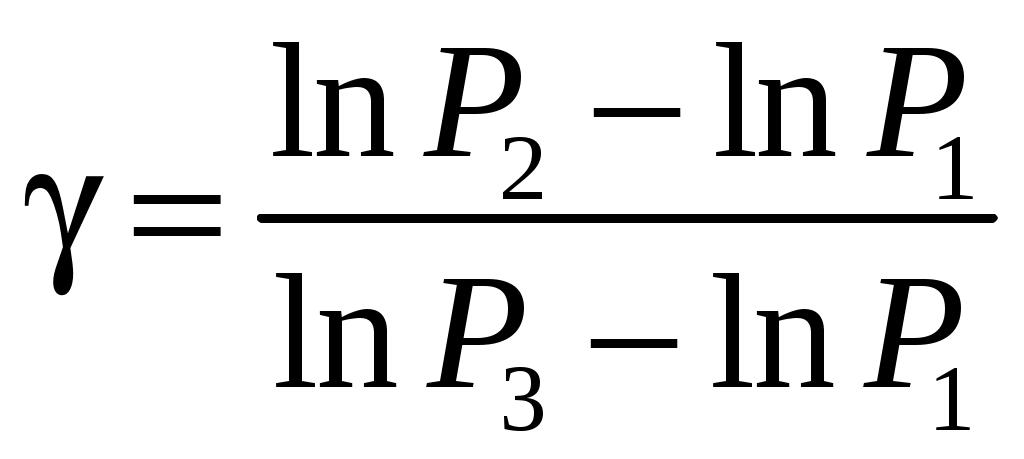 . (14) . (14)Так как давления Р1 и Р2 отличаются на очень малую величину, то разность логарифмов можно заменить разностью давлений 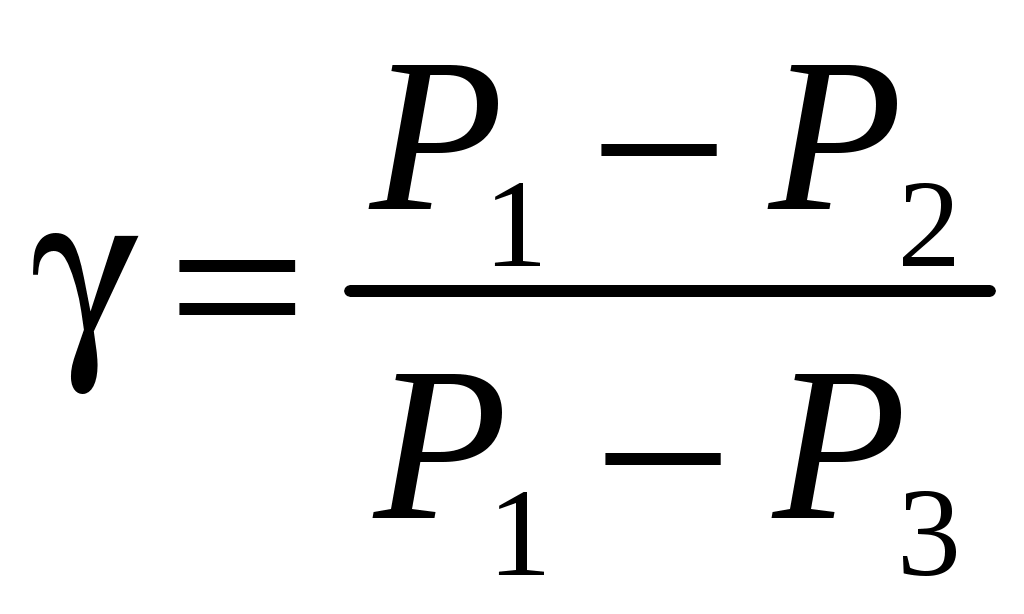 . (15) . (15)Таким образом, для определения необходимо определить давления в трех состояниях: Р1, Р2, Р3. В условиях данного опыта Р2 равно атмосферному давлению, когда разность уровней жидкости в коленах манометра равна нулю. Давление воздуха в баллоне в начальном состоянии (1) равно Р1 = Р2 + gh1, где Р2 – атмосферное давление; – плотность жидкости в манометре; g– ускорение свободного падения; h1 – разность уровней жидкости в манометре при измерении давления Р1после того, как температура в баллоне станет равной температуре окружающей среды. Давление в баллоне в конечном состоянииР3 = Р2 + gh2, где h2 – разность уровней жидкости в манометре при измерении давления Р3. Подставив Р1 и Р3 в уравнение (15), получим 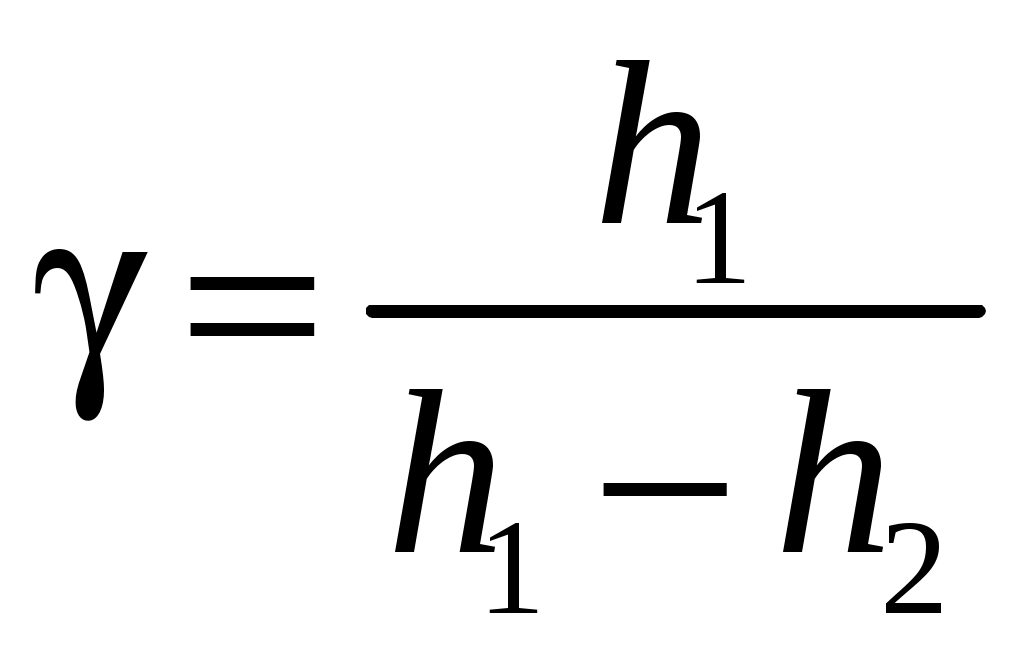 . (16) . (16)П 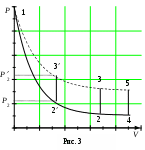 о формуле (16) можно производить вычисления . Величина h2 получена в предположении, что кран А закрывается в момент окончания адиабатного процесса 1–2. Если кран закрыть до завершения процесса 1–2, т.е. в тот момент, когда давление в баллоне снизится до некоторой величины о формуле (16) можно производить вычисления . Величина h2 получена в предположении, что кран А закрывается в момент окончания адиабатного процесса 1–2. Если кран закрыть до завершения процесса 1–2, т.е. в тот момент, когда давление в баллоне снизится до некоторой величины Е сли кран закрыть спустя некоторое время после завершения процесса 12, то за это время температура в баллоне несколько повысится за счет теплообмена с внешней средой (изобарный процесс 24 проходит при атмосферном давлении). В этом случае разность давлений, определяемая разностью ординат 45, окажется заниженной, что приведет к уменьшению . Д 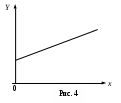 ля получения идеального измерения кран необходимо закрыть в тот момент, когда газ находится в состоянии 2, которое соответствует окончанию адиабатного процесса, что практически невозможно. Разность ординат (рис. 3) Р0 = Р3 – Р2 = gh2, где h2 – разность уровней жидкости в манометре, полученная в предположении, что кран А закрывается в момент окончания адиабатного процесса. Так как у сосуда нет тепловой изоляции, то адиабатным можно считать только «мгновенный» процесс, следовательно h2 соответствует открыванию крана А на время 0, что экспериментально невозможно, поэтому h2 приходится определять косвенным путем. Известно, что для линейной функции Y(Х) легко найти значение Y0 графически при Х 0, если прямое измерение Y0 затруднено. ля получения идеального измерения кран необходимо закрыть в тот момент, когда газ находится в состоянии 2, которое соответствует окончанию адиабатного процесса, что практически невозможно. Разность ординат (рис. 3) Р0 = Р3 – Р2 = gh2, где h2 – разность уровней жидкости в манометре, полученная в предположении, что кран А закрывается в момент окончания адиабатного процесса. Так как у сосуда нет тепловой изоляции, то адиабатным можно считать только «мгновенный» процесс, следовательно h2 соответствует открыванию крана А на время 0, что экспериментально невозможно, поэтому h2 приходится определять косвенным путем. Известно, что для линейной функции Y(Х) легко найти значение Y0 графически при Х 0, если прямое измерение Y0 затруднено. Пересечение прямой Y(Х) с ординатой соответствует значению Y0 при Х 0 (рис. 4) . В данной работе зависимость h2 = f() – нелинейная функция. Любой нелинейный процесс с достаточной степенью точности можно аппроксимировать экспонентной, то есть можно записать h2 = h2exp(-k), (17) где k – const, а h2 h2 при 0. Прологарифмируем выражение (17): З 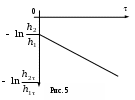 ависимость ависимость 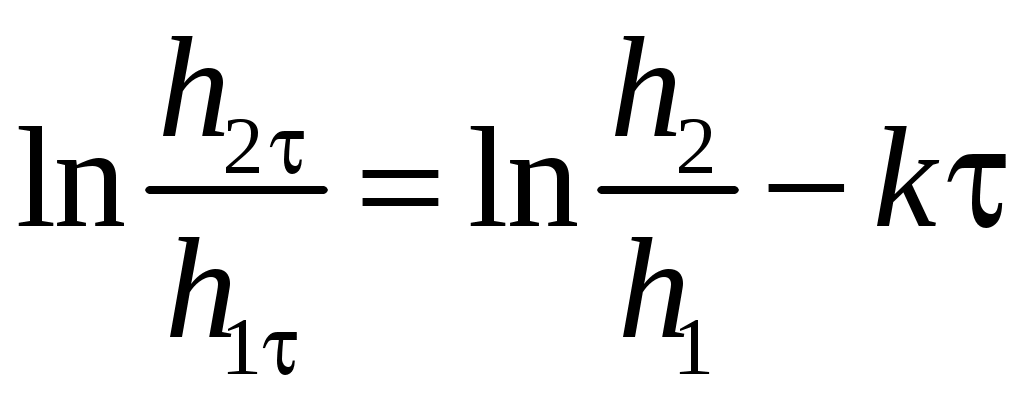 . (18) . (18)График зависимости Формулу (16) удобно переписать в следующем виде: |
| № опыта | , с | L1, см | L2, см | h1, см | 1, см | 1, см | h2 см | | | | |
| 1 2 3 | | | | | | | | | | | |
| 1 2 3 | | | | | | | | | | | |
| 1 2 3 | | | | | | | | | | | |
| 1 2 3 | | | | | | | | | | | |
| 1 2 3 | | | | | | | | | | | |
Примечание:
ВОПРОСЫ ДЛЯ САМОСТОЯТЕЛЬНОЙ И
ИНДИВИДУАЛЬНОЙ РАБОТЫ
Какой процесс называется адиабатическим? Какие существуют методы определения показателя адиабаты?
Какие существуют методы раздельного определения теплоемкостей Сv и Ср? Проанализируйте литературные данные, сделайте реферативное сообщение.
Почему непосредственное определение Сv более затруднительно, чем Ср?
Почему величина одинакова для молярных, удельных и других теплоемкостей? Ответ обосновать аналитически.
Как зависит величина от температуры? Сделайте соответствующий литературный обзор.
Почему на практике сложно реализовать адиабатический процесс?
Почему различны показатели адиабаты для одноатомного, двухатомного и многоатомного газа? Ответ обосновать.
При накачивании воздуха в баллон его температура увеличивается. Каковы причины этого явления?
Как влияют пары воды в баллоне на величину измеренного значения , завышают или занижают это значение и почему?
Почему при открывании крана А температура воздуха в баллоне понижается?
Является ли постоянным количество газа в баллоне? Как это учитывается в процессах, происходящих в эксперименте?
Есть ли в процессах, происходящих в баллоне, «квазизобарные»? Если есть, то укажите участок PV, на котором реализуется это явление.
Как вычислить количество газа в граммах, которое закачивается в баллон? Оцените это количество.
Почему разность столбов жидкости в манометре зависит от времени открывания крана?
В данной работе нелинейный процесс аппроксимируют экспонентой. Какую погрешность вносят данным допущением?
При обработке экспериментальных данных используют метод экстраполяции. Объясните, для чего это делают?
Проанализируйте возможные ошибки, возникающие при определении данным методом?
При каких условиях график зависимости
Предложите методы, позволяющие оптимизировать эксперимент, улучшить воспроизводимость результатов.
Почему теплоемкость зависит от способа нагревания?
Почему теплоемкость зависит от температуры? Сделайте анализ литературных данных на эту тему.
Почему необходимо определять h2 при = 0?
Объясните, является ли предлагаемый выбор = 2, 4, 6, 8, 10 с оптимальным? Можно ли выбрать иные значения? Ответ обосновать.
Почему происходит понижение температуры газа при открывании крана? Как величина Т зависит от массы закачиваемого в баллон воздуха?
Перечислите приближения, используемые при выводе основной формулы для определения . Почему нельзя использовать компрессор при выполнении измерений?

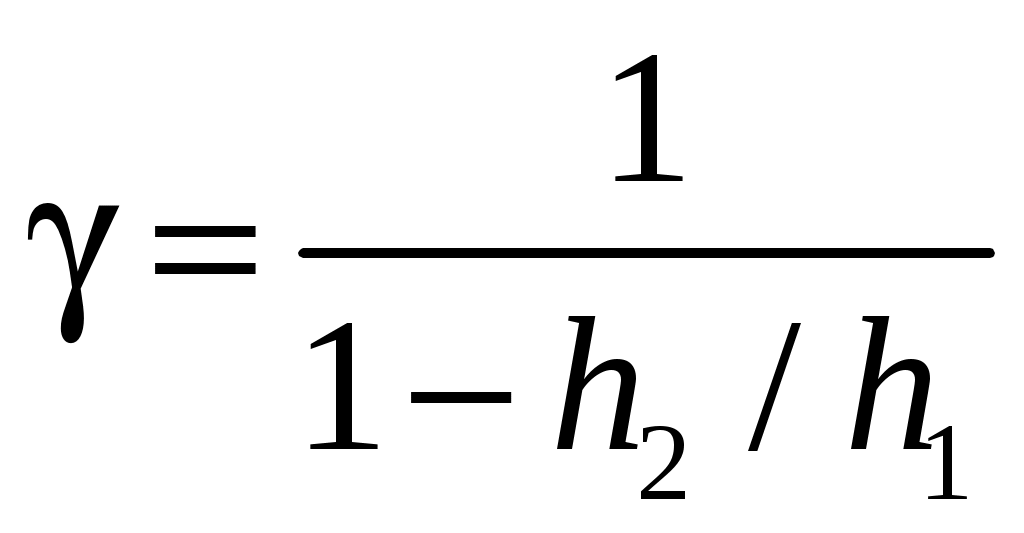 . (19)
. (19)