Определение содержания ионов ca2 и в растворе трилонаб
 Скачать 25.25 Kb. Скачать 25.25 Kb.
|
|
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ИОНОВ Ca2+ и 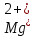 В РАСТВОРЕ ТРИЛОНА-Б В РАСТВОРЕ ТРИЛОНА-Б
Посуда: склянка(V=1 л), цилиндры(1 л, 25 мл) Реактивы: раствор Трилон-Б(ρ=0,86 г/ 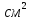 с с 0,05 моль/л) 0,05 моль/л)Расчет:
m(навески ТБ) 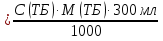 = =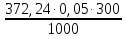 = 5,58 г. = 5,58 г.
V( 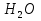 )= )= - -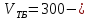 5,58= 295,2(мл) 5,58= 295,2(мл)
и перелить через воронку в склянку.
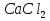 +2NaOH= +2NaOH=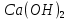 +2NaCl +2NaClПриготовление стандартного раствора 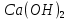 : :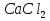 - 10 мл - 10 млВода - 70-80 мл NaOH(2 н.) - 5-7 мл Экспериментальная часть: В бюретку (вымытую водопроводной , ополоснутую дистиллированной водой и своим растворомТрилона-Б) , налить раствор Трилона-Б, заполнить носик бюретки. В коническую колбу для титрования отобрать пипеткой 10 мл первичного стандартного раствора гидроксида кальция, добавить муроксида, перемешать. Установить уровень раствора титранта в бюретке на нулевое деление . Титровать до перехода окраски раствора от розового до фиолетового цвета , записать объем Трилона-Б. Титровать до получения трех сходящихся результатов. Найти среднее значение. 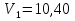 мл мл 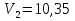 мл мл 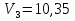 мл мл 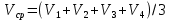 =10,37 мл. =10,37 мл.
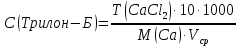 = =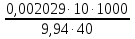 =0,0489 моль/л =0,0489 моль/л
Основной метод: комплексонометрическое титрование Индикатор: муроксид, эриохром черный-Т. Реактивы: а) стандартный растворТрилона-Б, б) контрольный раствор солей 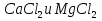 (выдается лаборантом) (выдается лаборантом)в) индикатор:муроксид, эриохром черный-Т. Посуда: мерная колба (100 мл), бюретка (25 мл), пипетка(10 мл), коническая колба для титрования, резиновая груша. Экспериментальная часть: В вымытую мерную колбу емкостью 100 мл получить у лаборанта контрольный раствор солей 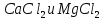 (по карточке студента). Довести объем дистиллированной водой до метки, закрыть пробкой, перемешать. (по карточке студента). Довести объем дистиллированной водой до метки, закрыть пробкой, перемешать.Бюретку заполнить стандартным растворомТрилона-Б, установить уровень раствора на нулевом делении. В коническую колбу отобрать с помощью пипетки 10 мл анализируемого раствора из мерной колбы добавить 1) муроксида/2)эриохрома черного-Т( на конце шпателя) . Оттитровать до получения трех сходящихся результатов. Найти средний объем, пошедший на титрование. 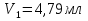 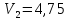 мл мл 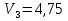 мл мл 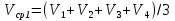 =4,76 мл =4,76 мл
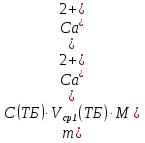 0,09312 г 0,09312 гб) Расчет массы ионов 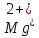 в растворе Трилона-Б: в растворе Трилона-Б: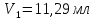 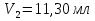 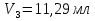 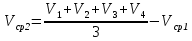 =11,29 - 4,83=6,46 мл =11,29 - 4,83=6,46 млm( 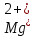 )= )=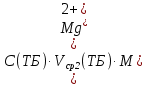 = = 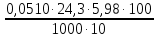 =0,07676 г =0,07676 гВывод: определили содержание ионов Ca2+ и 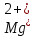 в растворе Трилона-Б методом комплексонометрического титрования. в растворе Трилона-Б методом комплексонометрического титрования. |

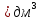 , объемом 300 мл.
, объемом 300 мл.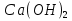
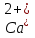 и
и