хим лаб3. Лаб 3 М.Е. Баргуев ОПз-22-1. Определение теплоты реакции нейтрализации
 Скачать 24.2 Kb. Скачать 24.2 Kb.
|
|
| ||||||||||||||||||||||
| Температура Т, К | Изменение энтальпии ∆Н, кДж | ∆Н°нейтр.практ., кДж/моль | ∆Н°нейтр. теор., кДж/моль | Относит. ошибка опыта Е, % | |
| начальная | конечная | ||||
| 26С 299,15K | 31С 304,15K | 1,045 | 41,8 | 55,6 | 24,8 |
1. Вычислить изменение энтальпии реакции ∆Н по формуле:
ΔH = −V ∙ ρ ∙ c ∙ ΔТ=50*1*4,18*5=1,045
где V – общий объем раствора, мл; ρ – плотность раствора, г/мл; с – теплоемкость раствора, Дж/(г∙К); ΔТ – разность между конечной и начальной температурами. Принять плотность раствора после нейтрализации равной 1 г/мл, а теплоемкость раствора − равной теплоемкости воды, т.е. 4,18 Дж/(г∙К).
2. Вычислить тепловой эффект реакции нейтрализации ∆Н°нейтр.(практ.) в расчете на 1 моль эквивалентов кислоты. Так как 1 моль эквивалентов кислоты содержится в 1 л раствора (концентрация равна 1 н.), а для реакции было взято 25 мл, то
 =
=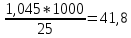
3. Используя следствие из закона Гесса, рассчитать теоретическое значение изменения энтальпии реакции нейтрализации ∆Н°нейтр.(теор.) для уравнения реакции:
Н+ + ОН‾ → Н2О.
ΔН° = - 285,8-(-230,2)=-55,6
Значения стандартных термодинамических функций состояния системы приведены в таблице 2.
Таблица 2
Стандартные энтальпии образования ∆Н°298
| Вещество | ∆Н°298, кДж/моль |
| Н+ | - |
| ОН‾ | -230,2 |
| Н2О | -285,8 |
4. Рассчитать относительную ошибку опыта Е (%):
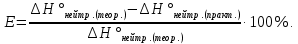
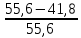 *100%=24,8.
*100%=24,8.
