практика. Коллоквиум 1. Определения Титрование процесс определения титра исследуемого вещества. Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки
 Скачать 40.74 Kb. Скачать 40.74 Kb.
|
|
Коллоквиум 1 Определения: 1. Титрование — процесс определения титра исследуемого вещества. Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки. 2.Титрант – реагент с точно известной. концентрацией, добавляемый к исследуемому. раствору для количественного анализа. содержащихся в нем веществ или их элементов. (ионов, функциональных групп). 3.Точка эквивалентности – это точка на кривой титрования, в которой количество затраченного титранта эквивалентно количеству реагирующего с ним вещества. 4. Конечная точка титрования – точка на кривой титрования, в которой регистрируется резкое изменение наблюдаемого свойства (например, меняется цвет индикатора). 5. Кислотно-основные индикаторы (pH-индикаторы) — органические соединения, способные изменять цвет в растворе при изменении кислотности (pH). 6.Скачком титрования называется участок кривой титрования, соответствующий резкому изменению свойств системы 7. Установочным веществом называют хи-мически чистое соединение точно известного состава, при-меняемое для установки титра раствора другого вещества. 8. Буферные растворы— растворы с определённой устойчивой концентрацией водородных ионов, рН которых мало изменится при прибавлении к ним небольших количеств сильного основания или сильной кислоты, а также при разбавлении и концентрировании. 9. Закон эквивалентов:Вещества взаимодействуют друг с другом равными количествами молярных масс эквивалентов: nЭ1 = nЭ2, где nЭ1 – количество молярных масс эквивалента одного вещества; nЭ2 – количество молярных масс эквивалента другого вещества, взаимодействующего с первым. 10. Водородный показатель — мера определения кислотности водных растворов Формулы и ед.измерения: 1. 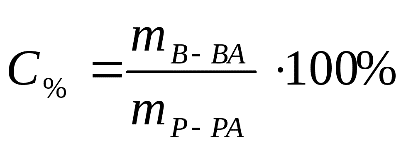 2. 3.M=m/v 5. 6. T = М.м. экв*С / 1000, где: C – молярная концентрация титранта. 7. aA + bB = cC + dD 8. Для сильных кислот и оснований: рН = - lg [H+] 9. Для слабых кислот: рН = 1/2 (pKa + pCa) pKa = - lg Ka, Ka 10. 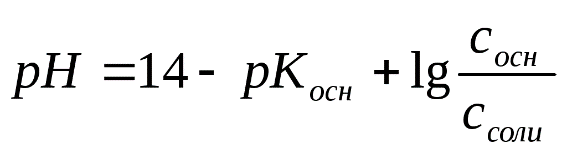 Вопросы к сдаче: 1. Химический анализ – это совокупность методов, с помощью которых определяют химический состав веществ. Химический анализ разделяют на качественный и количественный. Задача качественного анализа – идентификация веществ, т. е. обнаружение наличия химических элементов в соединениях или химических соединений в смесях. Задача количественного анализа – определение количеств элементов или их соединений в исследуемом веществе. Титриметрический анализ – метод количественного анализа, основанный на измерении объёма раствора реактива точно известной концентрации (титранта), расходуемого для реакции с определяемым (титруемым) веществом. Титрование – процесс определения концентрации исследуемого вещества путем добавления раствора титранта к раствору титруемого вещества по каплям. 2. Химические аналитические реакции классифицируют на реакции общие, групповые, селективные и специфичные. Общие реакции - - реакции, аналитические сигналы которых одинаковы для многих ионов. Применяемый реагент также называют общим. Групповые реакции - это частный случай общих реакций, используемых в конкретных условиях для выделения определенной группы ионов, обладающих близкими свойствами. Требования к качественным реакциям: - реакция должна сопровождаться аналитическим сигналом; - протекать быстро, почти мгновенно; - быть практически необратимой; - должна отличаться высокой чувствительностью и по возможности специфичностью. 5. Сильные электролиты в растворах диссоциируют полностью, а слабые — ступенчато и обратимо. Сильные основания: NaOH = Na + + OH - Слабые основания: Cu (ON) 2 ⇄ CuOH + + OH - CuOH + ⇄ Cu 2+ + OH - Диссоциация солей. Ведет к образованию катионов металлов (или катиона аммония) и отрицательно заряженных кислотных остатков. Средние соли в растворах полностью распадаются в одну ступень. Na 3 PO 4 = 3Na + PO 4 3 - Кислые соли распадаются ступенчато. Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. 6. Для выражения содержания водородных ионов была разработана специальная величина. Это логарифм концентрации ионов водорода, взятый с обратным знаком: pH = -lg [H+]. Для вычисления рН растворов кислот и оснований следует пред-варительно вычислить молярную концентрацию свободных ионов водорода ( [H+]) или свободных гидроксил ионов ( [OH−]), а затем воспользоваться формулами: pH = − lg [H+]; рОН-=-lg [OH-]; рН + рОН =14. 7. Константа гидролиза (К гидр) равна в момент динамического равновесия отношению произведения концентраций продуктов гидролиза к произведению концентраций гидролизующихся ионов соли. Степень гидролиза (α гидр)– отношение числа гидролизованных молекул соли к числу растворенных. В химическом анализе широко используются реакции гидролиза (для обнаружения и разделения ионов, регулирования кислотности раствора) 10. Растворы кислот и щелочей стандартизуют по одному из первичных установочных веществ: Na2CO3, Na2B4O7×10H2O (для кислот), гидрофталату калия, H2C2O4×2H2O, C6H5COOH и т.д. (для щелочей). 11. В титриметрическом анализе используют следующие способы титрования: – прямое; – обратное (титрование по остатку); – заместительное (титрование заместителя). При прямом титровании определяемое вещество (X) титруют раствором титранта (R) или наоборот (реверсивное титрование) 12. Согласно ионной теории индикаторы, используемые в методе кислотно-основного титрования, – это слабые органические кислоты (или слабые органические основания), у которых недиссоциированные молекулы и образуемые ими ионы имеют различную окраску. Показателем титрования называется та концентрация ионов водород, при которой наиболее заметно изменяется окраска индикатора. Принцип выбора индикатора является хотя бы частичное совпадение значений рН 13. Кривая титрования в методе нейтрализации - это графическая зависимость изменения рН раствора от процента оттитрованности (или от объема добавленного рабочего раствора, или от количества вещества рабочего раствора). Кривая титрования может быть рассчитана либо получена экспериментально - измерением рН раствора в ходе титрования. Точка эквивалентности (в титриметрическом анализе) — момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце. |
