химия. Лабораторная работа №2. Лабораторная работа 2 по дисциплине Химия Вариант 08 студент группы 0793208асз Маматов Сергей Владимирович
 Скачать 107.03 Kb. Скачать 107.03 Kb.
|
|
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТА Федеральное государственное бюджетное образовательное учреждение высшего образования «ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПУТЕЙ СООБЩЕНИЯ ИМПЕРАТОРА АЛЕКСАНДРА I» Кафедра «Инженерная химия и естествознание» ЛАБОРАТОРНАЯ РАБОТА № 2 по дисциплине «Химия» Вариант № 08 Выполнил: студент группы: 07-932-08-АСз Маматов Сергей Владимирович Проверила: Масленникова Людмила Леонидовна Санкт-Петербург – 2019 Химическая идентификация (обнаружение) и измерения веществ. Цели работы: Идентификация анализируемых растворов на присутствие в них опасных ионов (качественный анализ); устранение опасных ионов осаждением с помощью раствора щелочи; количественная оценка изменения концентрации ионов (количественный анализ). Химическая идентификация – это ответ на вопрос, какое вещество присутствует в интересующей нас системе (качественный анализ) и сколько этого вещества содержится в системе (количественный анализ). Такое исследование особенно актуально в настоящее время для оценки экологической обстановки. Качественный анализ позволяет определить качество, а количественный дает информацию о том, превышает или нет концентрация вещества его предельно допустимую концентрацию (ПДК) в системе. В основе качественного анализа лежит знание химического поведения веществ, например в виде ионов, по отношению к действию определенной группы соединений, называемых реагентами, а также знание свойств образующихся продуктов реакции (растворимость в воде, кислотах, щелочах, в растворах некоторых веществ (реагентов), способность к образованию веществ сложного состава (комплексообразование). Это знание особенностей химического поведения веществ позволяет выделить реакции обнарыжения, т.е. такие химические реакции анализируемого вещества с реагентом, при которых образуют продукты, имеющие заметные признаки: -Образование характерных осадков и их цвета -Растворение осадков -Появление (изменение) окраски при растворении осадков -Выделение газов Перечисленные признаки являются аналитическим сигналом, под которым понимается различная информация, которую можно зафиксировать визуально (цвет раствора, осадка и др.) либо зафиксировать инструментально и которая свидетельствует о присутствии и количестве того или иного вещества в системе. Часто в качественном и количественном анализах рассматривается образование осадков в реакции с реагентом, причем в качественном анализе – для идентификации. Чтобы идентифицировать раствор на присутствие в нем опасного иона, в данной лабораторной работе используется химическая реакция, в результате которой образуется трудно растворимое соединение – осадок. Цвет и поведение этого осадка с определенным реагентом, дает опорную информацию, указывающую на конкретный ион. Опишем опыт: Дана пробирка с исходным раствором. Сравним цвет исходного раствора с данными в таблице №1:  Согласно полученной информации исходный раствор может содержать следующие ионы: Zn(II), Cd(II), Pb(II), Al(III) или Ba(II). Для получения осадка (гидроксида), к исходному раствору добавляем 3 капли водного раствора щёлочи (NaOH) и наблюдаем. Сравним цвет выпавшего осадка с информацией в таблице №2: 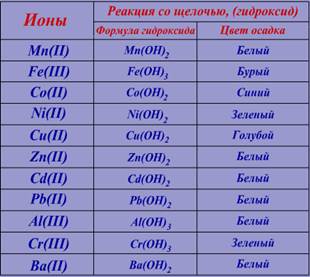 Следовательно в растворе возможно присутствие следующих ионов: Zn(II), Cd(II), Pb(II), Al(III) или Ba(II). Полученный осадок разделим на 2 части. К первой части добавим избыток щёлочи (NaOH) и наблюдаем Сравним результат реакции с информацией в таблице №3:  Следовательно в растворе возможно присутствие следующих ионов: Zn(II), Pb(II), Al(ӀӀӀ). Ко второй части осадка добавим водный раствор аммиака (NH4OH) и наблюдаем. Сравним результат реакции с информацией в таблице №4:  Следовательно в растворе возможно присутствие следующих ионов: Pb(II), Al(ӀӀӀ). На основании полученной информации, для окончательного вывода о присутствии предполагаемого конкретного иона, проделаем специфическую реакцию: к исходному раствору добавим ализарин и наблюдаем. Цвет раствора окрасился в ярко-красный, следовательно в нём возможно присутствие ионов: Al(ӀӀӀ). Проделаем тоже самое и для второй пробирки, результаты занесем в таблицу.
Вывод: первый раствор содержит Al(ӀӀӀ), а второй- Cr(ӀӀӀ), что подтверждается проведёнными опытами и их проверкой. | ||||||||||||||||||||||||||||
