Органические соединения азота
 Скачать 491.01 Kb. Скачать 491.01 Kb.
|
|
Глава 6. Органические соединения азота. 1. Нитросоединения Нитросоединения – производные углеводородов, в молекулах которых один или несколько водородных атомов замещены на одну или несколько нитрогрупп (– NO2). В    зависимости от характера углеродного атома, с которым связана нитрогруппа, различают первичные, вторичные и третичные нитросоединения: зависимости от характера углеродного атома, с которым связана нитрогруппа, различают первичные, вторичные и третичные нитросоединения:нитрометан 2-нитропентан 3-нитро-3-метилпентан По числу нитрогрупп различают моно-, ди- и полинитросоединения. По характеру радикала, связанного с нитрогруппой, нитросоединения подразделяют на алифатические, или нитроалканы, и на ароматические нитросоединения – нитроарилы, а также нитросоединения, содержащие и другие функциональные группы (нитроспирты, нитрокислоты). 1 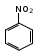 .1. Номенклатура. По систематической номенклатуре нитросоединения называют, добавляя приставку нитро- к названию соответствующего углеводорода. Аналогично образуются названия нитроспиртов и т.п.: .1. Номенклатура. По систематической номенклатуре нитросоединения называют, добавляя приставку нитро- к названию соответствующего углеводорода. Аналогично образуются названия нитроспиртов и т.п.: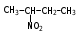 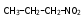 2-нитробутан 1-нитропропан нитробензол  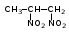  4-нитро-2-метилпентен-1 1,2-динитропропан 1-нитропропанол-2 Физические свойства. Нитроалканы – бесцветные жидкости с высокими температурами кипения. Нитроарилы – жидкие или твёрдые вещества, желтоватого цвета. Имеют специфический запах (горького миндаля), в воде не растворяются, со спиртом, эфиром и бензолом смешиваются во всех отношениях. 1.2. Химические свойства. В 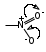 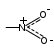 нитрогруппе связь кислород-азот образуется за счёт неподелённой электронной пары атома азота, которая оттягивается к кислороду, как к более электроотрицательному элементу. При этом происходит поляризация двойной связи N=O, которая находится в сопряжении с отрицательным зарядом второго атома кислорода. -электронное облако равномерно распределяется между обоими атомами кислорода: нитрогруппе связь кислород-азот образуется за счёт неподелённой электронной пары атома азота, которая оттягивается к кислороду, как к более электроотрицательному элементу. При этом происходит поляризация двойной связи N=O, которая находится в сопряжении с отрицательным зарядом второго атома кислорода. -электронное облако равномерно распределяется между обоими атомами кислорода:Такое распределение электронных облаков обусловливает значительные электрофильные свойства нитрогруппы, которая и является одним из самых сильных электрофильных агентов. 1. Восстановление нитросоединений (по Зинину Н.Н.). При восстановлении нитросоединений образуются первичные амины: СH3 – NO2 + 6H CH3 – NH2 + 2H2O нитрометан метиламин О  собое значение эта реакция имеет для ароматических нитропроизводных, широко используемых в производстве красителей, медикаментов, фотоматериалов и др.: собое значение эта реакция имеет для ароматических нитропроизводных, широко используемых в производстве красителей, медикаментов, фотоматериалов и др.:нитробензол анилин 2  . Действие минеральных кислот. концентрированные растворы кислот (например, 85 %-ная серная кислота) гидролизуют нитроалканы в карбоновые кислоты и гидроксиламин (В. Мейер, 1879): . Действие минеральных кислот. концентрированные растворы кислот (например, 85 %-ная серная кислота) гидролизуют нитроалканы в карбоновые кислоты и гидроксиламин (В. Мейер, 1879):Н+ нитроэтан ацетогидроксамовая сернокислый кислота гидроксиламин 3. При галогенировании первичных и вторичных нитросоединений образуются галогеннитросоединения: 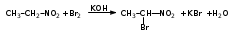 нитроэтан 1- нитро-1-бромэтан 1  .3. Способы получения. Нитроалканы получают по реакции Коновалова, при нагревании алкана с разбавленной азотной кислотой при повышенном давлении и температуре 150 – 475 С: .3. Способы получения. Нитроалканы получают по реакции Коновалова, при нагревании алкана с разбавленной азотной кислотой при повышенном давлении и температуре 150 – 475 С:пентан 2-нитропентан Нитрогруппа может быть введена в молекулу алкана действием солей азотистой кислоты на галогеналкилы: CH3 – CH2 – I + NaO – NO CH3 – CH2 – NO2 + NaI иодистый этил нитроэтан Н  итрование ароматических соединений легко осуществить при действии смеси концентрированной и серной кислот. итрование ароматических соединений легко осуществить при действии смеси концентрированной и серной кислот.толуол тринитротолуол (тротил) Тринитротолуол хорошо известен как взрывчатое вещество. Взрывается только от детонации. Нитроалканы применяются при производстве взрывчатых веществ, альдегидов, кислот, пластмасс, в качестве растворителей химических волокон и пластмасс, вулканизаторов в резиновой промышленности. Ароматические нитросоединения применяют в больших количествах в производстве красителей, взрывчатых веществ, в парфюмерии. Нитроспирты нашли применение в качестве пластификаторов. 2. Амины Амины – продукты замещения атомов водорода в углеводородах на аминогруппы –NH2. Эти соединения можно рассматривать и как производные аммиака, в молекуле которого один или несколько атомов водорода замещены углеводородными радикалами. В зависимости от числа радикалов, замещающих водородные атомы в молекуле аммиака, амины делят на первичные, вторичные и третичные:    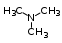 аммиак первичный амин вторичный амин третичный амин метиламин диметиламин триметиламин 2.1. Номенклатура и изомерия. По рациональной номенклатуре сначала называются радикалы, затем добавляется слово амин. Для ряда аминов сохраняются их тривиальные названия. П  о номенклатуре ИЮПАК названия аминов образуют добавлением слова амино- к названию соответствующего углеводорода, цифрой указывается место аминогруппы в молекуле. Изомерия аминов связана со строением углеродной цепи и положением в ней аминогруппы: о номенклатуре ИЮПАК названия аминов образуют добавлением слова амино- к названию соответствующего углеводорода, цифрой указывается место аминогруппы в молекуле. Изомерия аминов связана со строением углеродной цепи и положением в ней аминогруппы: бутиламин, 1-аминобутан бутиламин, 1-аминобутан вторбутиламин, 2-аминобутан вторбутиламин, 2-аминобутан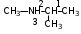 метилпропиламин, 1-метиламинопропан метилпропиламин, 1-метиламинопропан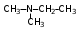 метилизопропиламин, 2-метиламинопропан метилизопропиламин, 2-метиламинопропан диметилэтиламин, диметиламиноэтан диметилэтиламин, диметиламиноэтандифениламин 2.2. Физические свойства. Метиламин, диметиламин и триметиламин – газы, хорошо растворимые в воде. Имеют запах испорченной рыбы. Средние члены ряда аминов – жидкости, высшие – твёрдые, нерастворимые в воде вещества, без запаха. С увеличением молекулярной массы аминов увеличивается их плотность, повышается температура кипения и уменьшается растворимость в воде. 2.3. Химические свойства. Являясь органическими производными аммиака, амины сохраняют главные его химические особенности. В частности, подобно аммиаку, амины проявляют свойства оснований. Это обнаруживается по щелочной реакции водных растворов аминов: N  H3 + H2O NH4+ + OH- H3 + H2O NH4+ + OH-R  NH2 + H2O RNH3+ + OH- NH2 + H2O RNH3+ + OH-Раствор лакмуса окрашивается в синий цвет, а раствор фенолфталеина – в малиновый. Основность аминов предельного ряда колеблется в очень небольших пределах и близка к основности аммиака. П  о мере роста углеводородного радикала растворимость аминов в воде уменьшается. Поэтому высшие амины уже не дают щелочной реакции. Однако они сохраняют свойства оснований; это обнаруживается в способности образовывать с кислотами соли. Причина основных свойств – свободная электронная пара атома азота. Алкильные радикалы обладают некоторой способностью отталкивать электроны, в результате чего в молекуле амина электронная плотность C – N ковалентной связи смещена в направлении к азоту, то есть поляризована: о мере роста углеводородного радикала растворимость аминов в воде уменьшается. Поэтому высшие амины уже не дают щелочной реакции. Однако они сохраняют свойства оснований; это обнаруживается в способности образовывать с кислотами соли. Причина основных свойств – свободная электронная пара атома азота. Алкильные радикалы обладают некоторой способностью отталкивать электроны, в результате чего в молекуле амина электронная плотность C – N ковалентной связи смещена в направлении к азоту, то есть поляризована:Н3С NH2 Поэтому неподелённая электронная пара атома азота в аминах обладает электрофильными свойствами. Природа радикала, с которым связана аминогруппа, также оказывает влияние на основные свойства аминов. В химическом отношении амины имеют большое сходство с аммиаком – вступают в различные реакции как нуклеофильные реагенты: 1 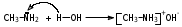 . Образование гидроксидов. Низшие амины, растворяясь в воде, образуют алкилзамещённые гидроксиды аммония: . Образование гидроксидов. Низшие амины, растворяясь в воде, образуют алкилзамещённые гидроксиды аммония:гидроксид метиламмония 2  . Образование солей с минеральными кислотами: . Образование солей с минеральными кислотами:хлористый метиламмоний 3  . Амины способны к алкилированию и ацилированию. Ацилирование первичных и вторичных аминов с ангидридами и галогенангидридами приводит к замещению водородного атома аминогруппы ацильным остатком: . Амины способны к алкилированию и ацилированию. Ацилирование первичных и вторичных аминов с ангидридами и галогенангидридами приводит к замещению водородного атома аминогруппы ацильным остатком:этилацетиламин хлористый этилацетиламмоний  этилацетиламин А 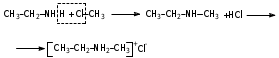 лкилирование осуществляется при взаимодействии с галогенпроизводными: лкилирование осуществляется при взаимодействии с галогенпроизводными:метилэтиламин хлористый метилэтиламмоний 4. Азотистая кислота переводит первичные амины в спирты, вторичные в нитрозоамины; третичные амины с азотистой кислотой не реагируют: 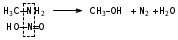 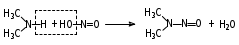 метанол метанолдиметилнитрозоамин 2.4. Способы получения. 1  . Пропускание паров спиртов и аммиака над катализатором Al2O3 при температуре 300С: . Пропускание паров спиртов и аммиака над катализатором Al2O3 при температуре 300С:2 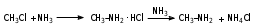 . Действием аммиака на галогензамещённые (реакция Гофмана) получают соли, затем дальнейшим воздействием аммиака – вторичные и третичные амины: . Действием аммиака на галогензамещённые (реакция Гофмана) получают соли, затем дальнейшим воздействием аммиака – вторичные и третичные амины: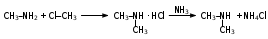 хлористый метиламмоний хлористый метиламмоний х  лористый диметиламмоний лористый диметиламмонийхлористый диметилэтиламмоний 3  . Восстановление нитросоединений в присутствии катализаторов (Pt, Pd): . Восстановление нитросоединений в присутствии катализаторов (Pt, Pd):2-нитропропан 2-аминопропан 2.5. Применение. Простейшие алифатические амины – метиламин, диметиламин, диэтиламин – находят применение при синтезе лекарственных веществ, ускорителей вулканизации, ПАВ и других продуктов органического синтеза. С 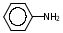 оли третичных аминов и четвертичных аммониевых оснований с радикалами из высших алканов обладают сильными бактерицидными свойствами. оли третичных аминов и четвертичных аммониевых оснований с радикалами из высших алканов обладают сильными бактерицидными свойствами.Анилин – важнейший из ароматических аминов, применяется для изготовления анилиновых красителей. Диамины путресцин NH2 – CH2 – CH2 – CH2 – CH2 – NH2 и кадаверин NH2 – CH2 – CH2 – CH2 – CH2 – СН2 – NH2 являются трупными ядами (латинское cadaver – труп), они образуются при гниении белков. 3. Амиды кислот А 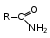 миды кислот – продукты замещения гидроксильной группы карбоновых кислот аминогруппой (или атома водорода в аммиаке ацильной группой): миды кислот – продукты замещения гидроксильной группы карбоновых кислот аминогруппой (или атома водорода в аммиаке ацильной группой): 3.1. Номенклатура. Название амидов производят от систематического названия соответствующей кислоты замещением окончания –овая на –амид. По рациональной номенклатуре к слову амид добавляют тривиальное название кислоты: а  мид масляной кислоты мид масляной кислотыб 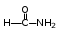 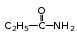 утанамид утанамидамид муравьиной кислоты амид пропионовой кислоты  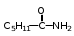 формамид пропионамид формамид пропионамидамид уксусной кислоты амид капроновой кислоты ацетамид капрамид Соединения, содержащие в молекуле группу – NH – , связанную с двумя ацильными радикалами, называют имидами. Изомерия амидов зависит от строения углеродной цепи, связанной с амидной группой (–СОNH2). 3.2. Физические свойства Амиды кислот – кристаллические вещества (исключение – жидкий формамид – амид муравьиной кислоты). Низшие амиды хорошо растворимы в воде. Растворы имеют нейтральную реакцию. 3.3. Химические свойства 1 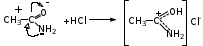 ) Амиды, в отличие от аммиака, почти лишены основных свойств, они дают соли только с сильными кислотами. Это объясняется влиянием карбонильной группы, которая смещает свободную пару электронов от атома азота: ) Амиды, в отличие от аммиака, почти лишены основных свойств, они дают соли только с сильными кислотами. Это объясняется влиянием карбонильной группы, которая смещает свободную пару электронов от атома азота:2  ) Водород аминогруппы способен замещаться на металл. В этом проявляются кислотные свойства амидов. ) Водород аминогруппы способен замещаться на металл. В этом проявляются кислотные свойства амидов.меркурацил имид Циклические амиды (имиды) обладают более кислотным характером: 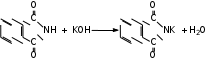 3 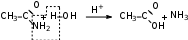 ) Под действием воды в кислых или щелочных средах амиды гидролизуются с образованием кислот: ) Под действием воды в кислых или щелочных средах амиды гидролизуются с образованием кислот:4  ) При восстановлении амидов (например, действием LiAlH4) получают амины: ) При восстановлении амидов (например, действием LiAlH4) получают амины:этиламин 5) Действие азотистой кислоты сопровождается выделением азота и образованием карбоновых кислот:  3.4. Способы получения Амиды кислот получают действием аммиака на галогенангидриды, ангидриды или сложные эфиры:     Карбамид (диамид угольной кислоты, мочевина) – кристаллическое вещество с температурой плавления 133 С, легко растворяется в воде, труднее в спирте, не растворяется в эфире, углеводородах. М 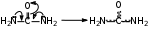 олекула мочевины имеет плоское строение: олекула мочевины имеет плоское строение:Перераспределением электронной плотности в молекуле объясняется слабая основность мочевины, несмотря на формальное присутствие двух NH2-групп. М 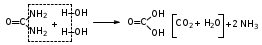 очевина имеет обычные свойства амида – гидролизуется при нагревании как в кислой, так и в щелочной средах: очевина имеет обычные свойства амида – гидролизуется при нагревании как в кислой, так и в щелочной средах: мочевина угольная кислота Гидролиз мочевины происходит и ферментативно под действием фермента уреазы. Азотистая кислота разлагает карбамид с выделением азота (реакция А.П. Бородина). Эта реакция используется в клиническом анализе: 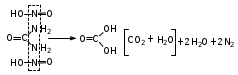 При действии на мочевину ацилирующих средств водород группы -NH2 замещается ацилом, в результате чего образуются уреиды: H  2N – CO – NH2 + (CH3–CO)2O H2N – CO – NH – CO – CH3 + CH3COOH 2N – CO – NH2 + (CH3–CO)2O H2N – CO – NH – CO – CH3 + CH3COOHуреид уксусной кислоты Уреиды некоторых кислот используются как лекарственные вещества (снотворные). П 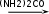 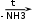 ри нагревании выше температуры плавления карбамид разлагается, давая циановую кислоту, которая, взаимодействуя с оставшейся мочевиной, образует биурет: ри нагревании выше температуры плавления карбамид разлагается, давая циановую кислоту, которая, взаимодействуя с оставшейся мочевиной, образует биурет:H2N – CO – NH2 H – O – C N H2N – CO – NH – CO – NH2 мочевина циановая кислота биурет П 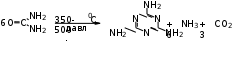 ри высоком нагревании и давлении карбамид превращается в циклическое вещество – меламин (2,4,6-триамино-1,3,5-триазин): ри высоком нагревании и давлении карбамид превращается в циклическое вещество – меламин (2,4,6-триамино-1,3,5-триазин):Меламин применяют для производства меламиноальдегидных полимеров, лаков и клеев, обладающих высокой механической прочностью, водо- и термостойкостью. Используют в качестве дубителя. Карбамид находит широкое применение в органическом синтезе для получения полимеров, лекарственных препаратов, гербицидов и других веществ. В промышленности мочевину получают нагреванием под давлением смеси СО2 и NH3:   карбамат аммония карбамид (аммиачная соль карбамида) Мочевину получают также действием воды на цианамид и при реакции фосгена с аммиаком: H  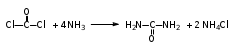 2N – C N + H2O H2N – CO – NH2 2N – C N + H2O H2N – CO – NH2Мочевина является основным продуктом дезассимиляции азотсодержащих веществ в животных организмах. В последнее время она нашла широкое применение в качестве пролонгированного азотного удобрения и добавок к кормам жвачных животных как дополнительный источник небелкового азота. Имин мочевины носит название гуанидина и встречается в природе в виде солей, хорошо растворимых в воде. Фрагмент гуанидина входит в состав и других более сложных соединений, например аргинина. Вопросы и задания. Объясните строение амидов кислот. Напишите уравнения реакций получения мочевины. Перечислите основные свойства мочевины и её применение. Вычислите массовую долю (%) азота в карбамиде. Почему карбамид может служить ценным азотным удобрением? 4. Аминокислоты. Аминокислотами называются соединения, содержащие одновременно амино- и карбоксильную группу: 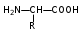 4.1. Номенклатура и изомерия. Обычно аминокислоты носят тривиальные названия. По рациональной номенклатуре их названия строятся прибавлением к тривиальному названию кислоты приставки амино- и буквы греческого алфавита, указывающего положение аминогруппы по отношению к карбоксилу. П 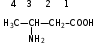 о систематической номенклатуре указывается адрес аминогруппы цифрой, приставка амино-, длина углеродной цепи и окончание –овая кислота. о систематической номенклатуре указывается адрес аминогруппы цифрой, приставка амино-, длина углеродной цепи и окончание –овая кислота.-амино-масляная кислота 3-аминобутановая кислота По числу карбоксильных и аминогрупп, а также в зависимости от радикала аминокислоты подразделяются: 1 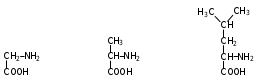 . Моноамино-монокарбоновые кислоты. К ним относятся кислоты с одной аминной и одной карбоксильной группами (в том числе соединения, содержащие атом серы и оксогруппу): . Моноамино-монокарбоновые кислоты. К ним относятся кислоты с одной аминной и одной карбоксильной группами (в том числе соединения, содержащие атом серы и оксогруппу):глицин аланин лейцин (-аминоуксусная (-аминопропионовая (-аминоизокапроновая кислота) кислота) кислота)  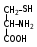 серин цистеин (-амино--окси- (-амино--тио- пропионовая кислота) пропионовая кислота) 2 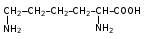  . Диамино-монокарбоновые кислоты. Содержат в молекуле одну карбоксильную и две аминогруппы: . Диамино-монокарбоновые кислоты. Содержат в молекуле одну карбоксильную и две аминогруппы:орнитин (,-диаминовалериановая лизин (,-диаминокапроновая кислота) кислота) 3   . Моноамино-дикарбоновые кислоты. Содержат одну аминогруппу и два карбоксила: . Моноамино-дикарбоновые кислоты. Содержат одну аминогруппу и два карбоксила:  L-аспарагиновая L,-аспарагин L-глутаминовая L,-глутамин (-аминоянтарная) кислота (-аминоглутаровая) кислота 4 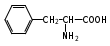 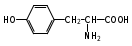 . Ароматические аминокислоты имеют в своём составе ароматическое ядро: . Ароматические аминокислоты имеют в своём составе ароматическое ядро:фенилаланин тирозин -амино--фенилпропионовая -амино--(п-оксифенил)пропионовая кислота кислота 5 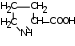  . Гетероциклические аминокислоты содержат ядро гетероцикла: . Гетероциклические аминокислоты содержат ядро гетероцикла:пролин триптофан -пирролидин карбоновая кислота -амино--(3-индолил) пропионовая кислота Аминокислоты подразделяют также на протеиногенные (входящие в состав белков) и непротеиногенные; на незаменимые, которые синтезируются только в растениях, и заменимые, синтезирующиеся и в растениях, и в животных организмах. И 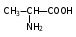 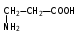 зомерия аминокислот зависит от степени разветвления углеродного скелета и от взаимного расположения аминогруппы и карбоксила (делятся на -, -, - и т.д. аминокислоты): зомерия аминокислот зависит от степени разветвления углеродного скелета и от взаимного расположения аминогруппы и карбоксила (делятся на -, -, - и т.д. аминокислоты):-аминопропионовая кислота -аминопропионовая кислота (-аланин) (-аланин) В белках наиболее распространены -аминокислоты, и редко встречаются -аминокислоты. М  ногие аминокислоты содержат асимметрический атом углерода, т.е. имеют оптические изомеры. Это можно продемонстрировать на примере существующей в двух изомерных формах -аминопропионовой кислоты: ногие аминокислоты содержат асимметрический атом углерода, т.е. имеют оптические изомеры. Это можно продемонстрировать на примере существующей в двух изомерных формах -аминопропионовой кислоты:D(-)-аланин L(+)-аланин В природе распространены аминокислоты L-ряда. Синтетически полученные аминокислоты имеют и D- и L-строение. Организмы человека и животных способны усваивать только L-аминокислоты. -Аминокислоты играют важнейшую роль в процессах жизнедеятельности живых организмов, так как они являются теми соединениями, из которых строится молекула любого белка. Природные аминокислоты могут быть получены при гидролизе белковых веществ животного и растительного происхождения. 4.2. Физические свойства. Аминокислоты – бесцветные кристаллические вещества с высокой температурой плавления (около 300 С). Большинство аминокислот хорошо растворяются в воде. Наиболее распространённые в природе L-аминокислоты безвкусные или горькие соединения, а D-аминокислоты – обычно сладкие. Аминокислоты содержат одновременно основную аминную и кислую карбоксильную группы. Поэтому они могут давать соли как с основаниями, так и с кислотами, т.е. являются амфотерными соединениями: Cl-[NH3+CH2COOH] [H2NCH2COO-]Na+ хлоргидрат глицина натриевая соль глицина Водные растворы одноосновных моноаминокислот имеют почти нейтральную реакцию. В свободном состоянии в аминокислоте карбоксил и аминогруппа взаимодействуют между собой, образуя внутренние соли, и молекула превращается в биполярный ион: + –  H  2N – CH2 – COOH H3N – CH2 – COO 2N – CH2 – COOH H3N – CH2 – COO4.3. Химические свойства. Аминокислоты проявляют свойства, характерные как для кислот, так и для аминов. Кроме того, аминокислоты обладают специфическими свойствами, характерными для соединений с двумя различными по своей природе функциональными группами I. Реакции карбоксильной группы. 1. Образование солей с основаниями. H2N – CH2 – COOH + NaOH H2N – CH2 – COONa + H2O глицинат натрия К 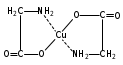 роме обычных солей аминокислоты могут образовывать внутрикомплексные соли с катионами тяжёлых металлов. Для всех -аминокислот очень характерны красиво кристаллизующиеся, интенсивно окрашенные в синий цвет внутрикомплексные (хелатные) соли меди: роме обычных солей аминокислоты могут образовывать внутрикомплексные соли с катионами тяжёлых металлов. Для всех -аминокислот очень характерны красиво кристаллизующиеся, интенсивно окрашенные в синий цвет внутрикомплексные (хелатные) соли меди:медная соль глицина 2. Образование эфиров. Эфиры аминокислот получают действуя спиртом в присутствии HCl: H 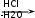 2N – CH2 – COOH + C2H5OH NH2 – CH2 – COOC2H5 2N – CH2 – COOH + C2H5OH NH2 – CH2 – COOC2H5этиловый эфир глицина II. Реакции аминогруппы. 1. Образование солей с кислотами: H2N – CH2 – COOH + HCl [H3N+ – CH2 – COOH]Cl- гидрохлорид глицина 2. Действие азотистой кислоты. При реакции образуются оксикислоты и выделяются азот и вода: H2N – CH2 – COOH + HONO HO – CH2 – COOH + N2 + H2O гликолевая кислота Этой реакцией пользуются для количественного определения аминных групп в аминокислотах, а также в белках и продуктах их распада. III. Реакции, характерные для -аминокислот. 1  . Реакция декарбоксилирования. При отщеплении СО2 под действием особых ферментов – декарбоксилаз или некоторых микроорганизмов -аминокислоты превращаются в амины: . Реакция декарбоксилирования. При отщеплении СО2 под действием особых ферментов – декарбоксилаз или некоторых микроорганизмов -аминокислоты превращаются в амины:аминопропионовая кислота аминоэтан Так, лизин и орнитин, декарбоксилируясь при гниении белков, образуют диамины путресцин и кадаверин. 2  . Реакция дезаминирования: . Реакция дезаминирования:-аминопропионовая -оксопропионовая кислота кислота 3. Реакция переаминирования: 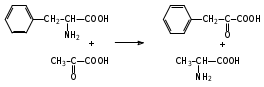 Реакции дезаминирования, декарбоксилирования и переаминирования могут протекать в животных и растительных организмах в очень мягких условиях под действием специфических ферментов. IV. Превращения аминокислот при нагревании. 1  . При нагревании -аминокислоты образуют циклические дикетопиперазины: . При нагревании -аминокислоты образуют циклические дикетопиперазины:-аминопропионовая кислота 2,5-диметилдикетопиперазин 2  . -аминокислоты превращаются в непредельные карбоновые кислоты: . -аминокислоты превращаются в непредельные карбоновые кислоты:-аминомасляная кислота кротоновая кислота 3 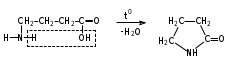 . - и -аминокислоты способны, теряя молекулу воды из обеих функциональных групп, образовывать внутренние эфиры, называемые лактамами: . - и -аминокислоты способны, теряя молекулу воды из обеих функциональных групп, образовывать внутренние эфиры, называемые лактамами:-аминомасляная кислота -лактам аминомасляной кислоты Таким образом, по получаемым продуктам при нагревании аминокислот можно установить положение аминогруппы в её молекуле. 4.4. Способы получения. 1. Замена галогена в галогензамещённых кислотах на аминогруппу при действии избытка аммиака (Э. Фишер): ClCH2 – COOH + 2NH3 H2NCH2 – COOH + NH4Cl хлоруксусная кислота глицин В настоящее время этот метод является основным промышленным методом синтеза -аминокислот. 2 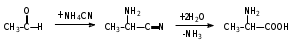 . Взаимодействие альдегидов и кетонов с синильной кислотой или её солями (циангидринный синтез Зелинского): . Взаимодействие альдегидов и кетонов с синильной кислотой или её солями (циангидринный синтез Зелинского):этаналь аминонитрил аланин 3  . Восстановление -нитрокислот: . Восстановление -нитрокислот:валин 4 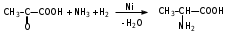 . Каталитическое восстановление оксокарбоновых кислот водородом в присутствии аммиака: . Каталитическое восстановление оксокарбоновых кислот водородом в присутствии аммиака:пировиноградная кислота аланин 5. Присоединение аммиака к ,-ненасыщенным кислотам. При этом образуются -аминокислоты: CH2 = CH – COOH + NH3 H2N – CH2 – CH2 – COOH кротоновая кислота -аминомасляная кислота 6. Кроме химических методов синтеза используют и биотехнологические приёмы. Освоены производства глутаминовой и аспарагиновой кислот, треонина, аланина, триптофана, метионина и лизина с использованием в качестве сырья крахмала и патоки. С этой же целью реализовано производство микробиальной биомассы из кератинсодержащего сырья (рога, копыта, перо). 5. Белки Высокомолекулярные соединения, построенные из аминокислотных остатков, называются белками. Белки входят в состав всех живых организмов, но особо важную роль они играют в животных организмах, которые состоят главным образом из тех или иных форм белков. Мышцы, покровные ткани, внутренние органы, хрящи, кровь — все это белковые вещества. Растения синтезируют белки (и их составные части — -аминокислоты) из СО2 и Н2О за счет фотосинтеза, усваивая остальные элементы белков (N, Р, S, Fе, Мg) из растворимых солей, находящихся в почве. В последние годы доказано, что растения могут усваивать и непосредственно азот атмосферы. Животные организмы в основном получают готовые аминокислоты с пищей и на их базе строят белки своего организма. Ряд аминокислот (заменимые аминокислоты) может синтезироваться непосредственно животными организмами. Белки представляют собой биополимеры -аминокислот. Если при гидролизе белковые вещества распадаются в конечном итоге до аминокислот, такие белки называют простыми белками, или протеинами. Но существуют и сложные белки, или протеиды, в состав которых входят остатки соединений, принадлежащих к иным классам органических и неорганических веществ (простетические группы). Несмотря на внешнее несходство, различные представители белков имеют некоторые общие свойства. Так, растворы всех белков имеют коллоидный характер. При повышении температуры, действии ультрафиолетового излучения или радиации, под влиянием кислот, щелочей и других реагентов происходят изменения физико-химических свойств белков, называемые денатурацией. При этом теряется биологическая активность. Белковые вещества осаждаются кислотами и солями многих тяжёлых металлов. Наиболее характерными качественными реакциями на белки являются: 1) биуретовая реакция — появление фиолетового окрашивания при обработке солями меди в щелочной среде (ее дают все белки); 2) ксантопротеиновая реакция — появление при действии концентрированной азотной кислоты желтого окрашивания, переходящего при действии аммиака в оранжевое (ее дают не все белки); 3) реакция Миллона — кипячение раствора белка с раствором нитрата ртути в смеси азотной и азотистой кислот приводит к выпадению красно-коричневого осадка (реакция на тирозин); 4) нингидринная реакция — появление синего окрашивания при кипячении с водным раствором нингидрина (на все белки). Главной составной частью белковых веществ являются двадцать -аминокислот. Все белковые аминокислоты, за исключением простейшей - -аминоуксусной кислоты, имеют в молекуле асимметрический атом углерода. В белках аминокислоты присутствуют в оптически активной форме, причём все они по конфигурации относятся к L-ряду. 5.1. Пептиды и пептидная связь. М 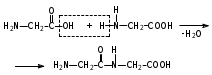 олекулы аминокислот связаны в белках по амидному типу. Амидные связи этого типа называются пептидными связями, а низкомолекулярные соединения, в которых аминокислоты соединены друг с другом пептидными связями, называют пептидами (или полипептидами): олекулы аминокислот связаны в белках по амидному типу. Амидные связи этого типа называются пептидными связями, а низкомолекулярные соединения, в которых аминокислоты соединены друг с другом пептидными связями, называют пептидами (или полипептидами): пептидная связь Пептиды образуются при частичном гидролизе белков. В зависимости от числа аминокислотных остатков, входящих в молекулу полипептида, различают дипептиды, трипептиды, тетрапептиды и т. д. Характерную для пептидов группировку —СО—NH— называют пептидной. Названия полипептидов производят от названий остатков аминокислот, прореагировавших своими карбоксильными группами, и от названия аминокислоты, реагирующей своей аминогруппой и сохраняющей свободную карбоксильную группу: H2N – CH2 – CO – NH – CH(CH3) – COOH глицилаланин (Н-гли-ала-ОН) NH2 – CH(CH3) – CO – NH – CH2 – CO – NH – CH2 – COOH аланилглицилглицин (Н-ала-гли-гли-ОН) Разработано много методов превращения -аминокислот в пептиды и синтезированы простейшие природные белки — инсулин, рибонуклеаза, вазопрессин, окситоцин и др. Для того чтобы соединить две аминокислоты пептидной связью, например, получить аланилглицин, необходимо: а) закрыть (защитить) карбоксильную группу глицина и аминогруппу аланина, чтобы не произошло нежелательных реакций по этим группам; б) образовать пептидную связь; в) снять защитные группы. Защитные группы должны надежно закрывать аминную и карбоксильную группы в процессе синтеза и потом легко сниматься без разрушения пептидной связи. З 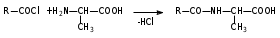 ащита аминогруппы наиболее просто проводится ацилированием: ащита аминогруппы наиболее просто проводится ацилированием:ацилаланин Карбоксильную группу для защиты превращают в сложно-эфирную: H2N – CH2 – COOH + HOR H2N – CH2 – COOR + HCl Д 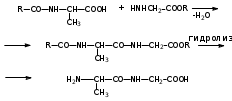 ля образования пептидной связи проводят конденсацию в присутствии сильных водоотнимающих веществ: ля образования пептидной связи проводят конденсацию в присутствии сильных водоотнимающих веществ:Затем снимают защитные группы в таких условиях, чтобы не затрагивалась пептидная связь. Таким образом можно синтезировать не только ди-, но и три- и тетрапептиды и т. д. Белок инсулин состоит из 51 аминокислоты, рибонуклеаза из 124 аминокислот. Главная причина разнообразия белков по сравнению, например, с полисахаридами, заключается в том, что в состав макромолекул белка могут входить около 20 различных аминокислот, в то время как полисахариды (целлюлоза, крахмал) построены из одного моносахарида – глюкозы. 5.2. Строение белковых молекул. Аминокислотный состав и последовательность связи аминокислот в молекуле белка определяют его первичную структуру. Так, например, первичная структура одного из белковых гормонов – окситоцина выражается следующей схемой:  H2N – цис – тир – изолей – глу – асп – цис – про – лей – гли – ОН Особый характер белка каждого вида связан не только с длиной, составом и строением входящих в его молекулу полипептидных цепей, но также и с тем способом, которым эти полипептидные цепи ориентируются в специфические формы. Существенное значение имеет пространственная форма белковой молекулы. В 1952 г. Л. Полинг показал, что наиболее выгодным расположением, которое осуществляется во многих пептидах и белках, является -спираль. Пептидные цепи -спирали свернуты таким образом, что возможно образование водородных связей между амидными водородными атомами и карбонильными группами, разделенными тремя-четырьмя аминокислотными фрагментами. Водородные связи почти параллельны основной оси спирали, а расстояние между витками составляет около 0,55 нм.  На один виток -спирали приходится около 3,6 остатка аминокислот. Боковые цепи аминокислот лежат на внешней стороне -спирали. Однако пространственные затруднения, возникающие между боковыми группами некоторых аминокислот, могут существенно деформировать нормальную -спираль и вызвать изгиб цепи. Вторичную структуру -спирали имеют, например, миозин и -кератин. Следовательно, вторичная структура определяется способом, которым скручена цепь – в частности, -спираль. Третичная структура — это способ, которым свернутая в спираль цепь изогнута и гидратирована в природном (нативном) белке. Для молекул белков, состоящих из нескольких полипептидных цепей, рассматривают и так называемые четвертичные структуры, определяющие тип взаимодействия между отдельными цепями. Общей формой четвертичной структуры обладают волокнистые белки (волосы, шерсть). Эта структура состоит из шести белковых цепей, каждая из которых имеет форму -спирали, закрученной вокруг центральной спиралеобразной белковой молекулы. В результате образуется веревкообразная структура. Биологическая активность белков нередко тесно связана с высокой организацией структуры, и живые организмы синтезируют белки требуемой конформации, которая часто оказывается не устойчивой. Под влиянием нагревания, крайних значений рН или многих химических реагентов белки часто теряют свою биологически необходимую конформацию, превращаясь в случайные неорганизованные структурные единицы и утрачивая биологическую активность. Такой процесс называется денатурацией. Наиболее известный пример — изменение структуры яичного белка при нагревании и структуры мяса в процессе приготовления. В последнем случае кулинарная обработка приводит к значительному облегчению процесса переваривания мяса, поскольку при денатурации освобождаются белковые связи, которые в сыром мясе труднодоступны для протеолитических ферментов пищеварительного тракта. Белки играют важную биологическую роль. Они служат основным веществом, из которого построены клетки животных и растительных организмов. Белки участвуют в важнейших процессах жизнедеятельности организма — строительных, каталитических, энергетических, обменных, защитных и многих других. Белки входят в состав ферментов, гормонов, нуклеотидов. Кроме того, они являются необходимой составной частью пищевого рациона человека и животных. Суточная потребность взрослого человека в белках — 70—80 г. Вопросы и задания. 1. Какие органические соединения называют аминокислотами? 2. Напишите формулы структурных изомеров аминокислот состава С4H9O2N и укажите эти изомеры. 3. Расскажите о физических свойствах аминокислот. Почему водный раствор аминокислот практически нейтрален? 4. Приведите примеры химических реакций, показывающих двойственную природу аминокислот. 5. Что означают первичная, вторичная, третичная и четвертичная структуры белка? 6. Что происходит при нагревании следующих аминокислот: а) - и -аминопропионовых; б) -, - и -аминомасляных; в) - и -аминоизомасляных? 7. Напишите структурные формулы следующих пептидов: а) глицил-ала-нина, б) валил-аланил-глицина; в) глицил-аланил-лейцина. Вопросы для самоподготовки к главе «Органические соединения азота» Классификация, номенклатура, изомерия аминов. Способы получения аминов. Физические свойства аминов. Химические свойства аминов. Амины – органические основания. Свойства, получение, применение анилина, сульфаниловой кислоты, нафтиламина, дифениламина. Классификация, номенклатура, изомерия амидов. Способы получения амидов. Химические свойства амидов. Свойства, способы получения, применение мочевины. Пестициды – производные мочевины, их токсичность, опасность для окружающей среды. Классификация, номенклатура, изомерия аминокислот. Способы получения аминокислот. Физические свойства аминокислот. Химические свойства аминокислот. Одноосновные моноаминокислоты, входящие в состав белков. Двухосновные моноаминокислоты, одноосновные диаминокислоты, входящие в состав белков. Серусодержащие, ароматические аминокислоты, входящие в состав белков. Белковые вещества. Строение белков. Пептидная связь. Строение белковых молекул. Пищевое и промышленное использование белков. Заменимые и незаменимые аминокислоты. |
