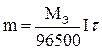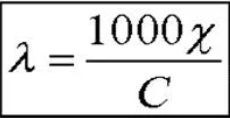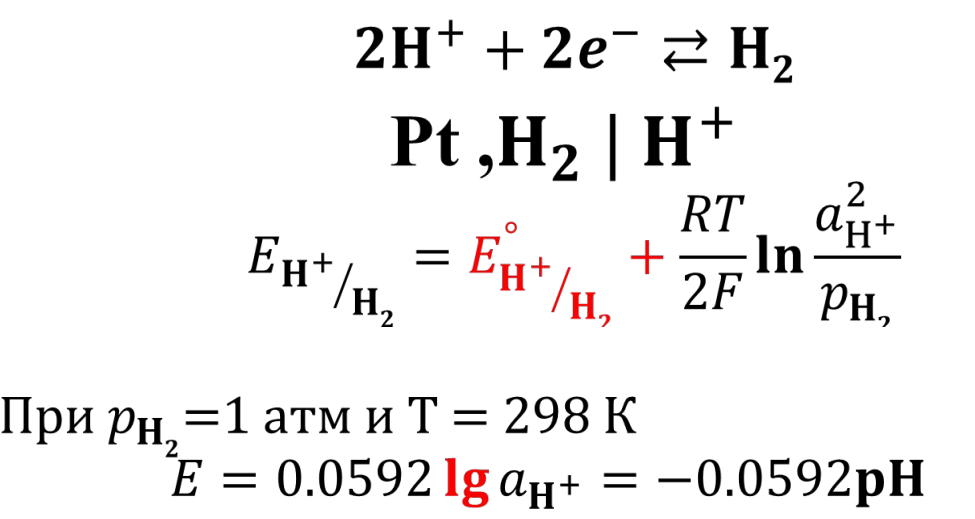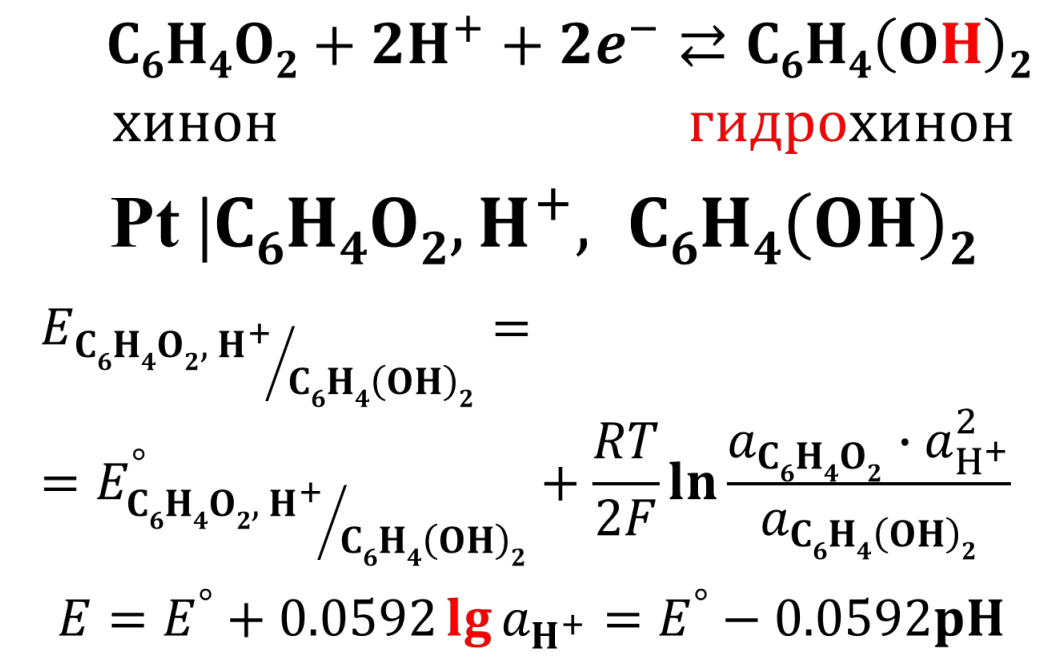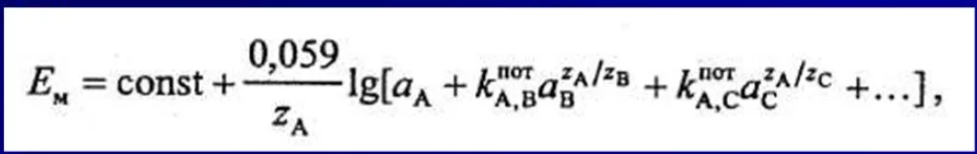аналитика. колоток 2. Основные законы физики Фарадея, Ома и Фика. Первый закон Фарадея
 Скачать 0.97 Mb. Скачать 0.97 Mb.
|
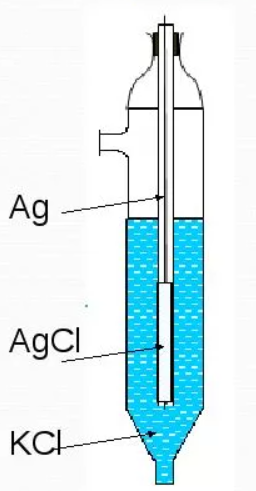
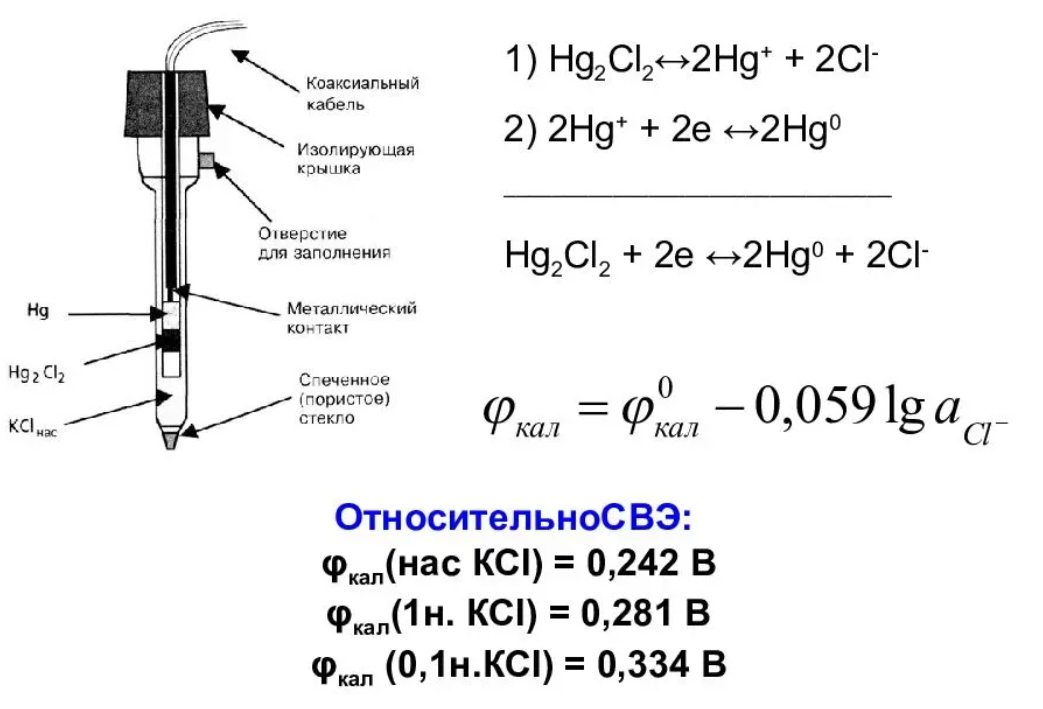
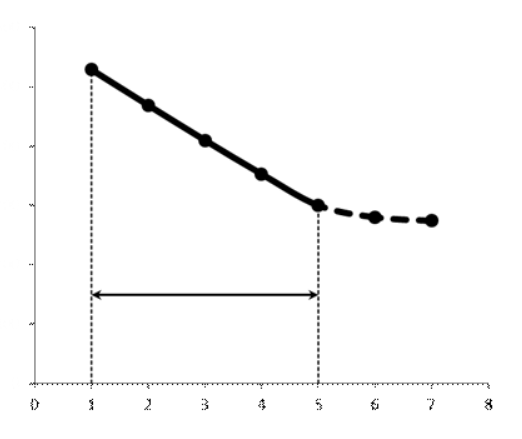
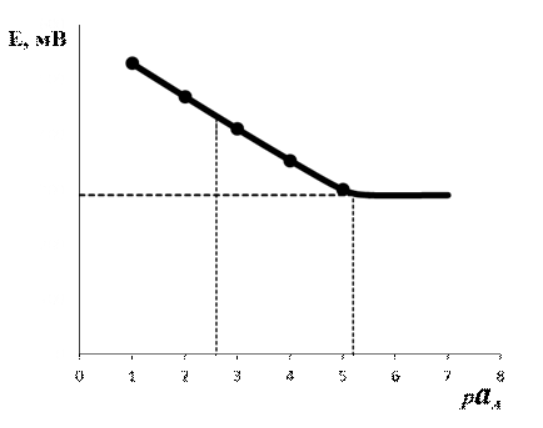
10^-5- 10^-7 М, т.е. значительно меньшей, чем рассчитанная из литературных данных о растворимости фторида лантана. Это свойственно и другим электродам на основе моно- и поликристаллов. Существенно мешают определению аF- только катионы, дающие комплексы с фторидами (Al3+, Fe3+, Ce4+, Li+, Th4+) и анионы OH-. Применяют лантанфторидный электрод для определения произведений растворимости, определение ионов F- в различных жидких средах и твердых веществах, для анализа биологических материалов, сточных вод, минеральных удобрений, фармацевтических средств.Основные законы физики: Фарадея, Ома и Фика. Поляризация электродов. Концентрационная и эл/хим поляризации. Напряжение разложения электролита при электролизе его водного раствора на инертных электродах. Перенапряжение. Электрическая проводимость растворов. Удельная и эквивалентная проводимость. Подвижности ионов. Факторы, влияющие на электрическую проводимость растворов: природа растворителя, концентрация электролита, температура. Классификация эл/хим методов анализа. Потенциометрический метод анализа. 2) Электроды с жесткой матрицей. Стеклянная мембрана, внутри электрода внутренний хлорсеребреный электрод сравнения, который помещен в насыщенный раствор хлорида серебра и 0,1 М соляная кислота. - Окислители и восстановители не оказывают существенного влияния на потенциал электрода. - Пригоден для измерения рН в широком интервале. - Обладает малым временем отклика. - Хорошо работает в физиологических системах. - Не загрязняет исследуемый раствор аналита посторонними веществами. - Имеет различные варианты конструкций. С помощью данного вида электродов определяют рН растворов. Существуют стеклянные электроды, которые позволяют определить концентрацию ионов Na+, K+. В основе теории стеклянного электрода лежит представление о том, что стекло - это ионообменник, который может вступать в ионообменное взаимодействие с раствором. Стекло при этом рассматривается как твердый электролит. Стекло, состоящее из окислов натрия, кальция, кремния, обладает резко выраженным специфическим сродством к ионам Н+. Вследствие этого при соприкосновении с водными растворами в поверхностном слое стекол образуется слой, в котором ионы Na+ оказываются почти полностью замещенными на ионы Н+. Поэтому мембранный электрод, изготовленный из такого стекла, обладает Н+ -функцией. Введение в состав стекла окислов бария, цезия, лантана и замена натрия на литий значительно расширяет диапазон Н+ -функции стеклянного электрода. Введение же окислов алюминия и бора значительно снижают Н+ -функции стеклянного электрода. Таким путем удалось создать ионселективные стеклянные электроды для ионов Na+, K+, Li+, Ag+. Разрушение стекла водными растворами происходит в результате сорбции воды стеклом и глубокое ее проникновение в толщу. Коррозионному действию щелочных растворов, образующихся при экстракции щелочных компонентов стекла, подвергается и горловое стекло. Для защиты электрода от разрушения необходимо хранить его в воде, так как в воде происходит выщелачивание связанных ионными силами основных компонентов стекла и замена их ионами водорода, в результате чего на поверхности стекла образуется слой гидролизованного кремнезема, предохраняющий стекло от дальнейшего разрушения. 3 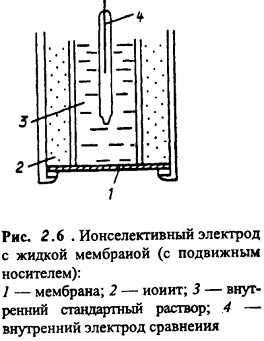 ) Электроды с подвижными носителями – раствор ионообменника или нейтральный переносчик в органическом растворителе, который удерживается на пористом полимере. Обладают потенциалом, устанавливающимся на поверхности между анализируемым раствором и несмешивающейся жидкости, селективно реагирующей с определяемым ионом. ) Электроды с подвижными носителями – раствор ионообменника или нейтральный переносчик в органическом растворителе, который удерживается на пористом полимере. Обладают потенциалом, устанавливающимся на поверхности между анализируемым раствором и несмешивающейся жидкости, селективно реагирующей с определяемым ионом.Ионит – эфир фосфорной кислоты с двумя алифатическими радикалами, растворенный в полярном растворителе. Молекула эфира содержит единственный способный к диссоциации протон ( то есть для клаьция понадобится две молекулы). Концентрация хлорида кальция во внутреннем растворе, контакирущем с ионитом, постоянна; в этот раствор погружен хлорсеребряный электрод сравнения. Анализируемый раствор отделяется от раствора сравнения, содержащего хлорид кальция, пористой мембраной, насыщенной ионитом. 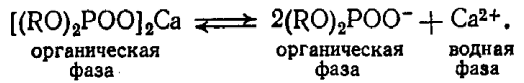 Кальциевый мембранный электрод – инструмент для физиологических исследований, так как кальций играет важную роль в нервной проводимости, формировании костей. Достоинства: 1.Высокая точность, высокая чувствительность 2.Возможность проводить титрования в более разбавленных растворах, чем это позволяют визуальные индикаторные методы. 3.Возможность определения этим методом нескольких веществ в одном растворе без предварительного разделения 4.Возможность титрования в мутных и окрашенных средах. 5.Значительно расширяется область практического применения потенциометрического титрования при использовании неводиых растворителей. Они позволяют, например, найти содержание компонентов, которые в водном растворе раздельно не титруются, провести анализ веществ, нерастворимых или разлагающихся воде. 6.Возможность автоматизировать процесс титрования. Недостатки: 1.Не всегда быстрое установление потенциала после добавления титранта 2.Необходимость во многих случаях делать при титровании большое число отсчетов. 4.3 Потенциометрическое титрование. Ячейка для потенциометрического титрования. Эл/хим индикаторная реакция. Способы обработки кривых потенциометрического титрования. Преимущества и недостатки потенциометрического способа фиксирования ктт. В отличие от прямых потенциометрических измерений метод потенциометрического титрования отличается большей точностью и воспроизводимостью результатов, хотя он и более трудоемок. В этом методе зависимость равновесного потенциала индикаторного электрода от состава раствора (описываемую уравнением Нернста) используют для нахождения точки эквивалентности. При потенциометрическом титровании измеряют электродный потенциал после добавления каждой порции титранта (R), который вступает с определяемым веществом (X) в химическую реакцию с образованием продуктов (Р): Из экспериментальных данных находят объем титранта, затраченный на достижение ТЭ, при этом применяют различные способы обработки данных потенциометрического титрования. Заметив объем, при котором наблюдается резкое изменение потенциала, проводят точное титрование, для чего прибавляют сразу почти весь необходимый объем титранта ( на 1,5-2 мл меньше), а затем добавляют его маленькими порциями до достижения резкого изменения потенциала и еще некоторый избыток. Методом численной интерполяции находим объем титранта, затраченный на достижение конечной точки. По полученным данным строят кривую титрования в интегральной ф 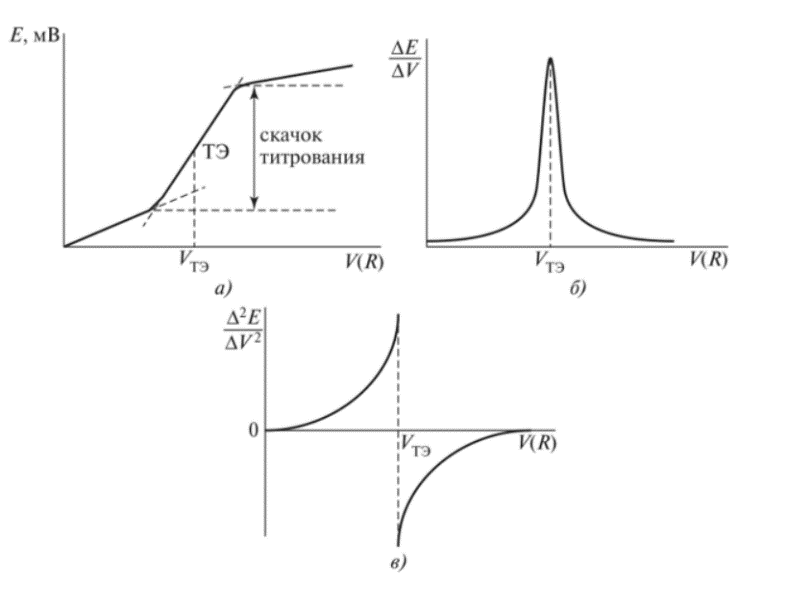 орме и находят ктт. орме и находят ктт. а) интегральная кривая б) первая производная в) вторая производная 4.4 Методы измерения ЭДС гальванических ячеек: компенсационный и некомпенсационный. Принципиальные схемы потенциометрических установок в обоих случаях. Стандартный элемент Вестона. Потенциометры, рН-метры, иономеры. Методы измерения ЭДС: основное условие – отсутствие тока. Компенсационный метод (схема Поггендорфа). Компенсационный метод измерений основан на компенсации измеряемого напряжения или эдс напряжением, создаваемым на известном сопротивлении током от вспомогательного источника. Применяют для измерений электрических величин (эдс, напряжений, токов, сопротивления); он широко применяется и для измерения др. физических величин (механических, световых, температуры и т.д.), которые обычно предварительно преобразуют в электрические величины. 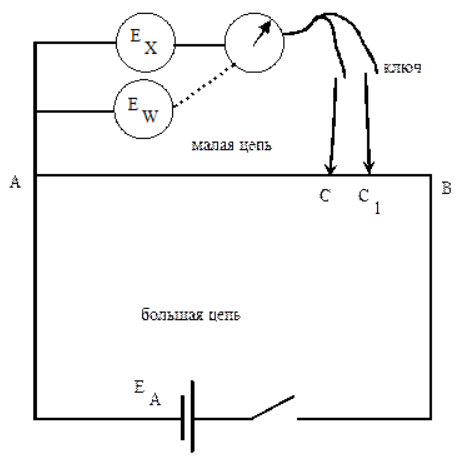 Стандартный элемент Вестона 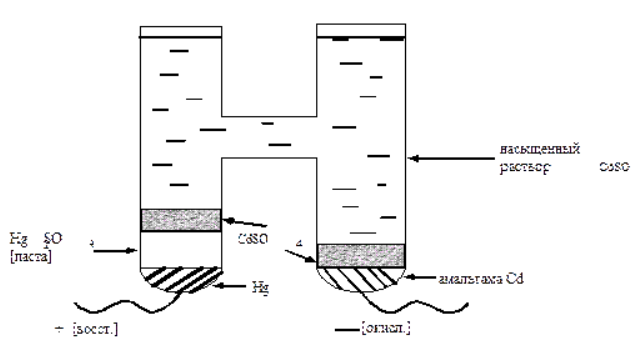 Некомпенсационный метод - определяют силу тока, протекающего в цепи ячейки потенциометрического титрования, которая пропорциональна ЭДС ячейки. Для установления потенциала точки эквивалентности используют электрод сравнения из того же материала, что и индикаторный, и погруженный в раствор, который не отличается от титруемого в конечной точке титрования. В процессе титрования происходит выравнивание состава обоих растворов, а ЭДС при этом постепенно уменьшается. В точке эквивалентности, когда значения потенциалов электродов становятся одинаковыми, ЭДС будет равна нулю. Этот момент устанавливают по прекращению отклонения стрелки прибора при кратковременном замыкании ключа во время титрования. Некомпенсационный способ потенциометрического титрования в различных вариантах применяют для массовых и экспресс- анализов с целью ускорения и упрощения методики потенциометрического титрования, т.е. там, где абсолютные значения потенциала индикаторного электрода не определяют. Ионометрия – способ определения концентрации ионов по измерению потенциала ионоселективного мембранного электрода.Современные приборы для прямой потенциометрии называют иономерами. Они могут быть использованы при наличии соответствующих индикаторных электродов для определения концентрации разных ионов. В настоящее время промышленностью выпускаются портативные иономеры (рН-метры), позволяющие проводить потенциометрические определения разных веществ как в лабораториях, так и в полевых условиях. Наиболее широкое применение нашла прямая потенциометрия для определения рН растворов с использованием стеклянно электрода. Перед работой стеклянный электрод выдерживают некоторое время в 0,1М растворе соляной кислоты. При измерении со стеклянным электродом рН-метр настраивают (градуируют) по буферным растворам с известными значениями рН. После настройки рН-метра электроды тщательно промывают, помещают их в анализируемый раствор и измеряют рН этого раствора при перемешивании. При использовании этого приема с другими электродами готовят ряд растворов с известными концентрациями анализируемых ионов. После измерений строят градуировочный график. Электрогравиметрический метод анализа. Реакции, происходящие на электродах при электролизе водных растворов. Требования к материалу электродов. Химические и физические условия электролиза. Влияние величины рН и присутствия комплексообразователей на потенциал выделения анализируемого компонента из раствора. Потенциал полного выделения. Электрогравиметрическое определение меди и свинца. Внутренний электролиз. Электрогравиметрический метод анализа основан на электролитическом выделении металлов и взвешивании полученного на электроде осадка металла. При этом металл может быть выделен как в элементарной форме на катоде в результате электровосстановительного процесса, так и в виде оксида на аноде в результате электроокислительного процесса. НА КАТОДЕ – ПРОЦЕСС ВОССТАНОВЛЕНИЯ, А НА АНОДЕ – ОКИСЛЕНИЯ. Требования к электродам: 1) не растворяются в процесс электролиза и в результате химического взаимодействия с компонентами раствора (с кислотами) 2) образующийся при электролизе осадок плотно удерживается на электроде 3) не взаимодействуют со средой при хранении. Физические условия электролиза: 1) Плотность тока. Чем больше плотность тока, тем больше в единицу времени выделяется определяемого металла (быстрее закончится электролиз). При слишком большой плотности тока осадок рыхлый и плохо держится на электроде. 2) Перемешивание. Ускоряет процесс электролиза. Химические условия: От этой величины зависит будет ли определяемый металл полностью выделен на электроде. 1) Кислотность раствора. Катионы серебра, меди (высокие значения потенциалов) можно вывести электролизом из кислого раствора. Никель и кадмий – из кислого раствора выделяется водород. В щелочной среде можно выделять активные металлы. При электролизе раствора сульфата меди добавляют деполяризатор, предотвращающий выделение водорода. 2) Комплексообразование. Скорость осаждения мала, но получаются гладкие и плотные осадки. Потенциал выделения – это потенциал, необходимый для начала выделения на электроде соответствующих ионов, или потенциал электрода в тот момент, когда достигается напряжение разложения и начинается электролиз. Потенциалы выделения металлов практически совпадают с равновесными потенциалами, то есть для многих металлов перенапряжение отсутствует, исключение составляют Fe, Co, Ni. Потенциал полного выделения – потенциал, который достигается, когда концентрация выделяемого вещества снижается до 10^-6. И электролиз считается завершенным. Определение меди. На аналитических весах с точностью до четвертого знака взять навеску сульфата меди (0,3 – 0,5 г), растворить в ячейке в 100 – 200 см3 воды. К полученному раствору добавить 30 – 40 см3 азотной кислоты (1:1). Поставить ячейку на столик магнитной мешалки. Опустить в раствор электроды так, чтобы они возвышались над уровнем раствора на 1 – 1,5 см. Опустить в ячейку стеклянную мешалку. Отрегулировать взаимное расположение электродов и мешалки. Мешалка при вращении не должна касаться электродов. Включить ток и с помощью реостата установить напряжение в пределах 2 – 2,5 В так, чтобы сила тока была 1,5 – 2 А. Время начала электролиза (включение тока) и силу тока записать в лабораторный журнал. Через 0,5 ч, не выключая тока, добавить к электролиту 3 см3 серной кислоты (1:1) и 30 см3 азотной кислоты (10%). После этого продолжить электролиз в течение еще 20 мин. По истечении времени, не выключая тока, поднять электроды из ячейки и опустить их в заранее приготовленный стакан с дистиллирован-ной водой. Затем выключить ток и промыть электроды в стакане со спиртом. Промытые электроды просушить на воздухе 10 мин и взвесить катод на аналитических весах. Вычислить количество выделившейся меди в граммах и процентное содержание меди в исходном образце. Сравнить результат с теоретически рассчитанным. Определение свинца. Навеску массой 0,5 г помещают в стакан вместимостью 250 см3, добавляют 15 см3 азотной кислоты, накрывают часовым стеклом, стеклянной или пластиковой пластинкой и растворяют при нагревании. После растворения сплава часовое стекло или пластинку и стенки стакана ополаскивают водой, раствор нагревают до кипения, добавляют 0,5 г сульфаминовой кислоты, разбавляют водой до 150 см3. В раствор погружают взвешенный анод и катод и проводят электролиз при силе тока 1,5 - 2 А при перемешивании раствора. Стакан с электролитом должен быть накрыт двумя половинками часового стекла, стеклянной или пластиковой пластинкой с прорезями для электродов и мешалки. Через 30 мин от начала электролиза снимают стекло или пластинку, ополаскивают водой и продолжают электролиз еще в течение 15 мин. Если после этого на свежепогруженной в раствор части анода не выделяется осадок, электролиз считают законченным. Не выключая тока, быстро удаляют стакан с электролитом и промывают электроды, подставляя по очереди три стакана с дистиллированной водой. Выключают ток, снимают анод с осадком двуокиси свинца, погружают в стакан с 200 см3 этилового спирта и высушивают его при температуре 160 - 170 °С до постоянной массы, охлаждают и взвешивают. Одна порция спирта может быть использована для промывки не более 20 электродов. М 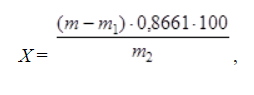 ассовую долю свинца (X) в процентах вычисляют по формуле ассовую долю свинца (X) в процентах вычисляют по формуле где m - масса анода с выделившимся осадком двуокиси свинца, г; m1 - масса анода, г; 0,8661 - коэффициент пересчета с двуокиси свинца на свинец; m2 - масса навески, г. Можно провести электролиз так, чтобы анализируемый раствор с погруженными в него электродами представлял собой гальванический элемент с собственным током, за счет которого и происходит электролитическое осаждение определяемого металла на взвешенном катоде. Такой метод, называемый внутренним электролизом, можно иллюстрировать следующим примером. В качестве примера рассмотрим определение меди методом внутреннего электролиза. Если в раствор CuSO4 поместить замкнутые накоротко платиновую сетку и цинковый стержень, то образуется гальванический элемент, в котором более активный металл отдает электроны и переходит в раствор: Zn – 2e = Zn2+ . Электроны переходят на платину и с нее передаются ионам меди, восстанавливая их: Cu2+ + 2e = Cu . В результате на платиновом катоде оседает металлическая медь, которую можно количественно определить по привесу электрода. К недостаткам метода следует отнести возможность восстановления анализируемого элемента непосредственно материалом анода, в нашем примере: Zn + Cu2+ = Zn2+ + Cu, что приводит к образованию слоя меди, пассивирующего анод, и к потерям меди на анодную реакцию. Этот процесс называется цементацией анода. Поскольку при цементации на катоде выделяется не вся медь, количественный анализ по привесу катода становится невозможным. Существуют различные методы борьбы с цементацией. Это, в частности, отделение раствора у катода (католита) от анолита с помощью полупроницаемых мембран, использование отдельных сосудов для катода и анода (соединенных солевым мостиком) и т.п. Необходимо также тщательно следить за надежностью электрических контактов, т.к. разрыв цепи немедленно влечет за собой выделение меди на цинковом электроде. По этой же причине, начав процесс, нельзя вынимать электроды из раствора. Достоинства метода внутреннего электролиза: а) не нужны специальные источники тока; б) слабые и равномерные токи электролиза приводят к образованию плотных и чистых осадков; в) на катоде можно выделять малые количества металлов; г) подбирая материал анода и состав раствора (pH, комплексообразователи), можно проводить разделение компонентов пробы и последовательно определять несколько ее компонентов. Существенно и то, что единственный анодный процесс – растворение анода, тогда как в обычном электролизе на аноде окисляются компоненты раствора, а продукты их окисления могут повлиять на ход анализа нежелательным образом. Вольтамперометрические методы. Классическая полярография. Принципиальная схема полярографической установки. Особенности электролиза на ртутном капающем электроде. Характеристика вольтамперной кривой: емкостный, фарадеевский, диффузионный и миграционный токи, потенциал начала разложения электролита и потенциал полуволны. Потенциал полуволны как характеристика природы деполяризатора. Зависимость диффузионного тока от концентрации деполяризатора (уравнения Ильковича). Полярографический фон и его значение. Преимущества и недостатки метода. Общая характеристика современных вариантов полярографии: полярография на твердых электродах, осциллографическая, импульсная, переменно-токовая полярография. Преимущества и недостатки методов. Инверсионная вольтамперометрия. Стадии осуществления эксперимента: предварительное накопление определяемого компонента, успокоение, растворения продуктов накопления. Формы вольтамперных кривых. Преимущества и недостатки метода. Амперометрическое титрования. Выбор потенциала индикаторного электрода по вольтамперным кривым. Возможные формы кривых титрования. Определение ктт. Кулонометрический анализ. Способы измерения количества электричества, прошедшего через раствор, кулонометры. Прямая кулонометрия в потенциостатическом режиме. Кулонометрическое титрование в амперостатическом режиме. Электрогенерирование кулонометрических титрантов. Принципиальная схема кулонометрической установки. Преимущества метода. Кондуктометрический анализ. Измерение электрической проводимости растворов. Принципиальная схема кондуктометрической установки. Прямая кондуктометрия и ее применение при контроле качества питьевой и дистиллированной воды. Кондуктометрическое титрование. Форма кривых кислотно-основного и осадительного титрования, определение ктт. |