Реферат на тему панкреатит. Острый панкреатит
 Скачать 329.23 Kb. Скачать 329.23 Kb.
|
|
Кировская государственная медицинская академия Министерство здравоохранения и федерального развития Российской Федерации РЕФЕРАТ На тему: «Острый панкреатит» Выполнила: Врач – лаборант клинической лаборатории Гудермесской ЦРБ Кимаева Мадина Амхадовна Гудермес - 2023 год. Оглавление: Главы: Актуальность проблемы…………………………………………………...3 Общие вопросы по проблеме: 2.1. Анатомо-физиологические аспекты………………………….3 2.2. Классификации………………………………………………….9 2.3. Современные теории этиопатогенеза………………………..11 2.4. Общая синдромология и семиотика…………………………19 2.5. Методы диагностики…………………………………………21 2.6. Дифференциальная диагностика…………………………….27 2.7. Современные методы лечения……………………………….30 2.8. Методы и средства реабилитации……………………………37 2.9. Исходы, осложнения, прогноз………………………………..37 2.10. Меры профилактики…………………………………………38 3. Выводы…………………………………………………………………….39 4. Список литературы……………………………………………………….40 Актуальность проблемы. Проблема острого панкреатита является одной из актуальнейших в экстренной хирургии. Это связано не только с тем, что заболевание очень распространено, но и с тем, что оно сложно в диагностике и в выборе лечебной тактики. Несмотря на то, что клиническая картина и характер морфологических изменений в поджелудочной железе при остром панкреатите описаны около 300 лет назад, и в последние годы возникают и исчезают различные концепции этиологии и патогенеза этого заболевания, предлагаются и отвергаются разнообразные тактико-технические направления лечения. В последние годы вопросы лечебной тактики у больных острым панкреатитом подверглись существенным изменениям: стала более целенаправленной и патогенетически обоснованной консервативная терапия, унифицированы показания к отдельным методам инструментальной диагностики и различным видам хирургических вмешательств. Более широкое применение получили прямые операции на поджелудочной железе при деструктивных формах острого панкреатита. Общие вопросы по проблеме: Анатомо-физиологические аспекты. Поджелудочная железа представляет собой образование треугольно-призматической формы. Тело её обычно имеет три отчётливо выраженные поверхности: переднюю, заднюю и нижню ю, головка и хвост - только две: переднюю и заднюю. На нижней поверхности головки по верхнему краю нижней горизонтальной части ДПК располагается крюковидный отросток. Масса - 70-90 г. Длина железы составляет в среднем 16-17см, ширина в области головки – 5 см, в области тела - 3,5 см, в области хвоста - 0,6-2 см. Расположена на уровне I L позвонка на границе брюшной полости и забрюшинного пространства, топографо-анатомически тесно связана с забрюшинными органами и сосудами: правыми почечными сосудами и началом воротной вены, верхними брыжеечными сосудами, аортой и началом грудного про тока, селезёночной и нижней брыжеечной венами, солнечным сплетением, левыми почкой, надпочечником и почечными сосудами. 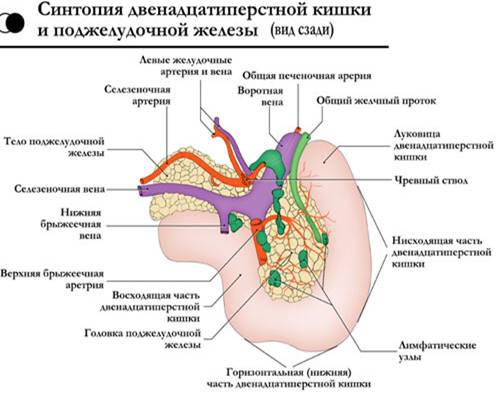 С 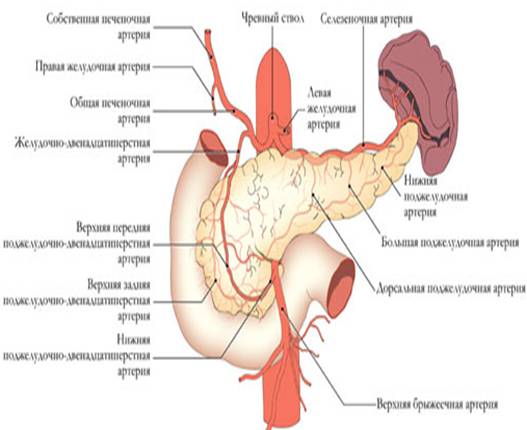 обственная фасция поджелудочной железы представляет собой полупрозрачную пластинку, которая неодинаково окружает её различные отделы. Головку эта фасция окружает со всех сторон и сращена с прилегающей стенкой двенадцатиперстной кишки. Тело и хвост покрыты собственной фасцией только сзади, сверху и снизу. Поджелудочная железа тесно прилежит к массе рыхлой забрюшинной клетчатки. обственная фасция поджелудочной железы представляет собой полупрозрачную пластинку, которая неодинаково окружает её различные отделы. Головку эта фасция окружает со всех сторон и сращена с прилегающей стенкой двенадцатиперстной кишки. Тело и хвост покрыты собственной фасцией только сзади, сверху и снизу. Поджелудочная железа тесно прилежит к массе рыхлой забрюшинной клетчатки.Кровоснабжение поджелудочной железы осуществляется из трёх истоков: 1) a. gastro duodenalis, которая исходит из a. hepatica, 2) a. pancreatoduodenalis inferior, 3) a. lienali s, снабжающей кровью преимущественно тело и хвост поджелудочной железы. (см. рис) 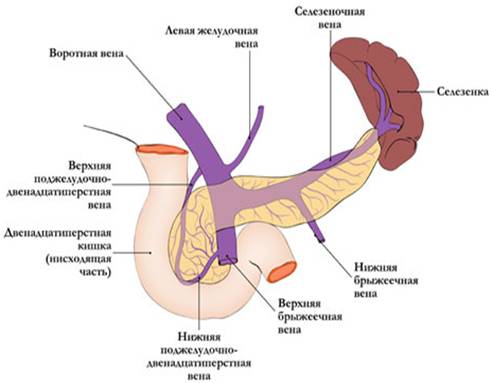 Отток крови проходит по верхней панкреатодуоденальной вене, впадающей в систему верхней брыжеечной вены, нижней панкреатодуоденальной вене, впадающей либо в верхнюю брыжеечную, либо в тощекишечную вену. Из тела и хвоста кровь по мелким панкреатическим венам оттекает через селезёночную вену в воротную. Лимфатические сосуды железы образуют густую сеть, анастомозируя с лимфатическими сосудами желчного пузыря и общего желчного протока. Так же лимфа течёт к надпочечникам, печени, желудку, селезёнке. Иннервация поджелудочной железы осуществляется, в основном, левым блуждающим нервом и постганглионарными волокнами левых чревных нервов, в то время, как внепечёночные желчные пути иннервируются правыми блуждающими чревными нервами. Принято считать, что все подходящие к поджелудочной железе нервы смешанные - симпатические и парасимпатические. Протоковая система поджелудочной железы представлена панкреатическими и добавочными протоками, причём, главный и добавочный проток либо анастомозируют, либо открываются раздельно на большом и малом сосочках двенадцатиперстной кишки. Бывает, что главный и добавочный протоки анастомозируют, но добавочный не открывается в двенадцатиперстную кишку. Физиология поджелудочной железы. Поджелудочная железа характеризуетсяальвеолярно-ацинозным строением, состоит из многочисленных долек, отделённых друг от друга прослойками соединительной ткани. Каждая долька складывается из секреторных эпителиальных клеток разнообразной формы: треугольной, округлой и цилиндрической. В этих клетках образуется панкреатический сок. Среди клеток железистой паренхимы поджелудочной железы имеются особые клетки, которые группируются в виде скоплений и носят название островков Лангерганса. Величина островков варьирует от 50 до 400 мкм в диаметре. Общая масса их составляет 1-2 % массы железы взрослого человека. Островки Лангерганса богато снабжены кровеносными сосудами и не имеют выводных протоков, то есть обладают внутренней секрецией, выделяют гормоны в кровь, принимают участие в регуляции углеводного обмена. Поджелудочная железа обладает внутренней и внешней секрецией.Внешняя секрециясостоит в выделении в двенадцатиперстную кишку панкреатического сока, который играет большую роль в процессе пищеварения. За сутки поджелудочная железа вырабатывает от 1.500 до 2.000 мл панкреатического сока, имеющего щелочной характер (рН 8,3-8,9) и строгое соотношение анионов (155 ммоль) и катионов (СО2 карбонатов, бикарбонатов и хлоридов). В состав сока входят ферменты: трипсиноген, амилаза, липаза, мальтаза, лактаза, инвертаза, нуклеаза, ренин, сычужный фермент и в очень небольшом количестве - эрепсин. Трипсиноген представляет собой сложный фермент, состоящий из трипсиногена, химотрипсиногена, карбоксипептидазы, расщепляющих белки до аминокислот. Трипсиноген выделяется железой в недеятельном состоянии, активируется в кишечнике энтерокиназой и переходит в активный трипсин. Однако, если этот фермент соприкасается с цитокиназой, выделяющейся из клеток поджелудочной железы при их гибели, то активация трипсиногена может наступить и внутри железы. Липаза внутри железы не активна и активируется в двенадцатиперстной кишке солями желчных кислот. Она расщепляет нейтральный жир на жирные кислоты и глицерин. Амилаза выделяется в активном состоянии. Она участвует в переваривании углеводов. Амилаза вырабатывается не только поджелудочной железой, но также слюнными и потовыми железами, печенью и лёгочными альвеолами. Инкреторная функция поджелудочной железы обеспечивает регуляцию водного обмена, принимает участие в жировом обмене и регуляции кровообращения. Механизм панкреатической секреции двойной - нервный и гуморальный, действует одновременно и синергично. В первой фазе пищеварения выделение сока происходит под влиянием стимулов с блуждающего нерва. Выделяющийся панкреатический сок при этом содержит большое количество ферментов. Введение атропина уменьшает выделение панкреатического сока. Во второй фазе пищеварения секреция железы стимулируется секретином - гормоном, который выделяется слизистой оболочкой двенадцатиперстной кишки. Выделяющийся панкреатический сок при этом имеет жидкую консистенцию и содержит небольшое количество ферментов. Внутрисекреторная деятельность поджелудочной железы состоит в выработке четырёх гормонов: инсулина, липокаина, глюкагона и калликреина (падутина). Островки Лангерганса содержат 20-25% А-клеток, которые являются местом образованияглюкагона. Остальные 75-80% составляют В-клетки, которые служат местом синтеза и депонированияинсулина. D-клетки являются местом образованиясоматостатина, а С-клетки -гастрина. Основную роль в регуляции углеводного обмена выполняетинсулин, который снижает уровень сахара крови, способствует отложению гликогена в печени, поглощению его тканями и уменьшению липемии. Нарушение продукции инсулина вызывает повышение сахара крови и развитие сахарного диабета.Глюкагон - антагонист инсулина. Он вызывает распад гликогена в печени и выделение глюкозы в кровь и может являться второй причиной развития диабета. Функция этих двух гормонов тонко координируется. Секреция их определяется уровнем сахара в крови. Таким образом, поджелудочная железа является сложным и жизненно важным органом, патологические изменения которого сопровождаются глубокими нарушениями пищеварения и обмена веществ. 2 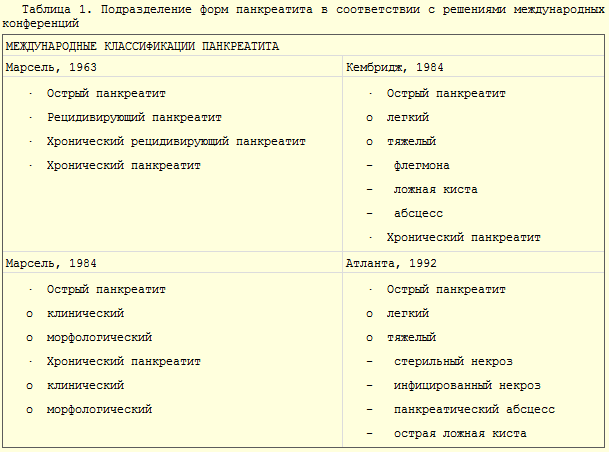 .2. Классификации. .2. Классификации.    2.3. Этиология и патогенез. ЭТИОЛОГИЯ Острый панкреатит - полиэтиологическое заболевание. Причину его развития удаётся чётко определить у 75-80% больных, у остальных она остаётся неустановленной. Среди причин развития панкреатита выделяют три тесно взаимосвязанные группы повреждающих факторов: механические (нарушение эвакуации панкреатического секрета по протоковой системе поджелудочной железы); нейрогуморальные (нарушение иннервации, метаболических функций поджелудочной железы и печени различной этиологии); токсические (присутствие экзо- и эндогенных токсических метаболитов различной природы). У 80% пациентов развитие заболевания связывают с патологией билиарной системы и приёмом алкоголя. Основная причина развития острого панкреатита - заболевания внепечёночных жёлчных путей. На их долю приходится в среднем 45% наблюдений. Анатомическая и функциональная общность панкреатобилиарной системы обусловливает частое развитие панкреатита при ЖКБ, холедохолитиазе, стриктуре, спазме или воспалении большого сосочка двенадцатиперстной кишки, при сдавлении жёлчных протоков опухолью головки поджелудочной железы, склерозирующем холангите и дискинезии жёлчных путей различной природы. В этих условиях развивается билиарный панкреатит, ведущие факторы патогенеза которого: нарушение оттока панкреатического секрета по внепечёночным жёлчным путям и протоковой системе поджелудочной железы; билиарно-панкреатический или дуоденально-панкреатический рефлюкс; внутрипротоковая гипертензия. Билиарный панкреатит чаще бывает у женщин старше 60 лет с ЖКБ с размерами конкрементов менее 5 мм. У 35% больных острым панкреатитом причина его развития - хронический алкоголизм, алкогольный эксцесс или приём суррогатов алкоголя. Алкогольный панкреатит чаще бывает у мужчин. Основной механизм развития алкогольного панкреатита - нарушение дренажной функции панкреатических и жёлчных протоков, поскольку стимулированная алкоголем секреция приводит к увеличению вязкости панкреатического секрета и повышению внутрипротокового давления. С алкоголизмом связывают токсическое повреждение поджелудочной железы, изменение синтеза панкреатических ферментов и нарушение метаболической функции печени. Развитию острого панкреатита также способствуют повреждения поджелудочной железы вследствие тупой травмы живота, хирургического вмешательства, эндоскопической ретроградной панкреатохолангиографии, папиллотомии, эндобилиарного стентирования, протезирования, дилатации стриктур жёлчных протоков и манометрии сфинктера Одди. Послеоперационный панкреатит, развивающийся после хирургических вмешательств на органах гепатопанкреатодуоденальной зоны и смежных с поджелудочной железой областях, характеризуется наиболее тяжёлым течением. Основной патогенетический механизм в этих условиях заключается в прямом повреждении протоков или опосредованном формировании внутрипротоковой гипертензии. При заболеваниях двенадцатиперстной кишки развитию острого панкреатита способствуют язвенная болезнь двенадцатиперстной кишки (пенетрация язвы в головку поджелудочной железы), дуоденостаз, дуоденальные дивертикулы, дуоденит с папиллитом. При этих заболеваниях нарушение эвакуации из двенадцатиперстной кишки, повышение внутриполостного давления и дискинезия сфинктерного аппарата дуоденального сосочка - пусковые факторы в развитии дуоденопанкреатического рефлюкса и внутрипротоковой гипертензии. С нарушениями системного метаболизма связано развитие острого панкреатита при гиперлипидемии, беременности, сахарном диабете, вирусном гепатите, СПИДе, васкулитах различной этиологии, заболеваниях печени, паращитовидных желёз, различных видах шока, гипоперфузии мезентериального бассейна в условиях искусственного кровообращения. Гиперлипидемия (I, IV и V типов, связанных с гипертриглицеридемией больше 1000 мг/дл) - причина развития острого панкреатита лишь в 1,3-3,8% наблюдений. У больных сахарным диабетом развитие гипертриглицеридемии считают одной из причин возникновения панкреатита. Однако непонятным остаётся тот факт, что у хронических алкоголиков триглицеридемия не всегда сопровождается развитием острого процесса в поджелудочной железе. При вирусном гепатите в течение первого года у 14% больных развивается панкреатит. Гиперпаратиреоидизм относят к редким причинам заболевания - только у 8-19% больных гиперпаратиреоидизмом развивается острый панкреатит. Другие состояния, вызывающие гиперкальциемию (метастазы в кости, передозировка витамина D, саркоидоз), вызывают острый панкреатит ещё реже. Среди широкого спектра химических соединений, воздействие которых бывает причиной острого панкреатита, следует отметить лекарственные препараты, широко используемые в клинической практике, - омнопон, фуросемид, индометацин, ранитидин, салицилаты и антибактериальные средства (эритромицин, метронидазол, тетрациклин). К наиболее редким этиологическим моментам развития панкреатита относят наследственность («семейный» панкреатит), циркулярно-расположенную поджелудочную железу (7-8% населения), ишемию мезентериального бассейна (вследствие эмболии/тромбоза верхней брыжеечной артерии), микоплазменную инфекцию и аскаридоз, отравление фосфорорганическими соединениями, укус скорпиона. У 10-23% больных острый панкреатит носит идиопатический характер и не имеет ни географической, ни демографической, ни социальной привязанности. ПАТОГЕНЕЗ Основу патогенеза острого панкреатита составляют процессы местного и системного воздействия панкреатических ферментов и цитокинов различной природы. Ферментную теорию с основной ролью трипсина в патогенезе заболевания считают ведущей. Комбинация нескольких пусковых факторов в рамках полиэтиологичности острого панкреатита - основной момент внутриацинарной активации протеолитических ферментов и аутокаталитического переваривания поджелудочной железы. В цитоплазме ацинарной клетки наблюдается слияние зимогенных гранул и лизосомальных гидролаз («колокализационная теория»), вследствие которого активируются проферменты с последующим выходом протеаз в интерстиций поджелудочной железы. Активация трипсиногена и переход его в трипсин - мощный активатор всех остальных проэнзимов с формированием каскада тяжёлых патобиохимических реакций. Принципиально важным в патогенезе заболевания представляют преждевременную активацию ферментных систем, причём ранний механизм активации связан с повреждением клеточных мембран и нарушением трансмембранных взаимосвязей. Один из реально существующих механизмов патогенеза панкреонекроза при повреждении ацинарной клетки - изменение концентрации ионов кальция в клетке и за её пределами, что приводит к активации трипсина. При увеличении концентрации ионов кальция в клетке инициируется внутриклеточный синтез фактора активации тромбоцитов (главного медиатора воспаления). Другие механизмы аутоактивации ферментных систем в поджелудочной железе: нарушение равновесия в системе «фермент-ингибитор» или дефицит ингибиторов трипсина (альфа-1-антитрипсина или альфа-2-макроглобулина), развивающийся на фоне мутации соответствующего гена. Трипсин - первичный активатор каскада тяжёлых патобиохимических реакций, но выраженность патологических реакций обусловлена действием интегральной совокупности всех ферментных систем поджелудочной железы (трипсина, химотрипсина, липазы, фосфолипазы А2, эластазы, карбоксипептидазы, коллагеназы и т.д.). Активированные ферменты поджелудочной железы выступают в качестве первичных факторов агрессии, оказывают местное действие, поступают в забрюшинное пространство, брюшную полость, по воротной вене - в печень, по лимфатическим сосудам - в системный кровоток. Фосфолипаза А2 разрушает мембраны клеток, липаза гидролизует внутриклеточные триглицериды до жирных кислот, которые, соединяясь с кальцием, образуют элементы структуры жирового (липолитического) некроза в поджелудочной железе, клетчатке забрюшинного пространства и брюшине. Трипсин и химотрипсин вызывают протеолиз белков тканей, эластаза разрушает стенку сосудов и межтканевые соединительнотканные структуры, что приводит к развитию геморрагического (протеолитического) некроза. Формирующиеся очаги некробиоза, некроза с перифокальной демаркационной зоной воспаления в поджелудочной железе и забрюшинной клетчатке первично асептические. Важное звено патогенеза острого панкреатита - активация трипсином калликреин-кининовой системы с образованием вторичных факторов агрессии: брадикинина, гистамина, серотонина. Это сопровождается увеличением сосудистой проницаемости, нарушениями микроциркуляции, формированием отёка в зоне поджелудочной железы и забрюшинном пространстве, повышенной экссудацией в брюшную полость. К факторам агрессии третьего порядка, участвующим в патогенезе местной и системной воспалительной реакции, нарушений микроциркуляции и системной гемодинамики, сердечной и дыхательной недостаточности, относят синтез мононуклеарными клетками, макрофагами и нейтрофилами различных медиаторов воспаления (цитокинов): интерлейкинов 1, 6 и 8, фактора некроза опухолей, фактора активации тромбоцитов, непанкреатической формы фосфолипазы А2, простагландинов, тромбоксана, лейкотриенов, оксида азота. К провоспалительным цитокинам относят: фактор некроза опухолей, интерлейкины 1-бета и 6, а к противовоспалительным - интерлейкины 1 и 10. В начале заболевания концентрация всех медиаторов воспаления в поджелудочной железе, печени, лёгких, селезёнке и системной циркуляции увеличивается, что объясняет механизмы развития локальной, органной и системной воспалительной реакции. Ферменты, цитокины и метаболиты различной природы, образующиеся при остром панкреатите в поджелудочной железе, забрюшинном пространстве, брюшной полости и просвете желудочно-кишечного тракта, быстро поступают в портальный кровоток и по грудному лимфатическому протоку - в системную циркуляцию с развитием панкреатогенной токсинемии. Первые органы-мишени на их пути из забрюшинного пространства к органам экстраабдоминальной локализации - печень и лёгкие, сердце, мозг и почки. Итог мощного цитотоксического действия этих биохимических соединений в начале заболевания - развитие панкреатогенного шока и полиорганных нарушений, определяющих степень тяжести состояния больного острым панкреатитом. В патогенезе системных нарушений еще до развития септических осложнений имеет значение токсинемия бактериальной природы и, прежде всего, липополисахарид клеточной стенки грамотрицательных бактерий (эндотоксин), продуцируемый в просвете желудочно-кишечного тракта микрофлорой кишечника. При остром панкреатите перемещение эндогенной микрофлоры и эндотоксина грамотрицательных бактерий кишечника происходит в однотипных условиях функциональной (реже морфологической) несостоятельности метаболической и барьерной функции желудочно-кишечного тракта, ретикулоэндотелиальной системы печени и лёгких. Перемещение эндогенной микрофлоры из желудочно-кишечного тракта в ткани поджелудочной железы и забрюшинного пространства - основное звено патогенеза деструктивного панкреатита. Этот процесс - связующее звено между начальной, «ранней» (доинфекционной), и последующей, «поздней» (септической), фазами острого панкреатита. В патогенезе острого панкреатита выделяют две основные фазы. Первая фаза обусловлена формированием системной реакции в течение первых суток от начала заболевания, когда воспаление, аутолиз, некробиоз и некроз поджелудочной железы, забрюшинной клетчатки носит асептический характер. В этих условиях в первую неделю заболевания в зависимости от степени выраженности патоморфологических нарушений возможно формирование следующих форм острого панкреатита: при некробиозе, воспалении и отграничении процесса развивается острый интерстициальный панкреатит (отёчная форма); при жировом или геморрагическом некрозе - стерильный панкреонекроз (некротический панкреатит). Тяжесть состояния больного острым панкреатитом обусловлена патоморфологией заболевания и панкреатогенной токсинемией, панкреатогенным шоком и полиорганной недостаточностью. Своевременными лечебными мероприятиями патологический процесс можно купировать на этапе интерстициального панкреатита, тогда как в обратной ситуации он переходит в панкреонекроз. При прогрессировании заболевания с исходом в панкреонекроз закономерен переход патологического процесса во вторую (септическую) фазу острого панкреатита, связанный с инфицированием зон некроза различной локализации на 2-3-й неделе заболевания. В этих условиях происходит повторная активация и репродукция аналогичных первой фазе медиаторов, триггер которых - токсины микроорганизмов, колонизирующих зоны некроза. В инфекционную фазу заболевания порочный круг патологических реакций составляет качественно новый этап формирования разнообразных инфицированных форм панкреонекроза и абдоминального сепсиса с септическим шоком и полиорганной недостаточностью. Средняя частота инфицирования при панкреонекрозе составляет 30-80%, что определяется распространённостью панкреонекроза, сроками от начала заболевания, характером консервативной терапии и тактикой хирургического лечения. Развитие инфекции при панкреонекрозе необходимо рассматривать как важный этап эволюции патоморфологического процесса. Существует прямая зависимость между степенью распространённости некротического поражения и вероятностью инфицирования. Инфицированные формы некроза выявляют у каждого четвертого больного на первой неделе заболевания; практически у половины пациентов, страдающих панкреонекрозом на второй неделе; у каждого третьего больного деструктивным панкреатитом в период третьей и четвёртой недель от начала заболевания. Наиболее частые возбудители панкреатогенной инфекции: кишечная палочка (26%), синегнойная палочка (16%), стафилококки (15%), клебсиелла (10%), стрептококки (4%), энтеробактер (3%) и анаэробы. Грибковая инфекция развивается спустя 2 нед и больше от начала развития панкреонекроза, что обусловлено длительностью предшествующей антибактериальной терапии. Инфицирование изначально стерильных зон панкреонекроза обусловлено контаминацией условно-патогенной микрофлорой эндогенного (толстокишечного) и экзогенного (у оперированого больного по дренажам и тампонам из окружения палаты интенсивной терапии) происхождения. |
