мива. шпора коллоидная. От tуменьшение межмолекулярных взаимодействий, т к. увеличивается расстояние можду молекулами в результате возрастания теплового движения молекул жидкости линейно убывает с ростом T. Полная
 Скачать 59.23 Kb. Скачать 59.23 Kb.
|
|
Термодинамическое - избыточная энергия на поверхности раздела двух фаз по сравнению с объемной фазой. Силовое - сила, которую нужно приложить над жидкостью, чтобы увеличить поверхность на единицу. Зависит от полярности фаз, чем больше их различие, тем больше пов натяжение. от T-уменьшение межмолекулярных взаимодействий, т.к. увеличивается расстояние можду молекулами в результате возрастания теплового движения молекул жидкости. 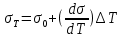 .линейно убывает с ростом T. Полная-работа, затраченная на преодоление межмолекулярных взаимодействий при переходе молекул из объмной ф. в поверхность и теплотой образование новой поверхности .линейно убывает с ростом T. Полная-работа, затраченная на преодоление межмолекулярных взаимодействий при переходе молекул из объмной ф. в поверхность и теплотой образование новой поверхности .Капиллярное давление ΔР-Разность внутренних давлений по обе стороны искривленной поверхности раздела фаз (жидкость – пар или двух жидкостей). Работа адгезии будет равна: WA = σA-Г + σВ-Г - σА-В (уравнение Дюпре). работа адгезии характеризует работу, необходимую для разделения 1 м2 поверхности раздела фаз АВ на две поверхности раздела фаз А и В (типа жидкость – газ, твердое тело – газ). В результате образуются две новые поверхности: одна с поверхностным натяжением σА-г и другая с σВ-г , а поверхность раздела фаз σА-В исчезает. Смачивание – это явление, возникающее при соприкосновении жидкости с поверхностью твердого тела или с другой жидкостью. Оно позволяет выявить сродство адгезива к субстрату, то есть является разновидностью адгезии к взаимодействию типа, Ж-Т.иммерсионное смачивание. Оно наблюдается при полном погружении твердого тела в жидкость. В нем участвуют две фазы – твердая и жидкая. Оно реализуется при смачивании порошков и мелких частиц; контактное смачивание. При этом виде смачивания могут взаимодействовать три фазы (Т-Ж-Г) или четыре фазы (Т-Ж1-Ж2-Г). При этом вторая жидкость не смешивается с первой и имеет большую плотность. способ гидрофобизации поверхности кремнезема?Нанесение ПАВ на поверхность кремнезема, при это поверхность из гидрофильной станет гидрофобной. Пов.акт. возр в 3.2 при удлинении цепи на CH2-увеличивается площадь, занимаемой молекулой ПАВ-большие молекулы экранируют больше полярных молекул воды, вызывая большее снижение пов.нат. Поверхностная энергия (Gs) – это избыток энергии в поверхностном слое на границе раздела фаз по сравнению с энергией в объеме этих фаз. Поверхностная энергия равна: Gs = σ·S, [ Дж ], Поверхностный слой существует только, если Gs > 0. ПАВ – это вещества, которые снижают поверхностное натяжение растворителя. К ним относятся большинство растворимых в воде органических соединений, обладающих дифильным строением, то есть состоят из двух различных частей: углеводородная цепь – неполярная и полярная функциональные группы –COOH-OH-CN-NH2. Полярные группы обращаются в водной фазе, втягиваясь в неё и взаимод. с диполями воды, углевод.цепь выталкивается из воды, обращаясь к менее полярной фазе. Внедряясь между диполями воды, молекулы ПАВ вызывают уменьшение межмолек.сил в пов.слое, что и приводит к снижению пов.нат. Классификация ПАВ. 1. по способности к электролитической диссоциации: Ионогенные ПАВ диссоциируют в водных растворах на ионы, один из которых обладает адсорбционной (поверхностной) активностью, другие (противоионы) – адсорбционно неактивны(анионные, катионные, амфоитые ). Неионогенные ПАВ неспособны к электролитической диссоцации в водных растворах. 2. Цвиттер-ионные ПАВ содержат положительно заряженную (обычно аммониевую) и отрицательно заряженную (обычно карбосилат-ион) группу. Они обладают синергизмом , то есть усиливают поверхностную активность в смесях ПАВ. 3. По типу систем, которые они образуют при взаимодействии с растворяющей средой. Истинно-растворимые: они сохраняют молекулярную степень дисперсности и система остаётся гомогенной, относятся все водорастворимые орган.соед. которые имеют дифильное строение. Коллоидные: Эти ПАВ способны самопроизвольно при называемой критической концентрацией мицеллообразования (ККМ), в объеме раствора объединяться в мицеллы , то есть раствор из гомогенного переходит в гетерогенное состояние. 4. По растворимости: водорастворимые ПАВ, растворимы в воде, но плохо растворимы в неполярной жидкости; маслорастворимые хорошо растворяются в неполярной жидкости и нерастворимы в воде; растворимые и в воде, и в масле. 5. по происхождению: синтетические на основе нефтехимических технологий (моющие средства); природные-липиды с помощью ферментативных реакций. 6. по строению: неорганические-солями неорганических веществ, большой поверхностной активностью к данной конкретной границе раздела фаз; органические органические соединения с дифильным строением, их поверхностная активность меньше, чем у неорганических ПАВ, применяют для любой границе раздела фаз. 7. биоразлагаемости Биоразлагаемость – это время снижения концентрации ПАВ под действием биоорганизмов в определенное число раз(хорошо,средне,трудно) 8. Гидрофильно-липофильный баланс (ГЛБ)-характеризует соотношение между гидрофильными свойствами полярной группы и липофильными (жир) свойствами углеводородного радикала. Чем выше число ГЛБ, тем сильнее св-ва, сдвинутых в сторону полярных свойств.Абсорбция – поглощение газов, паров в объемной фазе. Адсорбтив – вещество, молекулы которого могут адсорбироваться, но еще находиться в объемной фазе.В чём принципиальное отличие адсорбции на твёрдых поверхностях от адсорбции на жидкости. На поверхности твёрдого тела есть определённое число адсорбционных центров, а поверхность жидкости эквипотенциально, поэтому там отсутствуют эти центры, На поверхности жидкости молекулы адсорбата свободно перемещаются.количественного описания адсорбции? Абсолютная адсорбция (А)( .Капиллярное давление ΔР-Разность внутренних давлений по обе стороны искривленной поверхности раздела фаз (жидкость – пар или двух жидкостей). Работа адгезии будет равна: WA = σA-Г + σВ-Г - σА-В (уравнение Дюпре). работа адгезии характеризует работу, необходимую для разделения 1 м2 поверхности раздела фаз АВ на две поверхности раздела фаз А и В (типа жидкость – газ, твердое тело – газ). В результате образуются две новые поверхности: одна с поверхностным натяжением σА-г и другая с σВ-г , а поверхность раздела фаз σА-В исчезает. Смачивание – это явление, возникающее при соприкосновении жидкости с поверхностью твердого тела или с другой жидкостью. Оно позволяет выявить сродство адгезива к субстрату, то есть является разновидностью адгезии к взаимодействию типа, Ж-Т.иммерсионное смачивание. Оно наблюдается при полном погружении твердого тела в жидкость. В нем участвуют две фазы – твердая и жидкая. Оно реализуется при смачивании порошков и мелких частиц; контактное смачивание. При этом виде смачивания могут взаимодействовать три фазы (Т-Ж-Г) или четыре фазы (Т-Ж1-Ж2-Г). При этом вторая жидкость не смешивается с первой и имеет большую плотность. способ гидрофобизации поверхности кремнезема?Нанесение ПАВ на поверхность кремнезема, при это поверхность из гидрофильной станет гидрофобной. Пов.акт. возр в 3.2 при удлинении цепи на CH2-увеличивается площадь, занимаемой молекулой ПАВ-большие молекулы экранируют больше полярных молекул воды, вызывая большее снижение пов.нат. Поверхностная энергия (Gs) – это избыток энергии в поверхностном слое на границе раздела фаз по сравнению с энергией в объеме этих фаз. Поверхностная энергия равна: Gs = σ·S, [ Дж ], Поверхностный слой существует только, если Gs > 0. ПАВ – это вещества, которые снижают поверхностное натяжение растворителя. К ним относятся большинство растворимых в воде органических соединений, обладающих дифильным строением, то есть состоят из двух различных частей: углеводородная цепь – неполярная и полярная функциональные группы –COOH-OH-CN-NH2. Полярные группы обращаются в водной фазе, втягиваясь в неё и взаимод. с диполями воды, углевод.цепь выталкивается из воды, обращаясь к менее полярной фазе. Внедряясь между диполями воды, молекулы ПАВ вызывают уменьшение межмолек.сил в пов.слое, что и приводит к снижению пов.нат. Классификация ПАВ. 1. по способности к электролитической диссоциации: Ионогенные ПАВ диссоциируют в водных растворах на ионы, один из которых обладает адсорбционной (поверхностной) активностью, другие (противоионы) – адсорбционно неактивны(анионные, катионные, амфоитые ). Неионогенные ПАВ неспособны к электролитической диссоцации в водных растворах. 2. Цвиттер-ионные ПАВ содержат положительно заряженную (обычно аммониевую) и отрицательно заряженную (обычно карбосилат-ион) группу. Они обладают синергизмом , то есть усиливают поверхностную активность в смесях ПАВ. 3. По типу систем, которые они образуют при взаимодействии с растворяющей средой. Истинно-растворимые: они сохраняют молекулярную степень дисперсности и система остаётся гомогенной, относятся все водорастворимые орган.соед. которые имеют дифильное строение. Коллоидные: Эти ПАВ способны самопроизвольно при называемой критической концентрацией мицеллообразования (ККМ), в объеме раствора объединяться в мицеллы , то есть раствор из гомогенного переходит в гетерогенное состояние. 4. По растворимости: водорастворимые ПАВ, растворимы в воде, но плохо растворимы в неполярной жидкости; маслорастворимые хорошо растворяются в неполярной жидкости и нерастворимы в воде; растворимые и в воде, и в масле. 5. по происхождению: синтетические на основе нефтехимических технологий (моющие средства); природные-липиды с помощью ферментативных реакций. 6. по строению: неорганические-солями неорганических веществ, большой поверхностной активностью к данной конкретной границе раздела фаз; органические органические соединения с дифильным строением, их поверхностная активность меньше, чем у неорганических ПАВ, применяют для любой границе раздела фаз. 7. биоразлагаемости Биоразлагаемость – это время снижения концентрации ПАВ под действием биоорганизмов в определенное число раз(хорошо,средне,трудно) 8. Гидрофильно-липофильный баланс (ГЛБ)-характеризует соотношение между гидрофильными свойствами полярной группы и липофильными (жир) свойствами углеводородного радикала. Чем выше число ГЛБ, тем сильнее св-ва, сдвинутых в сторону полярных свойств.Абсорбция – поглощение газов, паров в объемной фазе. Адсорбтив – вещество, молекулы которого могут адсорбироваться, но еще находиться в объемной фазе.В чём принципиальное отличие адсорбции на твёрдых поверхностях от адсорбции на жидкости. На поверхности твёрдого тела есть определённое число адсорбционных центров, а поверхность жидкости эквипотенциально, поэтому там отсутствуют эти центры, На поверхности жидкости молекулы адсорбата свободно перемещаются.количественного описания адсорбции? Абсолютная адсорбция (А)( ) – количество вещества в поверхностном слое, приходящееся на единицу площади поверхности или массы адсорбента. А = ) – количество вещества в поверхностном слое, приходящееся на единицу площади поверхности или массы адсорбента. А =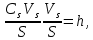 h –толщина поверхностного слоя (м). Избыточная (гиббсовская) адсорбция Г(моль/м2)– избыток компонента в поверхностном слое по сравнению в объёме, отнесенный к единице площади поверхности. Г= h –толщина поверхностного слоя (м). Избыточная (гиббсовская) адсорбция Г(моль/м2)– избыток компонента в поверхностном слое по сравнению в объёме, отнесенный к единице площади поверхности. Г= . Удельная адсорбция aI(моль/кг; кг/кг) – количество в-ва( . Удельная адсорбция aI(моль/кг; кг/кг) – количество в-ва( ) или его масса ( ) или его масса ( в поверхностном слое, отнесенное к массе адсорбента. aI= в поверхностном слое, отнесенное к массе адсорбента. aI= . гиббсовскую адсорбцию по изотерме поверхностного натяжения. В изотерме . гиббсовскую адсорбцию по изотерме поверхностного натяжения. В изотерме 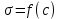 проводят касательные. tgα= проводят касательные. tgα= . Г= . Г=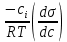 . Площадь одной молекулы ПАВ . Площадь одной молекулы ПАВ 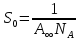 . Длина молекулы . Длина молекулы 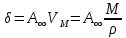 . У какой воды -Поверхностное натяжение с ростом температуры уменьшается, что объясняется увеличением взаимной растворимости компонентов фаз в системе и увеличением межмолекулярного расстояния в результате возрастания теплового движения молекул жидкости. Последний эффект характерен для чистых жидкостей. Поэтому величина всегда отрицательна, на эту величину происходит уменьшение поверхностного натяжения с увеличением температуры. Линейная зависимость характерна для всех индивидуальных (однокомпонентных) жидкостей на границе с газовой фазой. Для растворов (особенно растворов ПАВ) температурная зависимость поверхностного натяжения носит более сложный характер. Какая жидкость лучше смачивает гидрофобную поверхность вода или бензол? Твердая поверхность тем лучше смачивается, чем меньше когезия жидкости и чем больше адгезия жидкости с твердым телом. Другими словами, лучше смачивает поверхность та жидкость, которая ближе по полярности к смачиваемому веществу и имеет меньшее поверхностное натяжение. Поэтому, жидкости с малым поверхностным натяжением лучше смачивают твердые тела. Неполярные жидкости, такие как бензол, керосин, масла смачивают все твердые тела. Лучше смачивающиеся неполярной жидкостью с cosθ <0 и следовательно 90о < θ < 180о – гидрофобными или олеофильными. диспергирования легче В результате адсорбции вещества проникают в микрощели и стремятся их раздвинуть, содействуя тем самым внешним деформирующим силам и способствуя диспергированию. Облегчение диспергирования под влиянием адсорбции получило название эффекта Ребиндера или адсорбционного понижения твѐрдости, а вещества, повышающие эффективность диспергирования, называются понизителями твердости. самопроизвольные процессы уменьшением площади поверхности самопроизвольно протекающие процессы сопровождаются убылью энергии Гиббса dG < 0. Энергия Гиббса поверхности равна G = σ·S и тогда dG = σ·dS + S·dσ. процессы, приводящие к самопроизвольному уменьшению поверхности раздела фаз, для них dS < 0 и σ = const. Эти процессы происходят при коагуляции и изотермической перегонке.Изотермической перегонкой, при которой процесс укрупнения частиц с одновременным уменьшением их числа происходит за счет исчезновения более мелких частиц и роста более крупных (мелкие частицы сливаются с крупными).Коагуляция – процесс слипания одинаковых по природе и знаку заряда поверхности частиц, приводящий вследствие потери агрегативной устойчивости к образованию более крупных агрегатов, что приводит к разрушению дисперсной системы, т. е. разделению её на фазы. Коагуляция протекает в термодинамически неустойчивых (лиофобных) дисперсных системах. самопроизвольные процессы к уменьшению поверхностного натяжения? самопроизвольно протекающие процессы сопровождаются убылью энергии Гиббса dG < 0. Энергия Гиббса поверхности равна G = σ·S и тогда dG = σ·dS + S·dσ. процессы, сопровождаемые снижением поверхностного натяжения, для них dσ < 0 и S = const. К этим процессам относятся когезия, адгезия, смачивание, растекание. Перечисленные процессы обусловлены межмолекулярными взаимодействиями внутри фаз или между фазами: жидкость-жидкость, жидкостьтвердое тело, твердое тело - твердое тело Когезия – это взаимодействие одинаковых по природе молекул (атомов, ионов) внутри гомогенной фазы под действием сил притяжения – аттракции. Силы аттракции – это силы межмолекулярного взаимодействия, водородной и химической связи. Адгезия – это взаимодействие поверхностей двух разнородных твердых или жидких тел (например, капли воды прилипают к стеклу), то есть взаимодействие между телами разной природы. Смачивание – это явление, возникающее при соприкосновении жидкости с поверхностью твердого тела или с другой жидкостью. Оно позволяет выявить сродство адгезива к субстрату, то есть является разновидностью адгезии к взаимодействию типа, Ж-Т. Растекание Если контактируют жидкости, имеющие разную полярность (например, бензол с водой), то после насыщения жидкостей происходит растекание жидкости с меньшим поверхностным натяжением по поверхности жидкости с большим поверхностным натяжением – это проявление эффекта Марангони. почему олеат натрия (C17H35COOH) снижает поверхностное натяжение воды, а хлорид натрия (NaCl) его увеличивает? Олеат натрия ПАВ ( . У какой воды -Поверхностное натяжение с ростом температуры уменьшается, что объясняется увеличением взаимной растворимости компонентов фаз в системе и увеличением межмолекулярного расстояния в результате возрастания теплового движения молекул жидкости. Последний эффект характерен для чистых жидкостей. Поэтому величина всегда отрицательна, на эту величину происходит уменьшение поверхностного натяжения с увеличением температуры. Линейная зависимость характерна для всех индивидуальных (однокомпонентных) жидкостей на границе с газовой фазой. Для растворов (особенно растворов ПАВ) температурная зависимость поверхностного натяжения носит более сложный характер. Какая жидкость лучше смачивает гидрофобную поверхность вода или бензол? Твердая поверхность тем лучше смачивается, чем меньше когезия жидкости и чем больше адгезия жидкости с твердым телом. Другими словами, лучше смачивает поверхность та жидкость, которая ближе по полярности к смачиваемому веществу и имеет меньшее поверхностное натяжение. Поэтому, жидкости с малым поверхностным натяжением лучше смачивают твердые тела. Неполярные жидкости, такие как бензол, керосин, масла смачивают все твердые тела. Лучше смачивающиеся неполярной жидкостью с cosθ <0 и следовательно 90о < θ < 180о – гидрофобными или олеофильными. диспергирования легче В результате адсорбции вещества проникают в микрощели и стремятся их раздвинуть, содействуя тем самым внешним деформирующим силам и способствуя диспергированию. Облегчение диспергирования под влиянием адсорбции получило название эффекта Ребиндера или адсорбционного понижения твѐрдости, а вещества, повышающие эффективность диспергирования, называются понизителями твердости. самопроизвольные процессы уменьшением площади поверхности самопроизвольно протекающие процессы сопровождаются убылью энергии Гиббса dG < 0. Энергия Гиббса поверхности равна G = σ·S и тогда dG = σ·dS + S·dσ. процессы, приводящие к самопроизвольному уменьшению поверхности раздела фаз, для них dS < 0 и σ = const. Эти процессы происходят при коагуляции и изотермической перегонке.Изотермической перегонкой, при которой процесс укрупнения частиц с одновременным уменьшением их числа происходит за счет исчезновения более мелких частиц и роста более крупных (мелкие частицы сливаются с крупными).Коагуляция – процесс слипания одинаковых по природе и знаку заряда поверхности частиц, приводящий вследствие потери агрегативной устойчивости к образованию более крупных агрегатов, что приводит к разрушению дисперсной системы, т. е. разделению её на фазы. Коагуляция протекает в термодинамически неустойчивых (лиофобных) дисперсных системах. самопроизвольные процессы к уменьшению поверхностного натяжения? самопроизвольно протекающие процессы сопровождаются убылью энергии Гиббса dG < 0. Энергия Гиббса поверхности равна G = σ·S и тогда dG = σ·dS + S·dσ. процессы, сопровождаемые снижением поверхностного натяжения, для них dσ < 0 и S = const. К этим процессам относятся когезия, адгезия, смачивание, растекание. Перечисленные процессы обусловлены межмолекулярными взаимодействиями внутри фаз или между фазами: жидкость-жидкость, жидкостьтвердое тело, твердое тело - твердое тело Когезия – это взаимодействие одинаковых по природе молекул (атомов, ионов) внутри гомогенной фазы под действием сил притяжения – аттракции. Силы аттракции – это силы межмолекулярного взаимодействия, водородной и химической связи. Адгезия – это взаимодействие поверхностей двух разнородных твердых или жидких тел (например, капли воды прилипают к стеклу), то есть взаимодействие между телами разной природы. Смачивание – это явление, возникающее при соприкосновении жидкости с поверхностью твердого тела или с другой жидкостью. Оно позволяет выявить сродство адгезива к субстрату, то есть является разновидностью адгезии к взаимодействию типа, Ж-Т. Растекание Если контактируют жидкости, имеющие разную полярность (например, бензол с водой), то после насыщения жидкостей происходит растекание жидкости с меньшим поверхностным натяжением по поверхности жидкости с большим поверхностным натяжением – это проявление эффекта Марангони. почему олеат натрия (C17H35COOH) снижает поверхностное натяжение воды, а хлорид натрия (NaCl) его увеличивает? Олеат натрия ПАВ (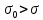 ) Хлорид натрия ПИАВ ( ) Хлорид натрия ПИАВ (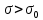 ) У неполярных веществ «σ» меньше, так как малы силы межмолекулярного взаимодействия, у полярных веществ «σ» больше – велики силы межмолекулярного взаимодействия. ) У неполярных веществ «σ» меньше, так как малы силы межмолекулярного взаимодействия, у полярных веществ «σ» больше – велики силы межмолекулярного взаимодействия. 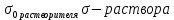 . емкость монослоя одинакова?Емкость монослоя (А∞ ) определяется гидрофильной частью ПАВ и если она одна и та же, то А∞ будет одинакова для соединений одного и того же гомологического ряда, так как она не зависит от длины углеводородного радикала. Одинаковой также будет и So –площадь, занимаемая одной молекулой в поверхностном слое. Почему концентрация ПАВ выше у поверхности раствора. ПАВ- менее полярные, чем растворитель и снижают пов.нат. . емкость монослоя одинакова?Емкость монослоя (А∞ ) определяется гидрофильной частью ПАВ и если она одна и та же, то А∞ будет одинакова для соединений одного и того же гомологического ряда, так как она не зависит от длины углеводородного радикала. Одинаковой также будет и So –площадь, занимаемая одной молекулой в поверхностном слое. Почему концентрация ПАВ выше у поверхности раствора. ПАВ- менее полярные, чем растворитель и снижают пов.нат. 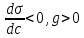 , ,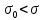 , Г>0, т.е адсорбция положительная и концентрация ПАВ в повер.слое больше , Г>0, т.е адсорбция положительная и концентрация ПАВ в повер.слое больше  . ПИВ-в-ва более полярны ,чем вода и стремятся уйти в объём . . ПИВ-в-ва более полярны ,чем вода и стремятся уйти в объём . 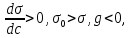 Г Г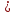 0 адсорбция отрицательная и 0 адсорбция отрицательная и  Такое деление относительное. Такое деление относительное. 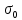 -чистого растворителя, -чистого растворителя,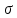 -р-ра в котором находится растворённое в-во.Физ.-между молекл. адсобата и адсорбента действую межмолек.силы и действуют в разных фазах , она обратима. Хим.-химическая реакция в повер.слое, необратима,избирательность взаимодействия и изменение структуры адсорбата и адсорбента -р-ра в котором находится растворённое в-во.Физ.-между молекл. адсобата и адсорбента действую межмолек.силы и действуют в разных фазах , она обратима. Хим.-химическая реакция в повер.слое, необратима,избирательность взаимодействия и изменение структуры адсорбата и адсорбента  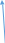  Ленгмюра. Положения : Энергия адсорбции всех молекул одинакова. адсорбция локализована в адсорбционных центрах, каждый из которых взаимодействует только с 1 молекулой адсорбата и образуется монослой.адсорбированные молекулы образуют адсорбционный комплекс, неспособный свободно перемещаться по поверхности и не взаимодействуют друг с другом.адсорбцию газа на тв.адсорбенте как квазихимическую реакцию молекула газа+активный центр  адсорбционный комплекс. адсорбционный комплекс.  . K-константа адсорбционного равновесия,характеризует сродство адсорбата к адсорбенту(их энергию взаимодействия). Через степень заполнения поверхности Ѳ . . K-константа адсорбционного равновесия,характеризует сродство адсорбата к адсорбенту(их энергию взаимодействия). Через степень заполнения поверхности Ѳ . 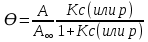  -`количество адсорбированного в-ва, покрывающее поверхность адсорбента плотным монослоем. Линейная форма а) -`количество адсорбированного в-ва, покрывающее поверхность адсорбента плотным монослоем. Линейная форма а) 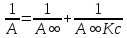 или б) или б) 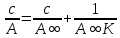 .а) .а) 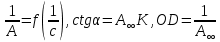 . б) ) . б) )  изотерм полимолекулярной адсорбции. типа I взаимодействие адсорбент – адсорбат сильнее взаимодействия адсорбат –адсорбат, а в случае изотерм типа II взаимодействие адсорбат –адсорбат сильнее взаимодействия адсорбент – адсорбат.. Изотермы типа III и IV для них характерна конечная адсорбция при приближении давления пара к давлению насыщенного пара изотерм полимолекулярной адсорбции. типа I взаимодействие адсорбент – адсорбат сильнее взаимодействия адсорбат –адсорбат, а в случае изотерм типа II взаимодействие адсорбат –адсорбат сильнее взаимодействия адсорбент – адсорбат.. Изотермы типа III и IV для них характерна конечная адсорбция при приближении давления пара к давлению насыщенного пара  . Изотермы типа I и II характерны для адсорбции на не пористом адсорбенте, а типа III и IV – на пористом твердом теле. Изотерма типа III (ступенчатая) отражает послойное заполнение поверхности молекулами адсорбата. Поверхностная активность характеризует природу растворённого в-ва и определяет знак гиббсовской адсорбции,чем сильнее уменьшается поверхностное натяжение с ростом концетрации, тем выше поерхностная активность в-ва. Это сила, удерживающая в-ва на поверхности, рассчитанная на единицу гиббсовской адсорбции.( . Изотермы типа I и II характерны для адсорбции на не пористом адсорбенте, а типа III и IV – на пористом твердом теле. Изотерма типа III (ступенчатая) отражает послойное заполнение поверхности молекулами адсорбата. Поверхностная активность характеризует природу растворённого в-ва и определяет знак гиббсовской адсорбции,чем сильнее уменьшается поверхностное натяжение с ростом концетрации, тем выше поерхностная активность в-ва. Это сила, удерживающая в-ва на поверхности, рассчитанная на единицу гиббсовской адсорбции.(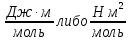 ) ) 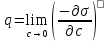 .Каким процессом является адсорбция, экзотермическим или эндотермическим? Процесс адсорбции протекает самопроизвольно, поэтому он сопровождается убылью энергии Гиббса (∆G < 0). Энтропия системы при адсорбции также уменьшается (∆S < 0), так как беспорядочно двигающиеся молекулы закрепляются в поверхностном слое. Адсорбция – это процесс экзотермический (∆Н < 0). Выделяющееся при адсорбции тепло, называется теплотой адсорбции. Процесс адсорбции всегда протекает до состояния адсорбционного равновесия, при котором скорость процесса адсорбции (Vад.) становится равной скорости процесса десорбции (Vдес.). повышение температуры будет уменьшать величину адсорбции Адсорбционное равновесие – скорость адсорбции равна скорости десорбции. В этом состоянии количество адсорбированных молекул остается постоянным сколь угодно долго, если неизменны внешние условия.Основными видами зависимости адсорбции являются:Изотерма - выражает зависимость количества адсорбированного вещества от равновесного давления (или концентрации) при постоянстве температуры А = ƒ(Р)Т или А = ƒ(С)Т Изобара - выражает зависимость количества адсорбированного вещества от температуры при постоянстве давления А = ƒ(Т)Р. Изопикна - выражает зависимость количества адсорбированного вещества от температуры при постоянном значении концентрации А = ƒ(Т)С. Изостера - выражает зависимость равновесного давления (или концентрации) от температуры при постоянстве количества адсорбированного вещества Р = ƒ(Т)А или С = ƒ(Т)А. теории полимолекулярной адсорбции БЭТ Брунауэр, Эммет, Теллер Адсорбция многослойна, на поверхности адсорбента имеется определенное число активных центров, адсорбция обусловлена физическими силами, действующими между адсорбентом и адсорбатом, каждая молекула первого слоя представляет собой активный центр для дальнейшей адсорбции, что приводит к образованию второго, третьего и т.д. При этом построение последующих слоев возможно при незаполненном первом слое, Первый слой адсорбата образуется в результате действия сил Ван-дерВаальса между адсорбентом и адсорбатом, а последующие в результате конденсации пара, Взаимодействие соседних адсорбированных молекул в первом и последующих слоях отсутствует. уравнение изотермы полимолекулярной адсорбции паров – уравнение БЭТ .Каким процессом является адсорбция, экзотермическим или эндотермическим? Процесс адсорбции протекает самопроизвольно, поэтому он сопровождается убылью энергии Гиббса (∆G < 0). Энтропия системы при адсорбции также уменьшается (∆S < 0), так как беспорядочно двигающиеся молекулы закрепляются в поверхностном слое. Адсорбция – это процесс экзотермический (∆Н < 0). Выделяющееся при адсорбции тепло, называется теплотой адсорбции. Процесс адсорбции всегда протекает до состояния адсорбционного равновесия, при котором скорость процесса адсорбции (Vад.) становится равной скорости процесса десорбции (Vдес.). повышение температуры будет уменьшать величину адсорбции Адсорбционное равновесие – скорость адсорбции равна скорости десорбции. В этом состоянии количество адсорбированных молекул остается постоянным сколь угодно долго, если неизменны внешние условия.Основными видами зависимости адсорбции являются:Изотерма - выражает зависимость количества адсорбированного вещества от равновесного давления (или концентрации) при постоянстве температуры А = ƒ(Р)Т или А = ƒ(С)Т Изобара - выражает зависимость количества адсорбированного вещества от температуры при постоянстве давления А = ƒ(Т)Р. Изопикна - выражает зависимость количества адсорбированного вещества от температуры при постоянном значении концентрации А = ƒ(Т)С. Изостера - выражает зависимость равновесного давления (или концентрации) от температуры при постоянстве количества адсорбированного вещества Р = ƒ(Т)А или С = ƒ(Т)А. теории полимолекулярной адсорбции БЭТ Брунауэр, Эммет, Теллер Адсорбция многослойна, на поверхности адсорбента имеется определенное число активных центров, адсорбция обусловлена физическими силами, действующими между адсорбентом и адсорбатом, каждая молекула первого слоя представляет собой активный центр для дальнейшей адсорбции, что приводит к образованию второго, третьего и т.д. При этом построение последующих слоев возможно при незаполненном первом слое, Первый слой адсорбата образуется в результате действия сил Ван-дерВаальса между адсорбентом и адсорбатом, а последующие в результате конденсации пара, Взаимодействие соседних адсорбированных молекул в первом и последующих слоях отсутствует. уравнение изотермы полимолекулярной адсорбции паров – уравнение БЭТ  . где А – количество адсорбированного пара при равновесном давлении (Р) в окружающей среде; Рs – давление насыщенных паров; . где А – количество адсорбированного пара при равновесном давлении (Р) в окружающей среде; Рs – давление насыщенных паров; 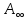 – количество пара, адсорбированного в виде насыщенного монослоя; С – постоянная, характеризующая энергию взаимодействия в адсорбционном слое. Основные типы изотерм при полимолекулярной адсорбции – количество пара, адсорбированного в виде насыщенного монослоя; С – постоянная, характеризующая энергию взаимодействия в адсорбционном слое. Основные типы изотерм при полимолекулярной адсорбции и уравнение БЭТ переходит в уравнение Ленгмюра и уравнение БЭТ переходит в уравнение Ленгмюра 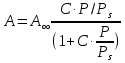 При Р → 0 уравнение БЭТ переходит в изотерму Генри При Р → 0 уравнение БЭТ переходит в изотерму Генри 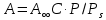 . Ограничения теории БЭТ Теория не учитывает энергетической неоднородности поверхности, Относительное давление должно быть 0,05 < . Ограничения теории БЭТ Теория не учитывает энергетической неоднородности поверхности, Относительное давление должно быть 0,05 < 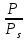 < 0,3, Теорию используют только для описания адсорбции паров; она неприменима к адсорбции газов, Теория предполагает постоянство общей площади для каждого слоя, однако на самом деле площадь уменьшается по мере увеличения числа слоев, Теория предполагает постоянство площади, приходящейся на одну молекулу в поверхностном слое, и не учитывает возможных изменений агрегатного состояния поверхностного слоя. расчёт удельной поверхности адсорбента ? используют в линейной форме < 0,3, Теорию используют только для описания адсорбции паров; она неприменима к адсорбции газов, Теория предполагает постоянство общей площади для каждого слоя, однако на самом деле площадь уменьшается по мере увеличения числа слоев, Теория предполагает постоянство площади, приходящейся на одну молекулу в поверхностном слое, и не учитывает возможных изменений агрегатного состояния поверхностного слоя. расчёт удельной поверхности адсорбента ? используют в линейной форме 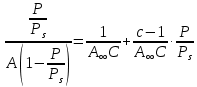 , строят , строят  =f( =f(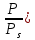 , ОД= , ОД= , а= , а= , b= , b=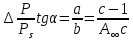 Из этих значений находят величину Из этих значений находят величину 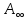 , а зная ее, рассчитывают удельную поверхность адсорбента , а зная ее, рассчитывают удельную поверхность адсорбента 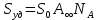 . Иониты - вещества, способные обмениваться ионами с растворами электролитов. Коллоидная химия – раздел физической химии, в котором рассматриваются процессы образования и разрушения дисперсных систем, а также их характерные свойства, связанные в основном с поверхностными явлениями на границе раздела фаз Гетерофазность – качественный признак объектов коллоидной химии, который указывает на наличие межфазной поверхности, поверхностного слоя – основного объекта изучения коллоидной химии. Дисперсность (раздробленность) – количественный признак, который определяется линейными размерами частиц дисперсной фазы «а», степенью дисперсности «D» и удельной поверхностью «Sуд». Наиболее универсален – дисперсность. количественные характеристики дисперсности. то есть мерой раздробленности дисперсной системы: удельная поверхность, дисперсность и кривизна поверхности. Удельная поверхность ( Sуд ) -отношение суммарной площади поверхности (Sсум) всех частиц дисперсной фазы к их суммарному объему (V) или массе (m). Она характеризует поверхность, приходящуюся на 1 м2 вещества дисперсной фазы. . Иониты - вещества, способные обмениваться ионами с растворами электролитов. Коллоидная химия – раздел физической химии, в котором рассматриваются процессы образования и разрушения дисперсных систем, а также их характерные свойства, связанные в основном с поверхностными явлениями на границе раздела фаз Гетерофазность – качественный признак объектов коллоидной химии, который указывает на наличие межфазной поверхности, поверхностного слоя – основного объекта изучения коллоидной химии. Дисперсность (раздробленность) – количественный признак, который определяется линейными размерами частиц дисперсной фазы «а», степенью дисперсности «D» и удельной поверхностью «Sуд». Наиболее универсален – дисперсность. количественные характеристики дисперсности. то есть мерой раздробленности дисперсной системы: удельная поверхность, дисперсность и кривизна поверхности. Удельная поверхность ( Sуд ) -отношение суммарной площади поверхности (Sсум) всех частиц дисперсной фазы к их суммарному объему (V) или массе (m). Она характеризует поверхность, приходящуюся на 1 м2 вещества дисперсной фазы. 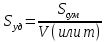 для сферической формы для сферической формы 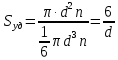 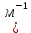 ), ), 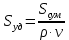 = =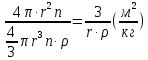 для кубической формы для кубической формы  , , 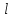 -длина ребра . Дисперсность (D) – это величина обратная поперечному размеру частиц дисперсной фазы «а», то есть -длина ребра . Дисперсность (D) – это величина обратная поперечному размеру частиц дисперсной фазы «а», то есть 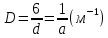  Чем меньше размер частиц, тем больше дисперсность. Кривизна поверхности (Н) – это отклонение поверхности от плоскости. Она определяется производной площади поверхности по объему Чем меньше размер частиц, тем больше дисперсность. Кривизна поверхности (Н) – это отклонение поверхности от плоскости. Она определяется производной площади поверхности по объему  Если кривизна поверхности имеет сферическую форму, то она равна Если кривизна поверхности имеет сферическую форму, то она равна  , где r – радиус кривизны поверхности Для нити цилиндрической формы кривизна поверхности равна , где r – радиус кривизны поверхности Для нити цилиндрической формы кривизна поверхности равна  . Если центр радиуса кривизны находится внутри тела, то кривизна – положительная, вне тела – отрицательная. . Если центр радиуса кривизны находится внутри тела, то кривизна – положительная, вне тела – отрицательная.классификации дисперсных систем.1. по агрегатному состоянию дисперсионной среды и дисперсной фазы. 2. по фракционному составу частиц дисперсной фазы-моно и полидисперсные. 3. Классификация по характеру взаимодействия частиц дисперсной фазы между собой. Свободнодисперсные системы, связнодисперсные системы. 4. Классификация дисперсных систем по виду дисперсной фазы. Если в качестве частиц дисперсной фазы выступают мембраны, нити, волокна, то в основу их классификации положено число размеров, которые определяют дисперсность. 5.Классификация по размерам частиц дисперсной фазы свободнодисперсных систем Различают: высокодисперсные системы (ультрамикрогетерогенные), размер частиц 10-9 – 10-7 м; микрогетерогенные системы, 10-7 – 10-5м; грубодисперсные системы, более 10-5 м. 6. Связнодисперсные системы классифицируют по размеру пор дисперсной фазы на: микропористые до 2 нм; мезопористые от 2 до 20 нм; макропористые более 20 нм. По однородности пор их делят на: однородные; разнородные. По жесткости структуры на:жесткие; набухающие. 7. Классификация по характеру взаимодействия между частицами дисперсной фазы и дисперсионной средой: лифильные и лиофобные 8.По методам их получения: диспергирование, конденсация, самопроизвольное диспергирование ,метод пептизации. на границе раздела фаз: масло – вода и вода – воздух? Если такие дифильные вещества находятся в воде, то термодинамически выгодно, чтобы они концентрировались на поверхности раздела фаз и имели при этом определенную ориентацию: неполярная гидрофобная углеводородная цепь (хвосты ПАВ) должны быть обращены к неполярной фазе (воздуху), а полярная гидрофильная часть – к полярной (водной) фазе.Если 1800>θ>900 поверхность по отношению к жидкости, нанесенной на нее, называется лиофобной (жидкость вода - поверхность называется гидрофобной). Если жидкость “масло”, то поверхность называется олеофобной. Под термином «вода» понимается любая полярная жидкость, в том числе и вода. Под термином «масло» понимается любая неполярная жидкость.Для любых жидких фаз, полярных и неполярных, работа когезии будет равна:Wk = 2σж-г , а в общем случае Wk = 2σ, где σ – поверхностное натяжение на границе с воздухом. Коэффициент 2 означает образование двух новых поверхностей. Применительно к идеально твердому телу величину Wk называют прочность на разрыв. Шишковского: σ = σО - Вln(1 + К·с), где В = А∞RT – это константа, одинаковая для всех членов одного гомологического ряда К – это константа адсорбционного равновесия,характеризующая сродство адсорбата к адсорбенту. К n + 1 /Kn = З,0 – 3,5. Данное строение насыщенного монослоя объясняет постоянство параметра В = А∞RT в уравнении Шишковского. Так как в пределах одного гомологического ряда площадь So(ПАВ) является постоянной и определяется размером полярной группы. Если из водного раствора нужно адсорбировать органические Следует выбрать неполярный адсорбент. Для получения абсолютного спирта, Для извлечения примеси воды необходимо выбрать полярный адсорбент.Лапласа Для поверхностей неправильной формы применяют уравнения Юнга- Лапласа: Δp =σж-г , где r1 и r2 - радиусы кривизны двух главных нормальных сечений поверхности. Если они направлены внутрь жидкости, то они будут положительны. Таким образом, из уравнения Лапласа следует, что фазы, разделенные искривленной поверхностью, могут находиться в равновесии только при разных давлениях внутри фаз. В фазе, имеющей положительную кривизну, давление меньше, чем давление внутри фазы с отрицательной кривизной. Разность давлений в фазах, разделенных искривленной поверхностью, называют капиллярным давлением (ΔР). Дополнительное давление, обусловленное кривизной, всегда направлено к центру кривизны. вывод уравнения Лапласа изменение энергии Гельмгольца для всей системы будет равно:  , где p1,2-давление в жидкой и газообразной фазе. При равновесии между фазами dA = 0, тогда (p2 – p1) ·dV = , где p1,2-давление в жидкой и газообразной фазе. При равновесии между фазами dA = 0, тогда (p2 – p1) ·dV = 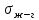 ·dS, т.е. Δp·dV= ·dS, т.е. Δp·dV=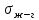 ·dS . Выразим из этого уравнения Δp: ΔP = σг-ж· ·dS . Выразим из этого уравнения Δp: ΔP = σг-ж· уравнение Лапласа, где уравнение Лапласа, где  - кривизна поверхности с радиусом кривизны r, a ΔР = ( Р2 - Р1 ) – капиллярное давление. Уравнение Лапласа для поверхности раздела фаз со сферической кривизной имеет вид: - кривизна поверхности с радиусом кривизны r, a ΔР = ( Р2 - Р1 ) – капиллярное давление. Уравнение Лапласа для поверхности раздела фаз со сферической кривизной имеет вид: 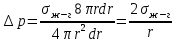 ∆р=± ∆р=±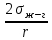 – уравнение Лапласа, отражающее влияние кривизны поверхности на внутреннее давление в фазах. Чем больше межфазное натяжение, тем значительнее влияние кривизны.● p2 > p1 (кривизна отрицательная), – уравнение Лапласа, отражающее влияние кривизны поверхности на внутреннее давление в фазах. Чем больше межфазное натяжение, тем значительнее влияние кривизны.● p2 > p1 (кривизна отрицательная), > 0, Δp> 0, то есть давление в фазе 2 больше, чем в фазе 1 на величину > 0, Δp> 0, то есть давление в фазе 2 больше, чем в фазе 1 на величину 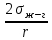 р2 < р1 ( кривизна поверхности положительная) , р2 < р1 ( кривизна поверхности положительная) , < 0, Δp < 0,, то есть давление в фазе 1 больше, чем давление в фазе 2 на величину < 0, Δp < 0,, то есть давление в фазе 1 больше, чем давление в фазе 2 на величину 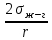 поверхность раздела фаз плоская поверхность раздела фаз плоская  = 0 и Δp = 0, то есть давление в фазах одинаково. Кривизна поверхности отрицательная в том случае, когда центр радиуса кривизны находится вне жидкой фазы. Если центр радиуса кривизны находится внутри жидкой фазы, то она положительная. Для цилиндрической поверхности длиной l и радиусом r: Δp = ± = 0 и Δp = 0, то есть давление в фазах одинаково. Кривизна поверхности отрицательная в том случае, когда центр радиуса кривизны находится вне жидкой фазы. Если центр радиуса кривизны находится внутри жидкой фазы, то она положительная. Для цилиндрической поверхности длиной l и радиусом r: Δp = ± Для поверхностей неправильной формы применяют уравнения Юнга- Лапласа Δp = Для поверхностей неправильной формы применяют уравнения Юнга- Лапласа Δp = 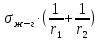 . Разность давлений в фазах, разделенных искривленной поверхностью, называют капиллярным давлением (∆Р). особенности адсорбции ПАВ на твердой поверхности? поверхность твердого тела, в отличие от поверхности жидкости, имеет сложный, неоднородный характер; адсорбция происходит не на всей поверхности, а лишь на активных центрах; адсорбция кинетически обратима – наряду с адсорбцией происходит десорбция; адсорбция может быть и физической и химической; поверхность адсорбента часто бывает пористой, поэтому полимолекулярная адсорбция сопровождается капиллярной конденсацией; адсорбция зависит от равновесного давления, температуры, природы твердого адсорбента и пара (или газа). Какая поверхность будет лучше смачиваться водой: стекла или фторопласта? Вода (σ=73,0 мДж/м2) занимает промежуточное положение, смачивая металлы, стекло, многие минералы и т.д., но не смачивая поверхности неполярных веществ – воска, парафина, фторопласта. Броуновское движение приводит к диффузионному переносу частиц дисперсной фазы из области с высокой концентрации частиц в область с их более низкой концентрацией, более равномерному распределению частиц по всему объёму дисперсной системы и повышению энтропии системы. Броуновское движение обусловлено столкновением молекул жидкости или газа с частицами, взвешенными в ней. интенсивность движения частиц Скорость диффузии и интенсивность броуновского движения частиц дисперсной фазы характеризуется значением коэффициента диффузии D, связанного с радиусом r частиц, вязкостью дисперсионной среды η и энергией теплового движения kT. Основными законами диффузии являются законы Фика. Согласно первому закону Фика диффузионный поток равен: . Разность давлений в фазах, разделенных искривленной поверхностью, называют капиллярным давлением (∆Р). особенности адсорбции ПАВ на твердой поверхности? поверхность твердого тела, в отличие от поверхности жидкости, имеет сложный, неоднородный характер; адсорбция происходит не на всей поверхности, а лишь на активных центрах; адсорбция кинетически обратима – наряду с адсорбцией происходит десорбция; адсорбция может быть и физической и химической; поверхность адсорбента часто бывает пористой, поэтому полимолекулярная адсорбция сопровождается капиллярной конденсацией; адсорбция зависит от равновесного давления, температуры, природы твердого адсорбента и пара (или газа). Какая поверхность будет лучше смачиваться водой: стекла или фторопласта? Вода (σ=73,0 мДж/м2) занимает промежуточное положение, смачивая металлы, стекло, многие минералы и т.д., но не смачивая поверхности неполярных веществ – воска, парафина, фторопласта. Броуновское движение приводит к диффузионному переносу частиц дисперсной фазы из области с высокой концентрации частиц в область с их более низкой концентрацией, более равномерному распределению частиц по всему объёму дисперсной системы и повышению энтропии системы. Броуновское движение обусловлено столкновением молекул жидкости или газа с частицами, взвешенными в ней. интенсивность движения частиц Скорость диффузии и интенсивность броуновского движения частиц дисперсной фазы характеризуется значением коэффициента диффузии D, связанного с радиусом r частиц, вязкостью дисперсионной среды η и энергией теплового движения kT. Основными законами диффузии являются законы Фика. Согласно первому закону Фика диффузионный поток равен: 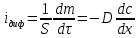 , где iдиф – поток диффузии, равный количеству вещества, проходящего за 1 с через единицу площади сечения S; D – коэффициент диффузии, (м2.с-1); , где iдиф – поток диффузии, равный количеству вещества, проходящего за 1 с через единицу площади сечения S; D – коэффициент диффузии, (м2.с-1);  –градиент концентрации, то есть изменение концентрации вещества, отнесенное к единице расстояния; dm – количество продиффундировавшего вещества. уравнение Стокса –градиент концентрации, то есть изменение концентрации вещества, отнесенное к единице расстояния; dm – количество продиффундировавшего вещества. уравнение Стокса  , ,  Fтр. = В·U , где В – коэффициент трения (гидродинамического сопротивления среды), В = 6π·η·r и Fтр. = 6π·η·r·U, где r – радиус частицы дисперсной фазы, м; U – скорость движения, U = dH/dτ, м·с.-1 . Движение частицы в начальный момент равноускоренное со временем становится равномерным. В этом случае обе силы (трения и тяжести) равны друг другу, то есть: Fтр. = В·U , где В – коэффициент трения (гидродинамического сопротивления среды), В = 6π·η·r и Fтр. = 6π·η·r·U, где r – радиус частицы дисперсной фазы, м; U – скорость движения, U = dH/dτ, м·с.-1 . Движение частицы в начальный момент равноускоренное со временем становится равномерным. В этом случае обе силы (трения и тяжести) равны друг другу, то есть:  выразим скорость оседания частицы: выразим скорость оседания частицы:  вычислить радиус частицы: вычислить радиус частицы:  Для данной дисперсной фазы и дисперсионной среды величины η, p и p0 будут постоянными. Тогда Для данной дисперсной фазы и дисперсионной среды величины η, p и p0 будут постоянными. Тогда 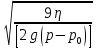 = const = K и r = K = const = K и r = K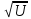 Учитывая, что скорость оседания частицы определяется отношением пройденного расстояния Н ко времени τ, то скорость U = H/τ. Радиус, осевших частиц, будет равен: r = K Учитывая, что скорость оседания частицы определяется отношением пройденного расстояния Н ко времени τ, то скорость U = H/τ. Радиус, осевших частиц, будет равен: r = K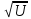 или r = или r =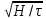 . Если p > p0, то происходит оседание частиц, если же p < p0, то – всплывание, при p = p0 седиментация происходить не будет. Чем выше степень дисперсности, тем больше и седиментационная устойчивость. Скорость седиментации будет уменьшаться в средах с повышенной вязкостью, а, следовательно, это приведет к повышению устойчивости дисперсной системы. Диффузия- молекулы перемещаются из области высокой концентрации в область более низкой концентрации. Зависит от: концентрации, температуры, массы частиц, св-ва растворителя. Если разница в концентрации выше, то молекулы будут снижаться градиент концентрации быстрее, если разница в концентрации не так велика, молекулы не будут двигаться так быстро, и скорость диффузии уменьшится. По мере повышения температуры кинетическая энергия, связанная с каждой частицей, также увеличивается, в результате частицы будут двигаться быстрее, если они могут двигаться быстрее, то они также могут распространяться быстрее. Более тяжелые частицы будут двигаться медленнее и, следовательно, будут иметь меньшую скорость диффузии, с другой стороны, более мелкие частицы будут диффундировать быстрее, потому что они могут двигаться быстрее. Вязкость и плотность сильно влияют на диффузию, если среда, через которую должна распространяться данная частица, является очень плотной или вязкой, то частице будет труднее диффундировать через нее. Коэффициент диффузии D – это количество вещества, продиффундировавшего через единицу площади в единицу времени . Если p > p0, то происходит оседание частиц, если же p < p0, то – всплывание, при p = p0 седиментация происходить не будет. Чем выше степень дисперсности, тем больше и седиментационная устойчивость. Скорость седиментации будет уменьшаться в средах с повышенной вязкостью, а, следовательно, это приведет к повышению устойчивости дисперсной системы. Диффузия- молекулы перемещаются из области высокой концентрации в область более низкой концентрации. Зависит от: концентрации, температуры, массы частиц, св-ва растворителя. Если разница в концентрации выше, то молекулы будут снижаться градиент концентрации быстрее, если разница в концентрации не так велика, молекулы не будут двигаться так быстро, и скорость диффузии уменьшится. По мере повышения температуры кинетическая энергия, связанная с каждой частицей, также увеличивается, в результате частицы будут двигаться быстрее, если они могут двигаться быстрее, то они также могут распространяться быстрее. Более тяжелые частицы будут двигаться медленнее и, следовательно, будут иметь меньшую скорость диффузии, с другой стороны, более мелкие частицы будут диффундировать быстрее, потому что они могут двигаться быстрее. Вязкость и плотность сильно влияют на диффузию, если среда, через которую должна распространяться данная частица, является очень плотной или вязкой, то частице будет труднее диффундировать через нее. Коэффициент диффузии D – это количество вещества, продиффундировавшего через единицу площади в единицу времени 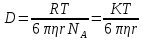 Дифференциальная кривая распределения частиц по радиусам характеризует степень полидисперсности системы, Дифференциальная кривая распределения частиц по радиусам характеризует степень полидисперсности системы, 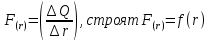 . Интегральная кривая может иметь восходящий и нисходящий в зависимости от нарастающего суммарное Qо,% содержание частиц . Интегральная кривая может иметь восходящий и нисходящий в зависимости от нарастающего суммарное Qо,% содержание частиц 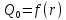 . Это можно сделать с использованием уравнения . Это можно сделать с использованием уравнения  с помощь интегральной кривой определяют процентное содержание фракций. увеличить скорость Важным фактором устойчивости также является и степень дисперсности частиц. Чем выше степень дисперсности, тем больше и седиментационная устойчивость. Скорость седиментации будет уменьшаться в средах с повышенной вязкостью, а, следовательно, это приведет к повышению устойчивости дисперсной системы.седиментационно-диффузионным равновесиемОседание частиц дисперсной фазы называется седиментацией, а всплывание частиц – обратной седиментацией. Если между процессами седиментации и диффузии наступает равновесие, то устанавливается и определенное равновесное распределение частиц по высоте, называемое диффузионно–седиментационным равновесием. с помощь интегральной кривой определяют процентное содержание фракций. увеличить скорость Важным фактором устойчивости также является и степень дисперсности частиц. Чем выше степень дисперсности, тем больше и седиментационная устойчивость. Скорость седиментации будет уменьшаться в средах с повышенной вязкостью, а, следовательно, это приведет к повышению устойчивости дисперсной системы.седиментационно-диффузионным равновесиемОседание частиц дисперсной фазы называется седиментацией, а всплывание частиц – обратной седиментацией. Если между процессами седиментации и диффузии наступает равновесие, то устанавливается и определенное равновесное распределение частиц по высоте, называемое диффузионно–седиментационным равновесием. 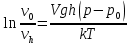 Лапласа – Перрена: , где νо и νh – численная концетрация на исходном уровне (h=0) и на высоте h, м –3 ; V – объем, занимаемый частицей дисперсной фазы, м3 ; ρ и ρо – плотности дисперсной фазы и дисперсионной среды соответственно, кг*м –3 . Это гипсометрический закон (hypsos – высота) и позволяет определить высоту, на которой концентрация частиц дисперсной фазы уменьшается в νо/νh раз.поверхность волокон смоченной водой фильтровальной бумаги? Поверхность волокон приобретет отрицательный заряд, вода имеет очень большую диэлектрическую проницаемость. Электроккин Потенциал, возникающий в ДЭС на плоскости скольжения при отрыве части диффузного слоя. Выберите для гидрозоля с положительно заряженными коллоидными частицами коагулянта. По правилу знака заряда: ионом коагулянтом являются ионы, имеющие противоположные знак заряду коллоидной частицы, то есть в данном случае это анионы. По правилу значности наибольшую коагулирующую способность будет иметь PO43-, так как его заряд равен 3-, что большее среди предложенных, значит порог коагуляции(который обратно пропорционален коагулирующей способности) будет наименьшим Что такое электрофоре Электрофорез – это направленное движение заряженных частиц дисперсной фазы относительно дисперсионной среды в постоянном электрическом поле. Потенциал оседания (седиментационный потенциал) – явление, противоположное электрофорезу, возникает при оседании частиц под действием силы тяжести. Электроосмос – это направленное движение дисперсионной среды относительно твердой поверхности в капиллярах и пористых телах (в том числе в фильтрах и мембранах) под действием внешнего электрического поля. U – образную стеклянную трубку заполняли водой, в её нижнюю часть помещали кварцевый песок. В воду опускали положительный и отрицательный электроды. После подачи напряжения вода поднималась к катоду. Потенциал течения (потенциал протекания) – явление противоположное электроосмосу. Оно заключается в том, что при течении воды (или другой жидкости) через пористую мембрану (или фильтр) на концах пористого тела возникает разность электрических потенциалов. Такой же эффект наблюдается при течении жидкости по стеклянному капилляру.Причиной электрофореза и электроосмоса является действие на дисперсную систему внешней разности потенциалов, которая приводит к относительному перемещению фаз. Они получили название электрокинетических явлений I – го рода.Причиной возникновения потенциалов течения и оседания является относительное перемещение фаз, поэтому их относят к электрокинетическим явлениям II – го рода. Почему лиофильные системы лиофильные системы - термодинамически устойчивые, поэтому они самопроизвольно диспергируются, и из-за этого обладают агрегативной устойчивостью.Можно разрушить при введении в систему электролитов-коагулянтов. Почему лиофобные дисперсные Лиофобные системы термодинамически неустойчивы, потому что имеют большую поверхностное натяжение, поэтому имеют избыточную поверхностную энергию ΔG>>0. Нейтрализационная коагуляция наблюдается у золей со слабо заряженными частицами, которые обладают низкими значениями φ0-потенциала. В этом случае коагуляция происходит в результате снижения электрического заряда частиц из-за уменьшения по тем или иным причинам адсорбции потенциалопределяющих ионов. Концетрационная коагуляция характерна для золей с сильно заряженными частицами. При этой коагуляции потеря устойчивости связана не с падением φо-патенциала, а сжатием диффузной части двойного электричекого слоя при увеличении концентрации ионов индифферентных электролитов в растворе и уменьшением абсолютного значения ζ-потенциала. По правилу знака заряда ионами коагуляторами являются катионы, тогда электролитом коагулянтом может быть Mg(NO3)2. закономерности наблюдаются a) Аддитивное действие Электролиты действуют независимо один от другого, их суммарное действие складывается из воздействия каждого из электролитов: Yсум= ск1+ ск2 b) б)Синергизм действия Электролиты способствуют коагулирующему действию друг другу, и для коагуляции их требуется меньше, чем нужно по правилу аддитивности.c) Антагонизм действия Электролиты противодействуют друг другу, и для коагуляции их следует добавить больше, чем требуется по правилу аддитивности. Какова природа сил притяжения Молекулярные силы притяжения Uм(h). Притяжение между частицами обусловлено силами Ван-дер-Ваальса, включающие три составляющие: ориентационное, индукционное и дисперсионное взаимодействия. Ориентационное и индукционное взаимодействие являются коротко действующими. Из сил Ван-дер-Ваальса наиболее универсальным является дисперсионное взаимодействие. Это взаимодействие действует всегда. Оно является аддитивным и слабо экранируемым. Последнее объясняется тем, что взаимодействие двух молекул друг с другом не зависит от присутствия других молекул. электростатического отталкивания Электростатические силы отталкивания Uэ(h) обусловлены наличием на поверхности частиц двойного электрического слоя (ДЭС) и возникают при перекрывании диффузных слоев противоионов двух сближающихся мицелл. Гетерокоагуляция – слипание различных по природе частиц, которые отличаются знаком и величиной поверхностного заряда. Взаимную коагуляцию разноименно заряженных частиц широко используют в процессах водоподготовки и очистки природных и сточных вод. способы получения дисперсных систем. Диспергирование(дробление), конденсация, самопроизвольное диспергирование(в результате теплового движения частиц) , метод пиптизации(растворение осадков и переходом в коллоидное состояние)Релаксационный эффект. Уменьшение скорости электрофореза, обусловленное нарушением симметрии диффузного слоя при движении фаз в противоположные стороны. Электрофоретическое торможение. Уменьшение электрофоретической скорости, обусловленное сопротивлением движению частицы обратным потоком противоионов, который увлекает за собой жидкость. Поверхностная проводимость χS. Приращение проводимости раствора в капилляре, обусловленное наличием ДЭС, благодаря чему общая проводимость может быть в несколько раз больше объемной проводимости (χV). устойчивостью дисперсной системы неизменность во времени ее основных параметров: степени дисперсности и равномерного распределения частиц дисперсной фазы в дисперсионной среде- кинетическую (седиментационную), агрегативную, фазовую и поверхностную. Светорассеяние в истинных растворах обусловлено флуктуацией концентраций и плотностей раствора.Рассеяние света дисперсной системой, состоящей из множества частиц, существенно отличается от рассеяния света одиночными частицами. Это отличие обусловлено: интерференцией волн, рассеянных одиночными частицами; многократным рассеянием, которое наблюдается, когда свет, рассеянный одними частицами, повторно рассеивается другими; перемещением частиц. оптической плотность Она характеризует ослабление луча света при его распространении в веществе. При рассмотрении отдельных частиц, когда их размер больше длины волны, оптическая плотность обусловлена лишь поглощением света. Каковы особенности рассеяния света для малых и больших частиц дисперсной фазы? Если частицы малы по сравнению с длиной волны, то больше всего света рассеивается под углами 0 и 180 к лучу, падающему на частицу.С увеличением размера частиц максимальное количество светарассеивается в направлении падающего света Ми угловое распределение света частиц различной величины Бугера-Ламберта-Бера? Зависимость интенсивности прошедшего света от толщины слоя и концентрации растворенного вещества гиббсовскими и ленгмюровскими адсорбционными слоями. ПАВ при адсорбции ориентируются определенным образом. Адсорбция ПАВ происходит в соответствии с правилом уравнивания полярностей. Гиббсовские адсорбционные слои - Адсорбционный монослой на границе раздела фаз формируется в результате перехода ПАВ из объемной фазы в поверхностный слой Ленгмюровские ад. слои - возникают при непосредственном нанесении ПАВ на поверхность, с последующим их растеканием. применимы понятия фаза и гетерогенность? Данные понятия применимы к коллоидно -дисперсным системам наличии или отсутствии в них взаимодействия между частицами дисперсной фазы? Свободнодисперсные Связнодисперсные системы разрыв тела и отнесенная к единице площади сечения? Работа когезии – это работа разрыва однородной объѐмной фазы, отнесенная к единице площади разрыва.Применительно к идеально твердому телу величину Wk называют прочность на разрыв.водой < 900, >900 и равный нулю Поверхность с краевым углом смачивания водой меньше 90 наз. Гидрофильной, более 90 гидрофобнойинверсия смачивание Это изменение краевого угла смачивания при адсорбции ПАВ на поверхности, так как при адсорбции молекулы ПАВ ориентируются таким образом, что меняют поверхность адсорбента Что такое обменная адсорбция обмен ионов между двойным электрическим слоем адсорбента и средой. При контакте ионита с раствором электролита по истечении некоторого времени установится равновесие между концентрациями ионов в ионите и в растворе, называемое ионообменным равновесием.отличаются коллоидные ПАВ Истиннорастворимые. К ним относятся вещества, добавление которых в гетерогенную систему уменьшает поверхностное натяжение на границе раздела фаз. Коллоидные. Эти ПАВ способны самопроизвольно при определенной концентрации, называемой критической концентрацией мицеллообразования (ККМ), в объеме раствора объединяться в мицеллы – наноразмерные дисперсные частицы, то есть при ККМ раствор из гомогенного переходит в гетерогенное состояние. Солюбилизацией самопроизвольное растворение мицеллярной фазой ПАВ веществ (твердых, жидких и газообразных), незначительно растворимых в обычных условиях в дисперсионной среде, с образованием термодинамически стабильного изотропного раствора. Явление мицеллярного катализа обусловлено изменением концентраций и реагентов вследствие связывания их мицеллами, а также влиянием мицелл на константы скорости и равновесия, вследствие изменения "микроокружения" реагентов по сравнению с водной фазой. Диализ − метод очистки коллоидных растворов от низкомолекулярных примесей, основанный на различной скорости диффузии их через полупроницаемую мембрану. Молекулы и ионы проходят через мембрану, отделяющую коллоидный раствор (золь) от чистого растворителя, а коллоидные частицы нет. Лапласа – Перрена: , где νо и νh – численная концетрация на исходном уровне (h=0) и на высоте h, м –3 ; V – объем, занимаемый частицей дисперсной фазы, м3 ; ρ и ρо – плотности дисперсной фазы и дисперсионной среды соответственно, кг*м –3 . Это гипсометрический закон (hypsos – высота) и позволяет определить высоту, на которой концентрация частиц дисперсной фазы уменьшается в νо/νh раз.поверхность волокон смоченной водой фильтровальной бумаги? Поверхность волокон приобретет отрицательный заряд, вода имеет очень большую диэлектрическую проницаемость. Электроккин Потенциал, возникающий в ДЭС на плоскости скольжения при отрыве части диффузного слоя. Выберите для гидрозоля с положительно заряженными коллоидными частицами коагулянта. По правилу знака заряда: ионом коагулянтом являются ионы, имеющие противоположные знак заряду коллоидной частицы, то есть в данном случае это анионы. По правилу значности наибольшую коагулирующую способность будет иметь PO43-, так как его заряд равен 3-, что большее среди предложенных, значит порог коагуляции(который обратно пропорционален коагулирующей способности) будет наименьшим Что такое электрофоре Электрофорез – это направленное движение заряженных частиц дисперсной фазы относительно дисперсионной среды в постоянном электрическом поле. Потенциал оседания (седиментационный потенциал) – явление, противоположное электрофорезу, возникает при оседании частиц под действием силы тяжести. Электроосмос – это направленное движение дисперсионной среды относительно твердой поверхности в капиллярах и пористых телах (в том числе в фильтрах и мембранах) под действием внешнего электрического поля. U – образную стеклянную трубку заполняли водой, в её нижнюю часть помещали кварцевый песок. В воду опускали положительный и отрицательный электроды. После подачи напряжения вода поднималась к катоду. Потенциал течения (потенциал протекания) – явление противоположное электроосмосу. Оно заключается в том, что при течении воды (или другой жидкости) через пористую мембрану (или фильтр) на концах пористого тела возникает разность электрических потенциалов. Такой же эффект наблюдается при течении жидкости по стеклянному капилляру.Причиной электрофореза и электроосмоса является действие на дисперсную систему внешней разности потенциалов, которая приводит к относительному перемещению фаз. Они получили название электрокинетических явлений I – го рода.Причиной возникновения потенциалов течения и оседания является относительное перемещение фаз, поэтому их относят к электрокинетическим явлениям II – го рода. Почему лиофильные системы лиофильные системы - термодинамически устойчивые, поэтому они самопроизвольно диспергируются, и из-за этого обладают агрегативной устойчивостью.Можно разрушить при введении в систему электролитов-коагулянтов. Почему лиофобные дисперсные Лиофобные системы термодинамически неустойчивы, потому что имеют большую поверхностное натяжение, поэтому имеют избыточную поверхностную энергию ΔG>>0. Нейтрализационная коагуляция наблюдается у золей со слабо заряженными частицами, которые обладают низкими значениями φ0-потенциала. В этом случае коагуляция происходит в результате снижения электрического заряда частиц из-за уменьшения по тем или иным причинам адсорбции потенциалопределяющих ионов. Концетрационная коагуляция характерна для золей с сильно заряженными частицами. При этой коагуляции потеря устойчивости связана не с падением φо-патенциала, а сжатием диффузной части двойного электричекого слоя при увеличении концентрации ионов индифферентных электролитов в растворе и уменьшением абсолютного значения ζ-потенциала. По правилу знака заряда ионами коагуляторами являются катионы, тогда электролитом коагулянтом может быть Mg(NO3)2. закономерности наблюдаются a) Аддитивное действие Электролиты действуют независимо один от другого, их суммарное действие складывается из воздействия каждого из электролитов: Yсум= ск1+ ск2 b) б)Синергизм действия Электролиты способствуют коагулирующему действию друг другу, и для коагуляции их требуется меньше, чем нужно по правилу аддитивности.c) Антагонизм действия Электролиты противодействуют друг другу, и для коагуляции их следует добавить больше, чем требуется по правилу аддитивности. Какова природа сил притяжения Молекулярные силы притяжения Uм(h). Притяжение между частицами обусловлено силами Ван-дер-Ваальса, включающие три составляющие: ориентационное, индукционное и дисперсионное взаимодействия. Ориентационное и индукционное взаимодействие являются коротко действующими. Из сил Ван-дер-Ваальса наиболее универсальным является дисперсионное взаимодействие. Это взаимодействие действует всегда. Оно является аддитивным и слабо экранируемым. Последнее объясняется тем, что взаимодействие двух молекул друг с другом не зависит от присутствия других молекул. электростатического отталкивания Электростатические силы отталкивания Uэ(h) обусловлены наличием на поверхности частиц двойного электрического слоя (ДЭС) и возникают при перекрывании диффузных слоев противоионов двух сближающихся мицелл. Гетерокоагуляция – слипание различных по природе частиц, которые отличаются знаком и величиной поверхностного заряда. Взаимную коагуляцию разноименно заряженных частиц широко используют в процессах водоподготовки и очистки природных и сточных вод. способы получения дисперсных систем. Диспергирование(дробление), конденсация, самопроизвольное диспергирование(в результате теплового движения частиц) , метод пиптизации(растворение осадков и переходом в коллоидное состояние)Релаксационный эффект. Уменьшение скорости электрофореза, обусловленное нарушением симметрии диффузного слоя при движении фаз в противоположные стороны. Электрофоретическое торможение. Уменьшение электрофоретической скорости, обусловленное сопротивлением движению частицы обратным потоком противоионов, который увлекает за собой жидкость. Поверхностная проводимость χS. Приращение проводимости раствора в капилляре, обусловленное наличием ДЭС, благодаря чему общая проводимость может быть в несколько раз больше объемной проводимости (χV). устойчивостью дисперсной системы неизменность во времени ее основных параметров: степени дисперсности и равномерного распределения частиц дисперсной фазы в дисперсионной среде- кинетическую (седиментационную), агрегативную, фазовую и поверхностную. Светорассеяние в истинных растворах обусловлено флуктуацией концентраций и плотностей раствора.Рассеяние света дисперсной системой, состоящей из множества частиц, существенно отличается от рассеяния света одиночными частицами. Это отличие обусловлено: интерференцией волн, рассеянных одиночными частицами; многократным рассеянием, которое наблюдается, когда свет, рассеянный одними частицами, повторно рассеивается другими; перемещением частиц. оптической плотность Она характеризует ослабление луча света при его распространении в веществе. При рассмотрении отдельных частиц, когда их размер больше длины волны, оптическая плотность обусловлена лишь поглощением света. Каковы особенности рассеяния света для малых и больших частиц дисперсной фазы? Если частицы малы по сравнению с длиной волны, то больше всего света рассеивается под углами 0 и 180 к лучу, падающему на частицу.С увеличением размера частиц максимальное количество светарассеивается в направлении падающего света Ми угловое распределение света частиц различной величины Бугера-Ламберта-Бера? Зависимость интенсивности прошедшего света от толщины слоя и концентрации растворенного вещества гиббсовскими и ленгмюровскими адсорбционными слоями. ПАВ при адсорбции ориентируются определенным образом. Адсорбция ПАВ происходит в соответствии с правилом уравнивания полярностей. Гиббсовские адсорбционные слои - Адсорбционный монослой на границе раздела фаз формируется в результате перехода ПАВ из объемной фазы в поверхностный слой Ленгмюровские ад. слои - возникают при непосредственном нанесении ПАВ на поверхность, с последующим их растеканием. применимы понятия фаза и гетерогенность? Данные понятия применимы к коллоидно -дисперсным системам наличии или отсутствии в них взаимодействия между частицами дисперсной фазы? Свободнодисперсные Связнодисперсные системы разрыв тела и отнесенная к единице площади сечения? Работа когезии – это работа разрыва однородной объѐмной фазы, отнесенная к единице площади разрыва.Применительно к идеально твердому телу величину Wk называют прочность на разрыв.водой < 900, >900 и равный нулю Поверхность с краевым углом смачивания водой меньше 90 наз. Гидрофильной, более 90 гидрофобнойинверсия смачивание Это изменение краевого угла смачивания при адсорбции ПАВ на поверхности, так как при адсорбции молекулы ПАВ ориентируются таким образом, что меняют поверхность адсорбента Что такое обменная адсорбция обмен ионов между двойным электрическим слоем адсорбента и средой. При контакте ионита с раствором электролита по истечении некоторого времени установится равновесие между концентрациями ионов в ионите и в растворе, называемое ионообменным равновесием.отличаются коллоидные ПАВ Истиннорастворимые. К ним относятся вещества, добавление которых в гетерогенную систему уменьшает поверхностное натяжение на границе раздела фаз. Коллоидные. Эти ПАВ способны самопроизвольно при определенной концентрации, называемой критической концентрацией мицеллообразования (ККМ), в объеме раствора объединяться в мицеллы – наноразмерные дисперсные частицы, то есть при ККМ раствор из гомогенного переходит в гетерогенное состояние. Солюбилизацией самопроизвольное растворение мицеллярной фазой ПАВ веществ (твердых, жидких и газообразных), незначительно растворимых в обычных условиях в дисперсионной среде, с образованием термодинамически стабильного изотропного раствора. Явление мицеллярного катализа обусловлено изменением концентраций и реагентов вследствие связывания их мицеллами, а также влиянием мицелл на константы скорости и равновесия, вследствие изменения "микроокружения" реагентов по сравнению с водной фазой. Диализ − метод очистки коллоидных растворов от низкомолекулярных примесей, основанный на различной скорости диффузии их через полупроницаемую мембрану. Молекулы и ионы проходят через мембрану, отделяющую коллоидный раствор (золь) от чистого растворителя, а коллоидные частицы нет.. |
