отчет л.1 ,эквивалент. Отчет по лабораторной работе 1 Определение эквивалентной массы метала
 Скачать 255.8 Kb. Скачать 255.8 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ Кафедра общей химии Отчет по лабораторной работе №1 «Определение эквивалентной массы метала» Выполнил: студент гр. ГС-21-1 Черниговская М.В. (шифр группы) (подпись) (Ф.И.О.) Оценка: Дата: Проверил: ____ (должность) (подпись) (Ф.И.О.) Общие сведения: Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Эквивалентной массой ЭМ называется масса одного эквивалента вещества, т.е. масса вещества и количество эквивалентов связаны уравнением: 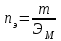 . .Для газов эквивалентным объемом называется объем, занимаемый при данных условиях одним эквивалентом вещества. Эквивалент (эквивалентную массу) можно вычислить по составу соединения данного элемента с любым другим, эквивалент (эквивалентная масса) которого известны пользуясь законом эквивалентов: вещества взаимодействуют друг с другом в эквивалентных количествах. Например, для реакции: aA + bB = cC + dD nэ(А) = nэ(B) = nэ(C) = nэ(D) или  . .Отсюда следует другая формулировка закона эквивалентов: массы взаимодействующих веществ пропорциональны их эквивалентным массам, например, На основе закона эквивалентов можно вывести общую формулу для вычисления эквивалентных масс веществ: где М – молярная масса элемента, оксида, кислоты, основания или соли, г/моль; Z – степень окисления элемента в продукте реакции, произведение числа атомов элемента и степени окисления элемента в оксидах, основность кислоты, кислотность основания, произведение числа атомов металла и степени окисления металла в соли. Цель работы: Усвоить одно из основных химических понятий – понятие об эквиваленте – и научиться определять его количественное значение.  Ход работы: 1. Наполнили водой кристаллизатор и бюретку (стеклянную трубку с делениями и пипеткой для выпуска жидкости внизу). Проверили, плотно ли закрыт кран бюретки. 2. Закрыв верхнее отверстие пальцем, перевернули бюретку и опустили её в кристаллизатор с водой. Палец убрали под водой, при этом вода из бюретки не вытекла. 3. Закрепили бюретку в штативе. (Уровень воды в ней не должен быть выше крайнего деления шкалы). 4. В колбу Вюрца (круглодонная колба с боковым отводом) при помощи мерного цилиндра отобрали 6 мл соляной кислоты. 5. Вытерли насухо горло колбы фильтром. 6. Расположив колбу горизонтально, поместили в её горло навеску металла и плотно закрыли колбу пробкой. 7. Поместили присоединенную к боковому отводу колбы Вюрца стеклянную трубку в опущенный в воду конец бюретки. 8. После этого отметили уровень жидкости в бюретке V1. 9. Затем колбу перевели в вертикальное положение, сбрасывая навеску металла в кислоту. В результате реакции выделяется водород, который вытесняет воду из бюретки. 10. Когда выделение пузырьков водорода прекратилось, отметили конечный уровень воды в бюретке V2. 11. При помощи линейки измерили высоту столба воды h в бюретке от нижнего края мениска до уровня воды в кристаллизаторе. 12. По показаниям барометра и термометра определили атмосферное давление и температуру в лаборатории. Экспериментальные данные (протокол л/р): Масса навески металла, 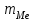 = 0,0096 г. = 0,0096 г.Объем соляной кислоты,  = 9 мл. = 9 мл.Объем воды в бюретке в начале эксперимента V1 = 19,9 мл. Объем воды в бюретке в конце эксперимента V2 = 8,5 мл. Объем выделившегося водорода,  = V1 – V2 = 11,4 мл. = V1 – V2 = 11,4 мл.Высота столба воды в бюретке h = 260 мм. Атмосферное давление в лаборатории  = 749мм. рт. ст. = 998441,7Па. = 749мм. рт. ст. = 998441,7Па.Температура в лаборатории Т = 24 °С = 297 K. Обработка результатов эксперимента: 1) Водород находится в бюретке под давлением ниже атмосферного на величину давления водяного пара, а также разрежения, создаваемого за счет давления столба жидкости в бюретке. Поэтому давление водорода вычисляют по формуле:  , где , где – давление столба воды в бюретке, Па, – давление столба воды в бюретке, Па,  = 9,8h = 9,8h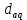 , 9,8 – переводной коэффициент из мм. вод. ст. в Па; , 9,8 – переводной коэффициент из мм. вод. ст. в Па; 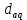 – плотность воды, равная 1 – плотность воды, равная 1  ; ;  – давление насыщенного водяного пара, которое находят по таблице: – давление насыщенного водяного пара, которое находят по таблице:
2) Массу выделившегося водорода  вычисляют по уравнению Менделеева–Клапейрона: вычисляют по уравнению Менделеева–Клапейрона:  , где , где – молярная масса водорода, 2 г/моль – молярная масса водорода, 2 г/мольV–объём водорода,  R – универсальная газовая постоянная, равная 8,314 Дж/(моль· К). 3) Вычислить эквивалентную массу металла по закону эквивалентов: 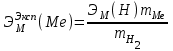 , где , где – эквивалентная масса водорода, равная 1 г/моль. – эквивалентная масса водорода, равная 1 г/моль.4) По степени окисления металла, указанной преподавателем, определить молярную массу металла. Установить, что это за металл. 5) Вычислить точное значение эквивалентной массы металла и найти относительную погрешность эксперимента  Вычисления: 1)  = 9,8 = 9,8 1000 1000  0,26 0,26 = 2695 Па = 2695 Па = 94121,2 Па = 94121,2 Па2) 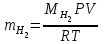 = =  г г3) 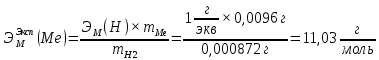 4)  , ,23 г/моль- металл Mg ЭМ теор. = 12,15 г/моль 5)   Вывод: Вывод:В ходе лабораторной работы мы усвоили и закрепили понятие об эквиваленте, выяснили, как можно определить его количественное значение. При определении значения эквивалентной массы получили погрешность равную 7,19% Санкт-Петербург 2022 |

 ,Па
,Па